造血干细胞如何从潜伏状态切换到激活状态?
在一项新的研究中,来自加拿大玛嘉烈公主癌症中心、多伦多大学和安大略省癌症研究所等研究机构的研究人员通过观察我们遗传物质中广阔的、未知的区域,揭示了造血干细胞(HSC)如何能够在我们的一生中产生新的血细胞。这些区域掌握着这些细胞中微妙生物学变化的重要线索。相关研究结果于2020年11月25日在线发表在Cell Stem Cell期刊上,论文标题为“The Transition from Quiescent to Activated States in Human Hematopoietic Stem Cells Is Governed by Dynamic 3D Genome Reorganization”。论文通讯作者为玛嘉烈公主癌症中心的Mathieu Lupien博士和John Dick博士。
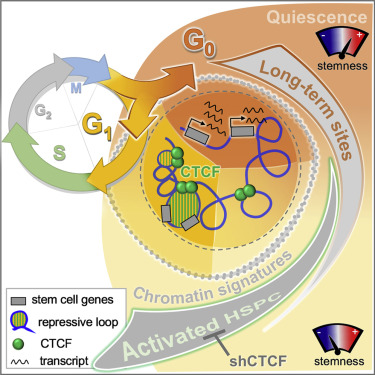
从研究正常血液中获得的这一发现可用于增强造血干细胞移植的方法,也可能为研究癌细胞在化疗后存活下来并在治疗多年后重新生长的过程提供线索。
这项研究利用最先进的测序技术对人类造血干细胞的表观遗传学景观进行全基因组剖析,揭示了基因如何通过染色质的三维折叠进行调控的重要信息。
在真核生物中,染色质存在于细胞核中,由DNA和蛋白组成,后者将DNA包装成紧凑的结构。染色质结构的变化与DNA复制、修复和基因表达(开启或关闭基因)有关。
Dick博士说,“我们对造血干细胞以特定方式发挥作用的原因或使它发挥作用的原因没有一个全面的看法。造血干细胞通常处于休眠状态,但它们偶尔需要被激活以维持血液系统的运转。了解这种激活过程是能够利用造血干细胞的力量进行治疗的关键,同时也要了解恶性细胞如何改变这种平衡。造血干细胞是强大的、有效的和罕见的。但它们是遭受激活后按需补充新的血细胞,还是失控地迅速分裂并产生突变,还是静静地处于原始的休眠状态,这是一个很难回答的问题。”
理解是什么让造血干细胞在这么多不同的状态之间切换困惑着科学家们几十年。如今,通过这项新的研究,我们更好理解了是什么确定了造血干细胞并让它以一种特殊的方式发挥作用。
Lupien博士说,“我们正在探索未知的领域。我们必须研究细胞基因组的折叠,以了解为什么有些细胞可以在我们的一生中自我更新,而另一些细胞则失去这种能力。我们必须超越遗传学所能告诉我们的东西。”
在这项研究中,这些研究人员关注的是基因组中经常被忽视的非编码区域:大片的不含有蛋白编码基因的DNA,但却含有重要的决定着基因开启或关闭的调控元件。在这些约占基因组98%的非编码DNA中隐藏着至关重要的调控元件,它们不仅控制着成千上万个基因的活性,而且在许多疾病中起着重要作用。
这些研究人员探究了两种不同的人类造血干细胞,即经过几个步骤才能发育成白细胞、红细胞和血小板等不同类型的血细胞的未成熟细胞。他们研究了在人类骨髓中发现的长效造血干细胞(long-term HSC)和短效造血干细胞(short-term HSC)。他们希望绘制出具有持续自我更新能力的长效造血干细胞的“休眠”状态所涉及的细胞机制,相比之下,短效造血干细胞具有更易被激活和随时被激活的能力,因而可以迅速转变为各种血细胞。
这些研究人员发现这两种类型的造血干细胞之间的三维染色质结构存在差异,这一点意义重大,这是因为染色质的排列或折叠和成环方式影响着基因和基因组其他部分的表达和调控方式。
利用最先进的三维图谱技术,这些研究人员能够分析长效造血干细胞并将它们与染色质折叠蛋白CTCF的活性及其调节300个基因表达的能力联系起来,以控制它们的长效和自我更新。
Dick博士说,“在此之前,我们还没有一个全面的观点来了解是什么让造血干细胞以一种特殊的方式发挥作用。这300个基因代表了科学家们现在认为的长效造血干细胞的‘本质’。”
他补充说,长期休眠的长效造血干细胞是对癌症的一种“保护”,这是因为它们能够长期存活并逃避治疗,从而潜在地导致癌症在治疗多年后复发。
他补充说,然而,即将激活的短效造血干细胞比长效造血干细胞更快地分裂和增殖,可以积累更多的突变,有时这些突变会导致血癌产生。
Dick博士说,“这项研究让我们深入了解癌症是如何开始的各个方面,以及一些癌细胞如何保持类似干细胞的特性,使它们能够长期存活。”
他补充说,对造血干细胞更深入的了解也有助于在未来利用造血干细胞移植治疗血癌,并且可能通过在体外刺激和培养这些干细胞以改善移植效果。
参考资料:
1.Naoya Takayama et al. The Transition from Quiescent to Activated States in Human Hematopoietic Stem Cells Is Governed by Dynamic 3D Genome Reorganization. Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.11.001.
2.Mapping out the mystery of blood stem cells
https://medicalxpress.com/news/2020-11-mystery-blood-stem-cells.html