同样是细胞,凭啥肿瘤细胞更能适应低氧环境?
大气层中的氧气,是动物赖以生存的必要元素,是细胞能量转化的必备原料。细胞感知及适应氧气的重要性,可以用上一届的诺贝尔生理学或医学奖来说明。
低氧环境与肿瘤的发生发展密不可分,急性和慢性低氧共存于肿瘤,并以不同的方式影响肿瘤细胞表型。本文,我们将重点探讨肿瘤细胞适应急性和慢性低氧的分子机制。文末更有双重特惠等你,不要错过哦!
低氧环境:促瘤还是抑瘤?
肿瘤细胞的快速增殖和血液供应的减少/不足都会引起低氧环境,根据时长主要分为急性低氧和慢性低氧,不同的低氧模式会差异性地调控细胞活动,包括血管生成、代谢、增殖和转移。
急性低氧:暂时性的血流阻塞,会在短时间内(数分钟至数小时)限制氧气供应;
慢性低氧:异常的血管形成和不足,限制了氧气向某些肿瘤区域的扩散,致使细胞长期暴露于低氧状态(数小时至数天)。

缺氧诱导因子 HIF-1α 和 HIF-2α 在指导细胞对低氧的反应中起着核心作用。目前比较公认的是,前者主要介导急性低氧,而后者主要涉及慢性低氧。两者在低氧条件下稳定激活后,易位至细胞核,继而调节与肿瘤发生发展相关的多种基因的表达。
低氧对肿瘤发生发展的调控呈现出两种截然不同的方向:致瘤和抑瘤。一方面 HIFs 可维持癌症干细胞的干性、调节代谢,从而介导肿瘤的存活与耐药性;另一方面,HIFs 可以通过激活凋亡或诱导自噬来限制肿瘤细胞的增殖和生长。
有研究提出,低氧对肿瘤发生的最终调控结果取决于缺氧的严重程度、缺氧的持续时间以及 HIF 亚型表达及活性。

HIF-1α 调控示意图:在常氧条件下,HIF-1α 被 PHD 酶羟基化,随后与 pVHL 结合,并启动泛素-蛋白酶体系统;在低氧条件下,稳定的 HIF-1α 可自由移动至细胞核,与 HIF-1β 形成异二聚体,并通过与共激活因子 p300 / CBP 的相互作用调控低氧反应元件(HRE)的基因表达,引发下游级联反应。HIF-2α 也可以类似的方式调节 HRE 的表达。
肿瘤发生发展:HIF-1α 与 HIF-2α 联合作用
面对不同的低氧条件,HIFs 蛋白各显神通地调节肿瘤细胞对环境的适应性,主要表现在对多种细胞进程的调控上。

01
血管生成
血管生成对肿瘤的扩散和转移至关重要,在低氧条件下,肿瘤细胞通过激活开关——HIFs 蛋白,诱导多种促血管生成因子的表达,营造更多输送养分的血管,代表性的因子为 VEGF。此外还包括如下因子:
血管生成素-2(Ang-2)
肾上腺髓质素(ADM)
Cyclin G2(CCNG2)
内皮细胞 TEK 酪氨酸激酶(Tie-2,TEK)
内皮素-1(ET-1)
诱导型一氧化氮合酶 2(iNOS2)
血小板衍生生长因子-&β;(PDGF-&β;)
纤溶酶原激活物抑制剂-1(PAI-1)
即便如此,由于肿瘤细胞的野蛮生长以及新生血管的「质量不达标」,低氧也成为肿瘤所处环境的常态。研究表明,在大肠癌中,急性低氧和慢性低氧条件下,促血管生成因子差异化表达,但两种条件都可促进肿瘤的侵袭。
02
细胞代谢
为了满足肿瘤细胞的肆意生长,HIFs 蛋白引起细胞能量产生途径的变化。例如,肿瘤内 HIF-1&α; 诱导涉及乳酸产生、丙酮酸代谢、葡萄糖转运和糖酵解相关基因的转录激活。
即使是在氧气充足、线粒体功能正常的情况下,肿瘤细胞仍倾向于将葡萄糖代谢为乳酸,称之为 Warburg 效应。此外,HIF-1&α; 还可影响氨基酸、铁和核苷酸的代谢。
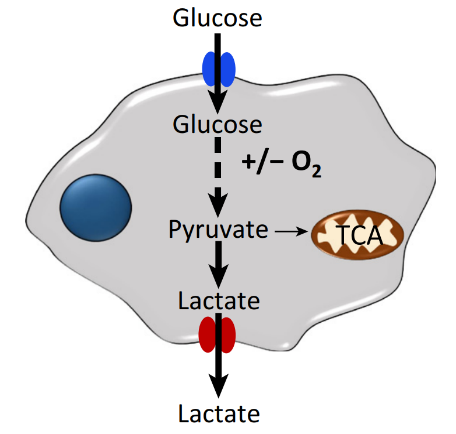
HIF-2&α; 可能通过其他机制来支持低氧条件下的代谢变化。例如,HIF-2&α; 调节无 VHL 的肾细胞癌中葡萄糖转运蛋白-1(GLUT1)的表达。
03
生存还是死亡
「To be, or not to be」,也是低氧环境下肿瘤细胞需要面临的抉择。
促红细胞生成素(EPO)是第一个被鉴定的 HIF-1&α; 靶基因,在低氧条件下被上调,并刺激红细胞生成,EPO 也是 HIF-2&α; 的重要靶标。EPO 和促血管生成基因可确保充足的血液/氧气供应,促进 HIFs 介导的肿瘤细胞存活。矛盾的是,某些肿瘤中,HIF-1&α; 的过度活化可导致细胞凋亡,主要通过以下三种机制:
HIF-1&α; 可能通过结合 E3 泛素连接酶 MDM2 来稳定 p53;
HIF-1&α; 诱导凋亡基因(NIP3、NIX 和 RTP801)的表达;
HIF-1&α; 转录激活 MIX-1,从而抑制 c-Myc(p21 抑制剂),导致细胞周期停滞。
此外,HIF-1&α; 和 HIF-2&α; 虽靶向相同下游基因,但调控作用可能截然相反。例如,HIF-2&α; 可抑制 p53 的活化,促进肺癌和透明细胞性肾细胞癌(ccRCC)的肿瘤发生。
04
EMT 和干性维持
上皮细胞转化为间质型细胞(EMT)的过程,可以说是肿瘤转移扩散的元凶,因为具有间充质表型的细胞迁移能力增强,还可抵抗凋亡。
HIF-1&α; 可直接或间接调节众多控制 EMT 过程的转录因子的表达,包括 Notch、PDGF、VEGF、Snail、TCF3、TGF-&β;、Twist1、ZEB1 和 ZEB2。在结直肠癌(CRC)中,HIF- 1&α; 直接与 ZEB1 的近端启动子结合,以增加 ZEB1 的表达,从而导致 EMT 和细胞迁移。
低氧是诱发 EMT 过程的重要因素,也可能导致具有自我更新能力的癌症干细胞(CSCs)的发展。低氧环境下,HIF 信号通路与多能性标志物的表达相关,支持干细胞的产生和维持。
在神经母细胞瘤和乳腺癌中,CSCs 可能是由低氧诱导的去分化过程产生的。低氧诱导的几种转录因子(包括 OCT4、NANOG 和 SOX2 等)位于 HIFs 的下游,在肿瘤细胞更新中发挥关键作用。

总结
一言以蔽之,肿瘤细胞对低氧环境的适应性主要受 HIFs 蛋白调控,了解潜在的细胞调控机制,对于有效研发肿瘤治疗方法至关重要。Bio-Techne 旗下子品牌 Novus Biologicals® 在缺氧研究方面具有极为丰富的经验,尤其是高品质的 HIF-1α 抗体,文献发表数 800 余篇,堪称缺氧研究的王牌抗体。
