结直肠癌预后 肿瘤间质将与TNM相辅相成
摘要
结直肠癌(CRC)是全球最常见的消化道恶性肿瘤之一,其发病率逐年增高。研究表明,肿瘤间质(tumor stroma)在肿瘤发生发展的过程中具有重要作用。肿瘤间质,通过与肿瘤实质的相互影响,促进了CRC的发生、发展和转移。因此,探究肿瘤间质成分在CRC进展中的具体作用、分子机制及其临床应用至关重要。本文就目前国内外肿瘤间质成分在CRC中的研究进展进行综述。
结直肠癌(colorectal cancer,CRC)是全球最常见的消化道恶性肿瘤之一,其发病率逐年增高。据2020年美国最新癌症统计数据显示:男性和女性CRC发病数量分别占男性、女性各类癌症发病总数的9%和8%,其发病率和死亡率在所有恶性肿瘤中分别位列第4位和第3位[1]。中国国家癌症中心2015年的癌症统计数据显示,CRC的发病率和死亡率在所有恶性肿瘤分别位居第3位和第5位[2]。肿瘤微环境(tumor microenvironment,TME)中肿瘤实质和肿瘤间质之间的相互作用是癌症发生发展的主要驱动力,肿瘤间质的一些基本成分,包括肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)、肿瘤相关的巨噬细胞(tumor-associated macrophages,TAMs)和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)。研究表明,肿瘤间质成分可通过与肿瘤实质成分的相互作用,影响CRC的进展和肿瘤转移能力,有望成为肿瘤治疗和干预的有力靶点[3]。
一、肿瘤间质成分在CRC中的作用
TME包括肿瘤实质细胞、间质细胞、细胞外基质和细胞分泌的细胞因子等,其在肿瘤的发生、发展和转移中起着重要作用。因此被认为具有广阔的肿瘤治疗前景。肿瘤间质细胞主要由TILs、TAMs、CAFs等组成(见图1),其通过分泌趋化因子和生长因子在肿瘤的发展中起着关键作用,并可导致肿瘤实质细胞增殖,运动性和侵袭性增强,也可促进炎症和血管生成[4]。解剖上,肿瘤实质细胞被血管和淋巴管包围,并由多种间质细胞营养支持,如巨噬细胞、成纤维细胞、淋巴细胞、内皮细胞等。而肿瘤实质细胞通过招募这些间质成分来诱导其恶性转化及进展。间质成分一旦被招募,可通过分泌多种细胞因子、趋化因子、生长因子和酶等,从而影响肿瘤实质的发生、发展、侵袭和转移。因此,肿瘤间质成分有望为肿瘤治疗提供新的靶点。
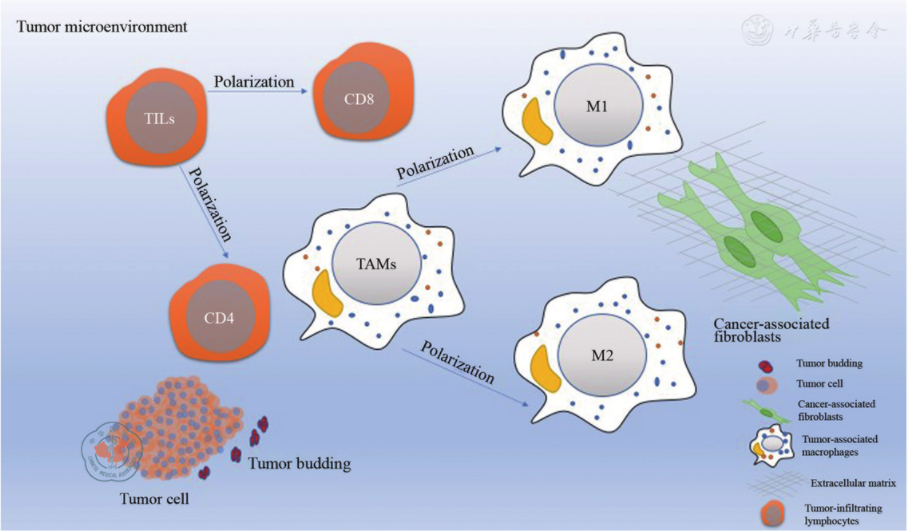
图1 肿瘤微环境中的肿瘤细胞和肿瘤间质成分
1.肿瘤浸润性淋巴细胞在CRC中的研究现状
CRC的生存预后主要和肿瘤TNM分期有关,但临床处于同一TNM分期的CRC可以表现为不同的生存期,故目前TNM分期不能全面、有效地指导CRC的治疗及评估预后。事实上,TNM分期没有考虑到间质成分中宿主免疫反应,而只是关注到了肿瘤实质细胞的作用。有越来越多的证据表明肿瘤间质中的免疫反应与肿瘤进展密切相关[5]。目前许多研究试图寻找新的免疫生物标记物,作为治疗新靶点并克服TNM分期的弊端[6]。
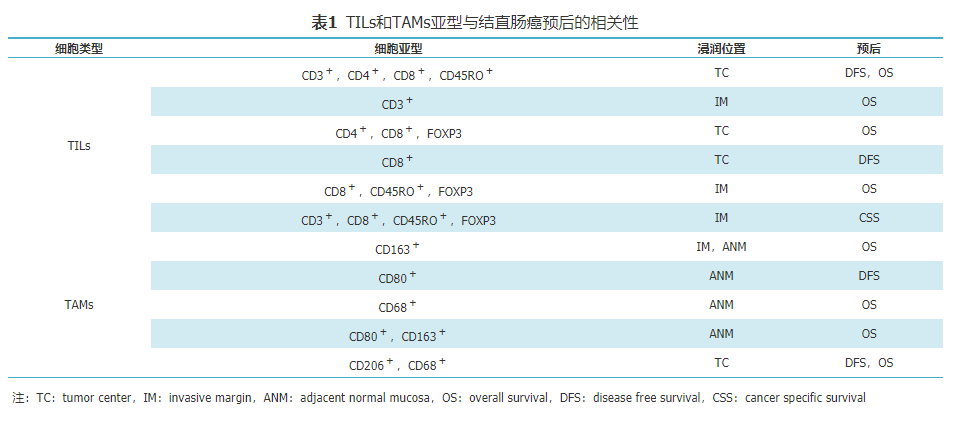
TME由多种类型的白细胞组成,如巨噬细胞、自然杀伤细胞(NK)、B淋巴细胞、T细胞(CD3+)、细胞毒性T细胞(CD8+)和记忆性T细胞(CD45 RO+)。而TILs是指从肿瘤组织中浸润淋巴细胞,富含肿瘤特异性细胞毒性T淋巴细胞和自然杀伤(natural kill,NK)细胞,文献报道,TME中TILs的位置、类型和密度直接影响CRC的发生和进展[7]。且TILs浸润密度的增加与临床预后密切相关,高密度的CD3+、CD8+和CD45RO+浸润与较长的无病生存期(disease free survival,DFS)以及总生存率(overall survival,OS)有关。Naito等[8]首次报道CD8+是结直肠癌孤立的预后因素。Koch等[9]研究表明TILs浸润密度与CRC的预后密切相关,与其他相关免疫细胞相比,高密度的CD3+和CD8+浸润具有更好的生存期;且与TNM分期相比,CD8+/CD3+比值被认为是更好的预后标志物。Trabelsi等[10]利用免疫组化染色及图像分析软件,定量分析肿瘤中心(tumor center,TC)及侵袭边缘(invasive margin,IM)的CD3+、CD8+,结果表明联合标志物CD3+、CD8+不仅具有可靠的预后评估价值,而且对选择最佳的肿瘤治疗方案也有帮助。此外,TILs比值(CD3+/CD8+、CD3+/CD45RO+或CD8+/CD45RO+)比传统的UICC分期的Ⅰ~Ⅲ期CRC有更精细的分层和更准确的预后评估价值。
2.TAMs在CRC中的研究现状
TAMs是一种多功能的抗原呈递细胞,其通过与肿瘤实质细胞相互作用进而分化的原核巨噬细胞参与了免疫抑制、肿瘤侵袭和转移等过程,影响其炎症反应。在肿瘤实质招募的各种免疫细胞中,TAMs是最常见的细胞[11]。在肿瘤进展的各个阶段TAMs计数丰富并占据主要地位,并可表现促癌[12]或抑癌作用[13]。研究指出在不同类型的肿瘤中,高浸润比例的TAMs与不良预后和预后较差有显著相关性[14]。
TAMs可以分为M1和M2两个亚型,其中M1型(抑癌型)以iNOS、CD86+、CD169+等为主,M2型(促癌型)以CD163+、CD206+、CD204+等为主。在多种恶性肿瘤中,TAMs密度越高,临床预后越差,尤其是M2亚型为代表的TAMs。TAMs高密度浸润或TAMs的极化通路被认为是恶性肿瘤治疗的新靶点。在炎症因子刺激下,M1型被激活具有吞噬肿瘤实质细胞的能力,抑制肿瘤进展,M2型则促进肿瘤生长和转移,维持血管生成和间质重塑功能[15]。
目前,TAMs最常用的标志物是巨噬细胞普遍标志物CD68+,但是测定单一TAMs中的CD68+浸润密度,不可避免会忽略TME中不同功能的巨噬细胞亚群的作用潜力。在CRC和胃癌中[16],发现高比例TAMs浸润具有更好的预后。Pinto等[17]对151例CRC标本进行免疫组化染色,以CD68+为巨噬细胞普遍标志物,CD80+为促癌型巨噬细胞标志物,CD163+为抑癌型巨噬细胞标志。通过计算机辅助定量方法分析TC、IM和癌旁正常黏膜(adjacent normal mucosa,ANM)的TAMs密度分布,结果发现抑癌型CD163+主要分布在IM,而促癌型CD80+几乎只分布在ANM,提示TAMs具有明显的抑癌极化作用。根据肿瘤分期分层,TAMs特别是CD163+在Ⅱ期肿瘤中所占比例较高,而CD80+在侵袭性较小的T1期肿瘤中占优势。另外,在Ⅲ期肿瘤中,高比例CD68+和低比例的CD80+/CD163+与总生存率降低相关。此外,TC、IM和ANM的TAMs对TME也具有重要的调节作用。通过分析TAMs亚群浸润比例和随访预后信息可以发现,TAMs亚群对CRC有不同的预后,并可筛选出哪些高危CRC可能受益于针对不同亚群巨噬细胞的免疫治疗。Zhang等[18]发现CD68+、CD163+和CD80+巨噬细胞在右半结肠的ANM中更为普遍(见表1)。除TAMs外,其他免疫细胞,即某些T淋巴细胞亚群,也被报道为右半结肠肿瘤区域的主要免疫细胞[19]。
3.肿瘤相关成纤维细胞在CRC中的研究现状
肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)是肿瘤间质的重要组成部分,不仅为上皮细胞提供营养支持,而且是肿瘤的关键功能调节因子,以环境依赖的方式促进和延缓肿瘤的发生与发展。转录组学和免疫组化研究表明,肿瘤间质纤维增生性与患者预后不良相关,结缔组织增生反应主要由活化的CAFs组成,高密度CAFs浸润与结直肠癌不良预后密切相关。
CAFs是可能构成肿瘤间质的异质性成分最主要的细胞之一。CAFs在起源、亚型、生物学甚至定义方面也是最不为人所知的细胞类型之一。在结构和功能上,CAFs通过多种机制影响肿瘤的发生和发展。例如,CAFs释放多种促肿瘤因子,如细胞因子和趋化因子,营养支持肿瘤细胞生长和血管生成[20]。在功能上,CAFs可分为促癌型CAFs和抑癌型CAFs,对CAFs生物学功能的进一步研究,可衍生出对间质成分的新诊断、预测和治疗的方案。肿瘤间质中的CAFs一个突出表现是,其能够将TME中肿瘤生长的抑制转变为促进作用[21]。CAFs在几个方面促进了肿瘤的生长。例如,它们分泌细胞因子,具体的作用可能是促进血管生成[4],有助于肿瘤的耐药,从而促进肿瘤生长。肿瘤间质比(tumor stroma ratio,TSR)高的肿瘤可能更多地受益于肿瘤的促生长能力,这可以解释高间质比例患者预后较差的原因。
随着间质在肿瘤生长中的作用越来越明显,开发针对间质而不是实质的治疗研究日益增多[22]。例如,广为探究的包括针对CAFs生长因子的抗体[23]、针对转化生长因子的抗体,以及针对间质T细胞免疫疗法的研究。目前,临床上尚未发现大规模针对间质成分的靶向治疗应用,但是间质成分的靶向治疗可能在未来变得更加重要。因此,大量的前瞻性研究将有助于评估TSR在临床应用中的附加价值,患者在接受新辅助治疗前后,根据TSR与预后的关系的研究结果,制定不同的应用于新辅助治疗方案具有极大的临床意义。目前针对肿瘤间质成分中的CAFs的新靶向疗法正在研发中[22],并可进一步提高对肿瘤患者TSR的评估价值。
4.肿瘤出芽在CRC中的研究现状
肿瘤出芽(tumor budding,TB)定义为存在侵袭边缘的单个或小簇肿瘤细胞,被认为是CRC中影响预后的高危因素,TB与CRC的不良预后相关,并可预测早期CRC的区域淋巴结转移。ITBCC(International Tumor Budding Consensus Conference)建议将TB与其他临床病理因素一同加入到未来的CRC指南中。目前TNM分期通常被认为是CRC分期的金标准,但是按照TNM分期标准,同一分期的肿瘤患者可能会有不同的临床结局。TB的相关数据可在常规苏木精和伊红(H&E)染色切片中轻松获得,研究表明TB与肿瘤复发显著相关,而肿瘤生长模式与肿瘤复发无关。
TB可作为预测和评估高复发风险患者的孤立预后因素,特别是在可从辅助治疗中获益的Ⅱ期高复发风险CRC患者,TB可作为原发性结直肠癌新的分期系统的良好候选方案。有研究结果显示,TB能够有效地将可手术的原发性肿瘤的肿瘤特异性生存(cancer specific survival,CSS)分层。此外,与其他肿瘤特征,包括T分期和N分期相比,TB的复发危险率最高,约为其他肿瘤特征的三倍。在T1和T2肿瘤中,只有TB有显著的预后价值。这表明TB的发生在肿瘤侵袭的早期,代表了恶性肿瘤的有侵袭性特征,如细胞粘附力丧失和局部侵袭。
二、肿瘤间质比在CRC中的作用
TME中肿瘤实质细胞和间质细胞是一个整体,与肿瘤的发生、发展和转移均密切相关,间质成分的比例高低是多种肿瘤重要的预后因素[24]。研究表明,高间质比例的肿瘤患者预后差,并且有理由作为一种重要的高复发风险因素的参考。TSR是指肿瘤实质面积和间质面积比值,在传统的苏木精和伊红(H&E)染色石蜡切片,在肿瘤最具有侵袭性部位通过人工评估获取比值。TSR在CRC的研究进展及Ⅱ期肠癌中的预后价值尚不完全清楚,因此探究TSR在CRC中的预后价值显得尤为重要。
目前常用于临床决策的分期是美国癌症联合委员会(AJCC)的肿瘤淋巴结转移(TNM)分期,按照TNM分期标准对肿瘤的浸润程度进行评判,可为临床医师提供治疗决策。由于没有考虑到肿瘤的异质性和生物学特征,同一TNM分期的CRC患者有不同的预后,并且其中25%的Ⅱ期肠癌患者五年内会出现复发,除此之外,有些ⅡB期比ⅢA期患者的预后更差,导致在某些情况下Ⅱ期CRC治疗不足而Ⅲ期CRC治疗过度[5]。因此,临床上急需新型分期方法以优化目前常用的CRC患者的TNM分期[25]。近年来,Park等[26]通过对331例Ⅰ~Ⅲ期CRC的研究,指出TSR是CRC根治术后复发的高危因素,并与CRC的生长和侵袭密切相关。有学者通过对530例CRC术前的肿块进行活检并计算出TSR,成功预测出CRC的术前淋巴结转移状态并提出最适合的治疗方案,同时建立出预测CRC术前淋巴结转移状态的Nomogram模型[27]。研究表明Ⅱ期高复发风险CRC可从辅助化疗中获益,因此可将新的高复发因素纳入现有的病理分期分级。综上,TSR可作为一种孤立的CRC预后因素,并可预判CRC术后复发,同时可为Ⅱ期CRC提供重要的治疗决策。
三、肿瘤间质成分在Ⅱ期CRC中的应用及展望
肿瘤间质成分通过与肿瘤实质成分的相互作用,影响CRC的进展和肿瘤转移能力,并可作为肿瘤治疗和干预的有力靶点[3]。目前以氟尿嘧啶为基础的术后辅助化疗方案已被广泛应用于CRC以降低复发率和提高生存率,然而其对II期CRC的疗效仍存在争议[28]。传统的临床病理高危因素不能很好地确定预后差和高复发风险。鉴于辅助化疗的副作用和成本等其他因素,急需准确的CRC预后价值和预测的生物标志物,并寻找高复发风险因素并筛出可能受益于辅助化疗的Ⅱ期高复发风险CRC患者。
对于Ⅱ期CRC,有学者通过对84例Ⅱ、Ⅲ期的结直肠癌患者资料进行回顾性研究,认为TILs可作为预测CRC生存期可靠的指标,因此TILs在CRC中有更好的预后价值并在Ⅱ期CRC中具有较广阔的应用前景[29]。另外,Eriksen等[30]通过对573例Ⅱ期CRC的HE染色切片计算TSR,结果表明在Ⅱ期CRC中TSR可提供重要的预后价值,将TSR纳入当前的风险分层可更好地筛出Ⅱ期高复发风险CRC。此外,Sickert等[31]发现当根据肿瘤分期评估TAMs数量时,与Ⅳ期相比,Ⅱ期CRC中CD68+和CD163+浸润比例更高。对于Ⅱ期CRC,术后辅助化疗的疗效仍存在争议,Feng等[32]指出在根治性切除的Ⅱ期CRC中,CD206+/CD68+比值越高,复发风险越高、预后越差,并可受益于辅助化疗。同时,Feng等人评估了TAMs作为术后辅助化疗的生物标志物的预后价值,将传统的临床病理高危因素和评估的预后与预测效果做出比较,指出将TAMs比值结合传统的临床病理高危因素,更有助于精准化、个性化治疗,对于预后良好且复发风险较低的患者,可以优先使用化疗辅助[33]。因此TAMs作为生物标志物在CRC中有更好的预后价值并在Ⅱ期CRC中具有较广阔的应用前景。
目前CAFs在Ⅱ期CRC中报道较少,但通过对CAFs浸润评分有助于进一步肿瘤分期分层。对于TB,有学者研究指出肿瘤浸润性生长模式与组织学亚型和淋巴管浸润显著相关,而高TB与T分级和N浸润显著相关,证明TB是Ⅱ期CRC进展的孤立预测因子,TB可孤立预测AJCC/UICC Ⅱ期CRC的预后,因此可通过综合多模式治疗用于准确预测、患者咨询和临床实验设计[34]。
四、结论
实体肿瘤不仅由恶性肿瘤实质细胞构成,而且由间质成分如巨噬细胞、浸润性淋巴细胞等构成,肿瘤的发生发展是一个多步骤的过程,其进展依赖于组织细胞内突变的顺序累积,此外,肿瘤的发生与不同间质成分包括肿瘤相关成纤维细胞、肿瘤相关巨噬细胞、间充质干细胞、血管内皮细胞等的激活有关。肿瘤间质是目前肿瘤研究的热点之一,大量证据表明肿瘤行为不是单个细胞而是细胞群体协同活动的结果。肿瘤细胞比间质细胞更容易聚集成团,这种聚集行为使肿瘤细胞有发生、发展和转移的倾向,因此分析这种聚集特性的特征可能有助于区分高复发风险和低复发风险肿瘤。
TME对CRC的预后具有重要影响,显著的肿瘤周围炎症(高TILs浸润)与良好的预后相关。TSR已被证实是CRC患者生存率降低的一个孤立的分期指标[26],有助于TME评分的发展,补充现有的TNM分期系统。TNM分期系统虽然已被广泛应用于评估CRC的预后,但它不能预测治疗的反应、难以作为一个强有力的预后标志物。因此TME中的肿瘤间质成分在CRC中的作用及预后有望与TNM分期系统相结合,并可在Ⅱ期CRC中具有广阔的应用前景。