bMSI检测重磅突破 完成国内胃肠肿瘤队列临床疗效验证
自2017年帕博利珠单抗获批首个泛癌种适应证——dMMR/MSI-H(错配修复缺陷/微卫星高度不稳定)晚期实体瘤患者,微卫星不稳定(MSI)检测跃升至肿瘤分子诊断的最前沿。采用聚合酶链反应(PCR)检测MSI是目前临床公认的“金标准”,但是该方法局限于组织样本检测。临床上1/3的晚期实体瘤患者无法获得足够的活检组织,而基于外周血进行的循环肿瘤DNA(ctDNA)检测具有微创、简易、快速、样本可及性高、能克服肿瘤异质性等特点,可以满足临床无组织样本的晚期患者的需求。
但是,国内的NGS液体活检技术中,完成临床疗效验证者屈指可数,针对免疫治疗标志物的更是少之又少。其中,用于肿瘤突变负荷(TMB)检测的LAF-bTMB技术已被证明,筛选出来的bTMB-H的NSCLC患者PFS时间和OS时间均明显长于bTMB-L的患者[1,2]。但bMSI的检测在免疫治疗疗效预测方面却始终没有突破,直至2020年11月8日国际肿瘤学知名杂志J Immunother Cancer(影响因子10.252)在线发表由北京大学肿瘤医院沈琳教授团队与思路迪公司共同完成的最新研究成果——基于NGS panel的bMSI检测技术可筛选胃肠肿瘤患者免疫治疗获益人群,且可同时进行bMSI及bTMB检测,筛选更多免疫治疗获益患者[3]。
01
与“金标准”——组织PCR对照准确性94%
该研究路线分为以下环节:算法开发、技术验证、临床疗效验证及扩大样本量的检测(图1)。

图1 实验设计流程图
算法开发:研发团队根据10位晚期结直肠癌患者的全外显子组测序(WES)数据筛选出500个MSI位点,结合有组织PCR-MSI结果的20例MSI-H和100例MSS胃肠肿瘤患者的血液样本,进行这500个MSI位点检测,并从中挑选出性能最佳的前100个位点进行bMSI score的计算。此算法中的bMSI score定义为100个微卫星位点中,不稳定微卫星位点的比例;结合组织PCR的检测结果确保至少95%的特异性,将MSI-H的截断值定为bMSI score=0.2(图2)。
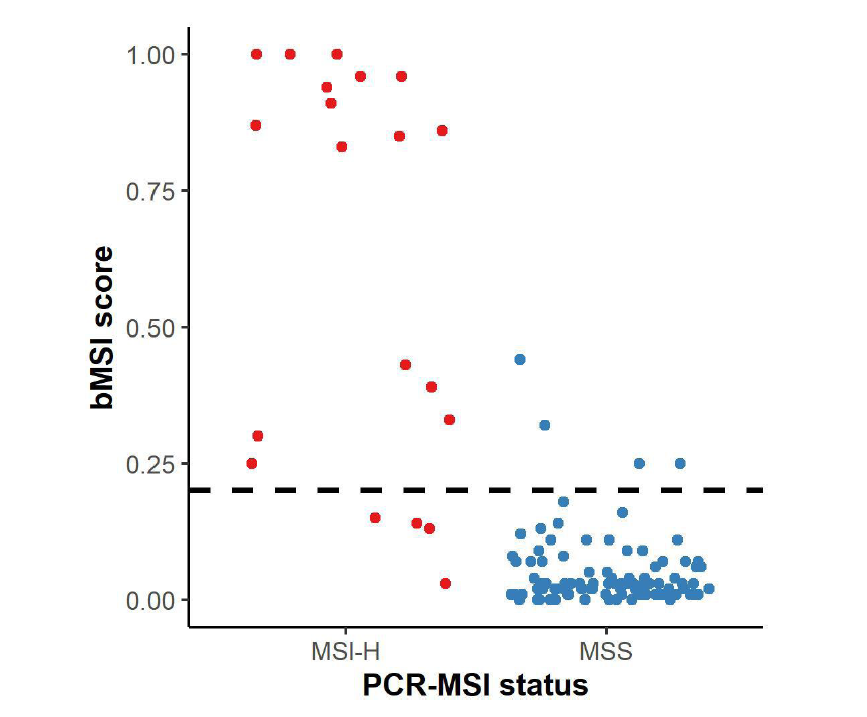
图2 确定bMSI score的截断值
技术验证:研究纳入经PCR-MSI检测确认的40例tMSI-H和209例tMSS晚期胃肠肿瘤患者的外周血进行技术验证。该bMSI算法筛出33例tMSI-H患者和201例tMSS患者,与组织PCR对照准确性达到94%(敏感性:82.5%,特异性:96.2%)(表1)。通过检查患者的记录,发现1例假阳性和2例假阴性患者有多个病变,另外1例假阴性患者的血样采集在其组织样本采集后的1年内,可能是肿瘤组织中肿瘤细胞克隆与血液中捕获的克隆存在差异的原因。
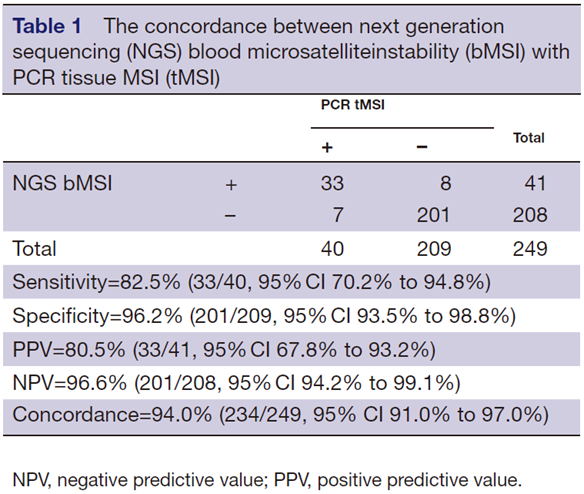
表1 血液NGS-bMSI与组织PCR-MSI一致性
02
国内首个且目前唯一通过临床疗效验证的bMSI检测
临床疗效验证:研究共纳入60例2016年1月至2020年1月期间接受PD-1/PD-L1单抗单药治疗的晚期胃肠肿瘤患者。3D-bMSI检测结果显示,31例患者为bMSI-H,29例患者为bMSS,且两组基线特征几乎无差异(除LDH水平)。bMSI-H患者与bMSS患者相比,ORR显著升高(38.71%∶6.90%,P=0.005)(图3);PFS时间显著延长(5.57个月∶2.03个月)(HR=0.431;95%CI:0.236~0.787,P=0.005),OS也显著延长(20.03个月∶10.07个月)(HR=0.489;95%CI:0.249~0.961,P=0.034)(图4)。
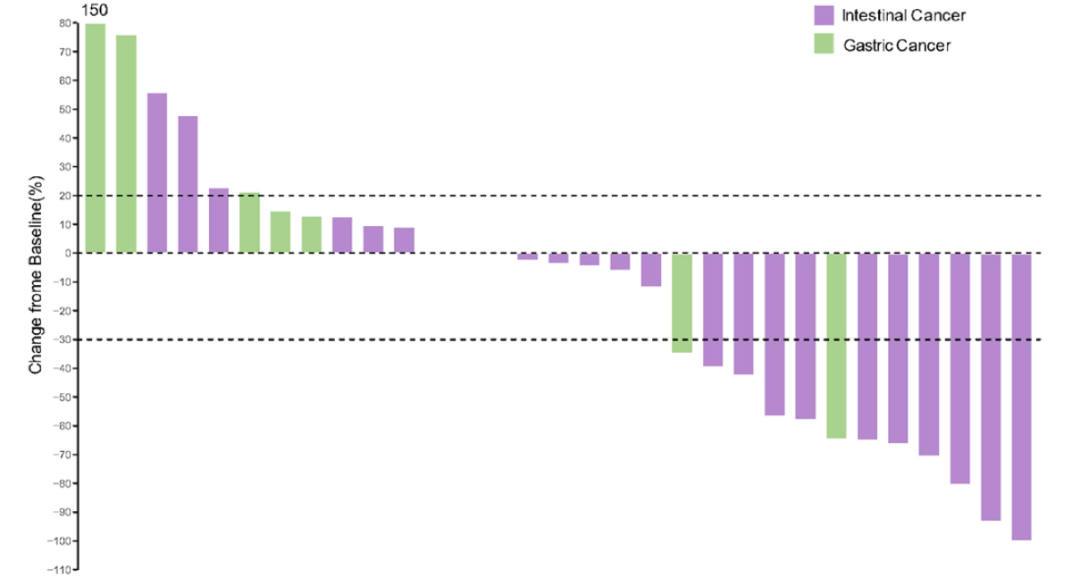
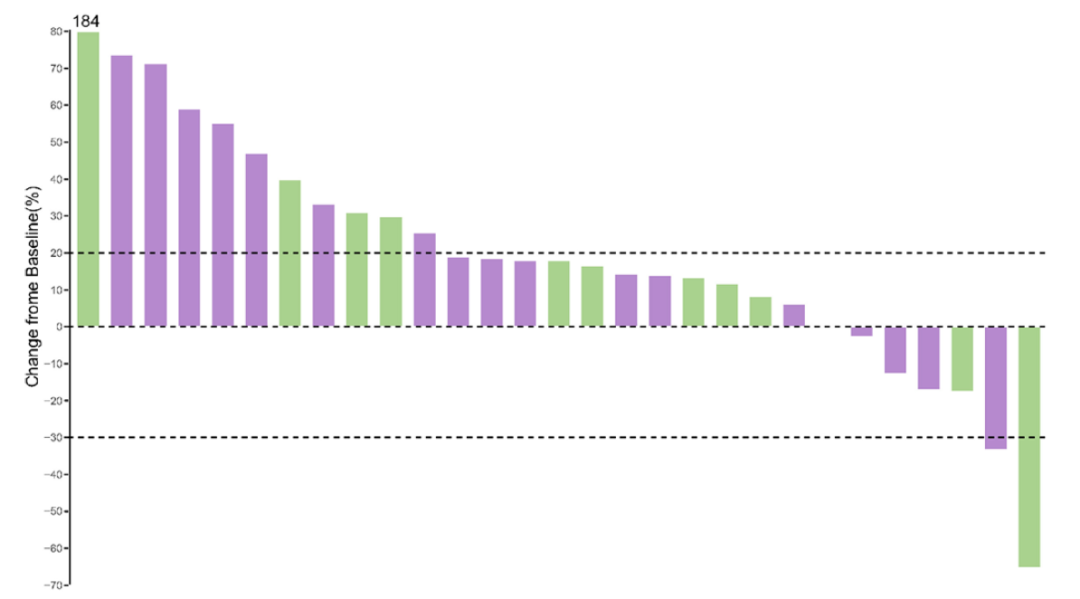
图3 bMSI-H与bMSS患者的疾病进展对比
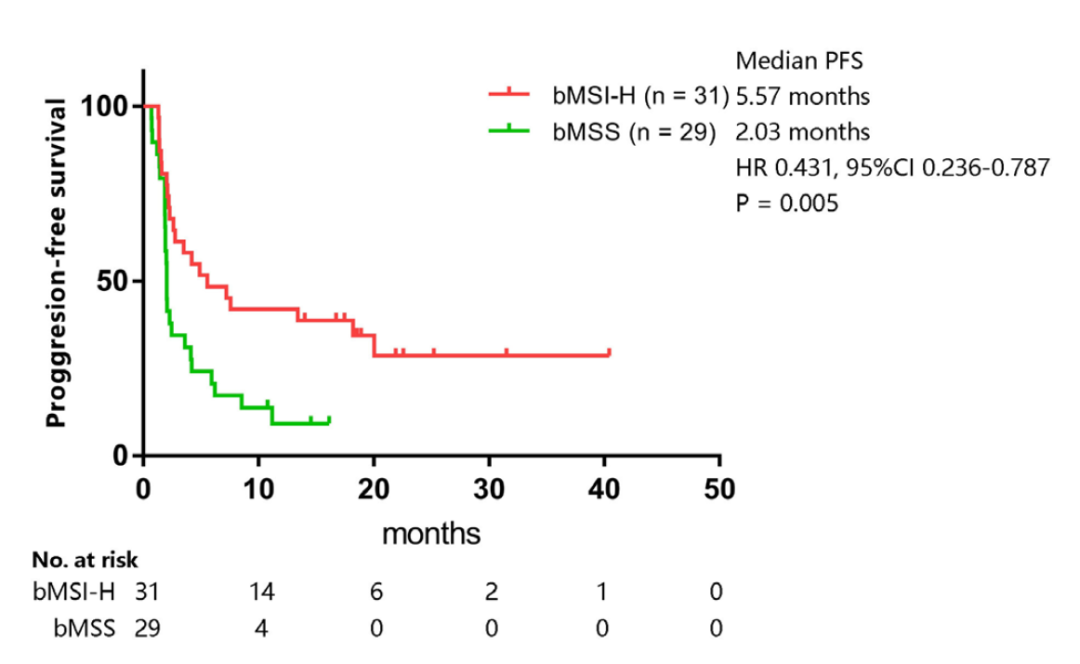

图4 bMSI-H与bMSS患者的PFS时间和OS时间对比
03
bMSI与bTMB联合筛选更多免疫治疗获益患者
虽然目前仅MSI-H患者被证实可以从免疫治疗中得到更大获益,但从临床实验和临床实践的反馈来看,部分MSS患者仍可能从免疫治疗中获益,推荐通过TMB治疗进一步将MSS患者进行分层。该研究通过已完成验证的150个基因panel计算入组患者bTMB,将29例bMSS患者进一步划分为bMSS-bTMB-H亚组(4例)和bMSS-bTMB-L亚组(25例)。bMSS-bTMB-H亚组相比bMSS-bTMB-L亚组具有更长的OS时间(22.38个月∶9.83个月)(HR=0.026,95%CI:0~2.635,P=0.011)(图5)。
这提示,bMSI与bTMB均能预测免疫治疗疗效,胃肠肿瘤患者只要携带bMSI和bTMB这两个免疫疗效预测标志物之一,即可获得较bMSS且bTMB-L患者更长的生存(20.87个月∶9.83个月)(HR=0.317,95%CI:0.157~0.640,P<0.001)(图6)。bMSI与bTMB二者联合检测能够筛选更多免疫治疗获益患者。
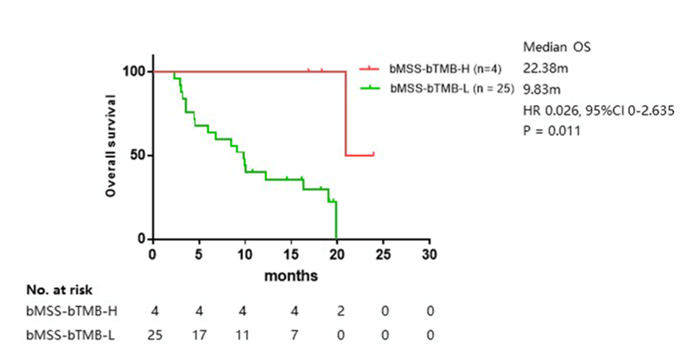
图5 bMSS患者中bTMB-H与bTMB-L的OS时间对比
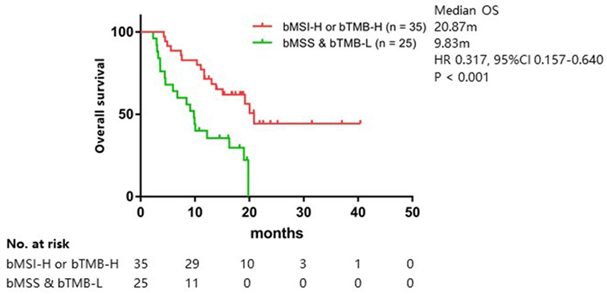
图6 bMSI-H或bTMB-H患者与bMSS且bTMB-L患者的OS对比
04
中国18个癌种5000+例真实大样本MSI数据
完成了技术验证和临床疗效验证后,为了更好地了解MSI-H在其他恶性实体肿瘤中的发生率,研究者应用该技术对18个实体瘤进行分析:纳入5138例实体肿瘤患者,其中大部分为晚期肿瘤患者(III期患者占30.5%,IV期患者占54.4%),均以150个基因panel进行ctDNA测序。结果显示,80例(1.6%)患者为bMSI-H。各瘤种的bMSI-H与组织检测tMSI-H的比例不尽相同:子宫内膜癌(5.7%)、前列腺癌(4%)、结直肠癌(3.3%)和胃癌(3.1%)的MSI-H比例较高(图7),但是高发MSI-H的癌种是相似的。
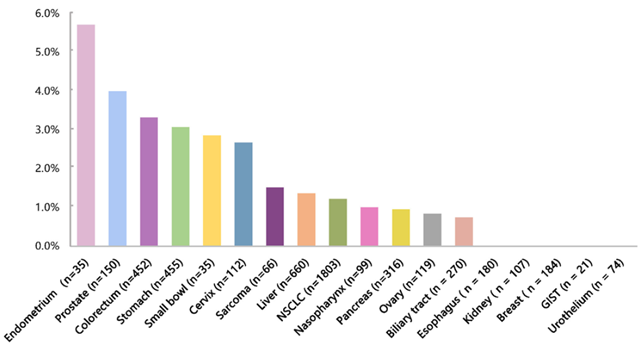
图7 中国18个癌种5138例晚期患者bMSI-H分布
相较于之前的bMSI研究,该研究的创新之处在于征集了晚期胃肠肿瘤免疫单药治疗队列,通过该bMSI检测方法区分患者并进行生存获益分析。目前国内外基于ctDNA的MSI算法有很多,对于MSI-H的截断值选定方式也不同,即便有敏感性和特异性这样的技术参数,但选定的对照方法不同,例如选择组织PCR结果还是组织NGS结果作为对照,得出的敏感性特异性也不同。在这种情况下,采用患者治疗后的生存获益来作为评判标准,相对更能让人信服,毕竟检测方法的研发是为临床治疗服务的,而临床治疗的目标就是让患者获得更长的生存。
参考文献
[1] Wang Z, Duan J, Cai S, et al. Assessment of Blood Tumor Mutational Burden as a Potential Biomarker for Immunotherapy in Patients With Non-Small Cell Lung Cancer With Use of a Next-Generation Sequencing Cancer Gene Panel[J]. JAMA Oncol, 2019, 5(5):696-702.
[2] Wang Z, Duan J, Wang G, et al. Allele Frequency-Adjusted Blood-Based Tumor Mutational Burden as a Predictor of Overall Survival for Patients With NSCLC Treated With PD-(L)1 Inhibitors[J]. J Thorac Oncol, 2020, 15(4):556-567.
[3] Plasma-based microsatellite instability detection strategy to guide immune checkpoint blockade treatment[J]. J Immunother Cancer, 2020, 8(2):e001297.