K药“首”领一线, 第六个适应证头颈部鳞癌正式获批, 带来4年生存率突破性改善
2020年12月9日,NMPA官网显示K药新适应证审批状态更新为“审批完成-待制证”,标志着K药在华已被批准单药用于通过充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线治疗,成为国内首个头颈部鳞癌的免疫一线治疗。
从提交药物申请到获批,中间只经历了短短七个月的时间,NMPA再次刷新了中国速度,急患者之所需,不断缩短时间差,基本实现了抗癌药国内外的获批同步。
1
头颈部鳞癌
实现全球和中国获批基本同步
这么高效的药物审批速度是我们过去难以想象的。头颈部鳞癌之前的标准一线治疗方案,是EGFR靶向药(西妥昔单抗)联合铂类化疗和5-FU,也就是EXTREME方案。这个方案早在2008年就获得美国FDA批准,但是今年才在国内获批,时间差达到了10年以上。知道有药但是用不上,错过了最佳使用机会,是不少患者或家属难以释怀的遗憾。
现在我们终于迎来了转机,创新药物特别是临床急需的抗癌药,获批速度不断加快,基本实现了全球和中国获批的同步,就像最近这几次K药新适应证的获批,给了中国肿瘤患者极大的鼓舞。
为什么K药获批这么快,背后有什么原因吗?支持K药获批加速的,一方面是国家政策改革和头颈部鳞癌患者的急需,一方面是K药扎实全面的临床试验数据。
头颈部肿瘤虽然不像肺癌、肝癌这类大癌种那样众所周知,但也是十分常见的一类恶性肿瘤,其包括了唇及口腔癌、口咽癌、下咽癌和喉癌等癌种,其中90%以上病理类型都是鳞癌。而且传统治疗的疗效有限,转移性或复发性头颈部鳞癌的5年生存率甚至不足5%。
2
4年生存率近三倍
长期疗效和安全性双保障
K药相关的临床试验数量是所有PD-1/PD-L1抑制剂中最多的,有多项临床试验数据证实了K药在肺癌这类难治肿瘤中,5年长期生存率从5%到30%的突破性改善。在最近的ESMO(欧洲肿瘤内科学会年会)上,KEYNOTE-048研究展示了K药在头颈部鳞癌中,4年生存率近3倍的改善。
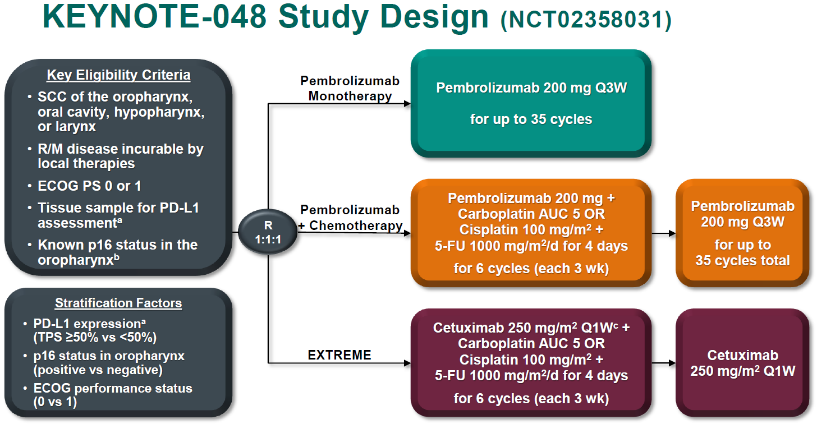
试验设计:KEYNOTE-048研究共入组了882例复发或转移性头颈部鳞癌患者,以1:1:1的比例随机入组,接受K药单药、K药联合化疗或EXTREME方案(EGFR靶向药联合化疗)。
试验结果:
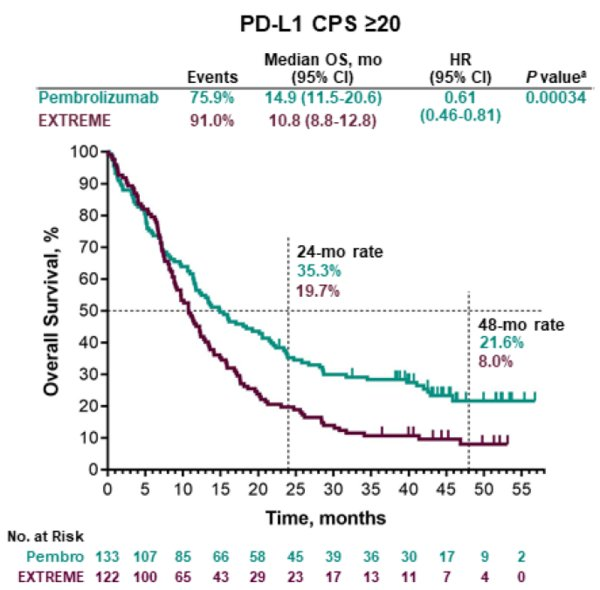
生存时间和生存率:在PD-L1表达阳性(CPS≥20)患者中,K药将中位总生存期(OS)从标准治疗的10.8个月延长到14.9个月,降低了39%的疾病死亡风险(HR=0.61),4年生存率近乎3倍(21.6% vs8.0%)。
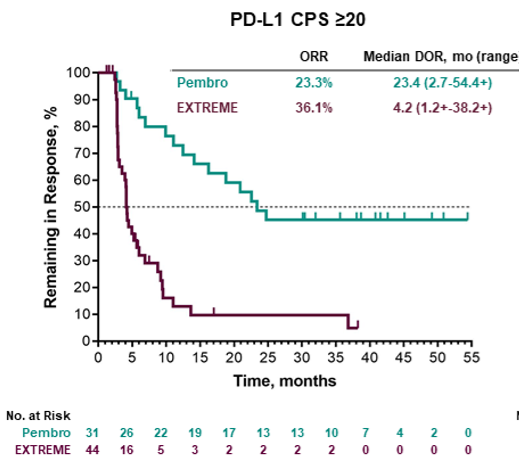
持续缓解时间:在PD-L1表达阳性(CPS≥20)患者中,K药的客观缓解率(ORR)虽然比标准治疗稍低,但中位持续缓解时间(DOR)超5倍(23.4个月 vs 4.2个月)。
安全性:在全部患者中,K药相比标准治疗,不良反应发生率大幅下降(58.3% vs96.9%),3级以上不良反应发生率仅为四分之一(17.0% vs 69.3%)。
上海市东方医院肿瘤医学部副主任兼一期临床试验中心主任郭晔教授表示:“KEYNOTE-048研究是头颈部鳞癌中一个跨时代的研究,奠定了帕博利珠单抗一线治疗复发转移头颈鳞癌的经典地位。今年的长期数据更新也具有特殊意义,4年生存率整体提高了接近3倍。随着时间的延长,帕博利珠单抗在某一部分患者中的长期生存获益甚至达到了接近治愈的效果,这是过往治疗中非常难得一见的。”
随着K药新适应证的获批,越来越多的中国患者可以从免疫治疗中获益,有望获得更持久的疗效缓解和更长期的生存获益,最终提升中国癌症整体的5年生存率,离“不治之症”越来越远。