活体动物CRISPR基因编辑成功治疗癌症
随着科技进步和医学发展,许多过去让人们束手无策的疾病如今都逐一被缓解,甚至彻底治愈。然而,癌症——作为“众病之王”,却仿佛一道难以攻克的天堑,至今仍未完全被人类所战胜。
从传统的癌症治疗方法,如放疗和化疗,再到如今新兴的肿瘤治疗方法——靶向药物、溶瘤病毒以及免疫治疗,科学的进步为肿瘤患者带来了新的希望,但遗憾的是,这些方法并不能彻底解决癌症这一难题。
因此,这也迫使人类不断开发更新、更高效的癌症治疗方法!
2020年11月18日,以色列特拉维夫大学的研究人员在 Science 子刊Science Advances 杂志上发表题为:CRISPR-Cas9 genome editing using targeted lipid nanoparticles for cancer therapy 的研究论文。
这项研究为世界首例证实CRISPR/Cas9系统可以有效治疗活体动物转移性癌症的研究。
研究人员开发了一种新的基于脂质纳米颗粒(LNP)的CIRSPR递送系统——CRISPR-LNP,并在两种侵袭性和不可治愈的癌症类型——胶质母细胞瘤和卵巢癌中表现出良好的治疗效果。

CRISPR技术的迅速发展正在潜移默化地改变着生命科学研究领域乃至人类世界。目前,CRISPR技术已经广泛应用于基因编辑、基因治疗、核酸定位及核酸检测等领域。
2020年10月7日,两位在CRISPR基因编辑领域做出杰出贡献的科学家——Emmanuelle Charpentier和Jennifer A. Doudna更是被授予了2020年诺贝尔化学奖。
近年来,分子靶向药物和免疫治疗等的兴起极大地改善了癌症反应,降低了药物毒性和不想反应。然而,大多数类型癌症的高复发率和耐药性的发展促使我们不断开发新的治疗方式。
值得注意的是,CRISPR-Cas9基因编辑技术从原理上可以永久破坏肿瘤生存基因,从而克服传统癌症疗法的重复剂量限制,提高治疗效果。
但遗憾的是,CRISPR-Cas9技术用于癌症治疗一直受到肿瘤细胞编辑效率低和现有递送系统潜在毒性的阻碍。
在这项研究中,研究团队报道了用于治疗性基因组编辑的靶向非病毒脂质纳米颗粒(LNP)递送系统的开发,并在胶质母细胞瘤和卵巢癌这两种侵袭性和不可治愈的癌症模型中对其进行了评估。
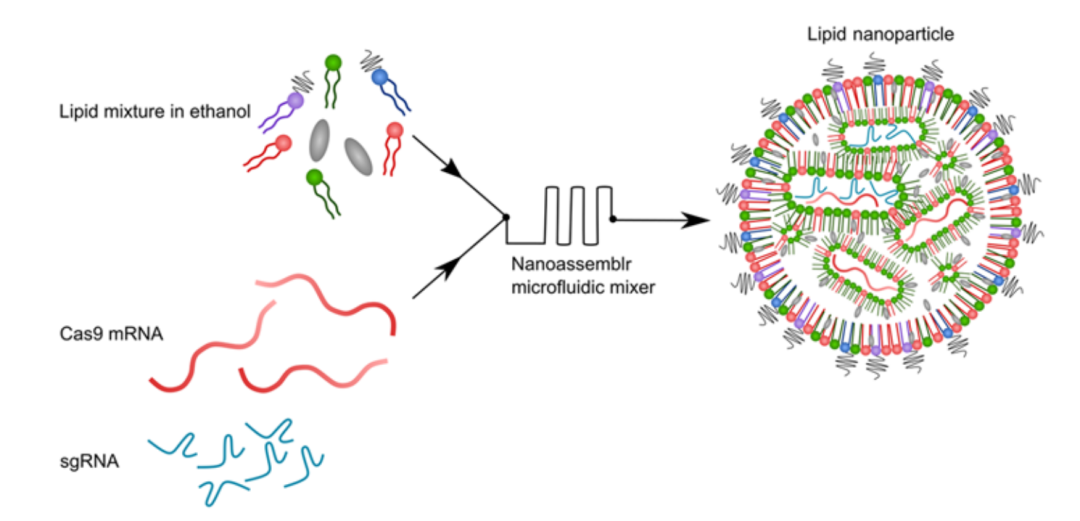
CRISPR-LNP的设计与构建
该研究得通讯作者Dan Peer教授表示,这是世界上第一个证明CRISPR基因组编辑系统可以在活体动物身上有效治疗癌症的研究,必须强调的是,这不是化疗,没有副作用,并且用这种方法治疗的癌细胞将永远不会再活跃起来。Cas9的分子剪刀切断癌细胞的DNA,从而去除它,永久阻止癌细胞复制。
为了确定这项技术在治疗癌症上的可行性,Dan Peer 教授及其研究团队选择了两种最致命的癌症——胶质母细胞瘤和转移性卵巢癌。
胶质母细胞瘤是一种侵袭性最强的脑癌,诊断后预期寿命为15个月,5年生存率仅为3%。研究人员证明,仅用CRISPR-LNP进行一次脑内注射治疗,就可以使患有胶质母细胞瘤的小鼠的平均寿命增加一倍,抑制肿瘤生长50%,提高生存率30%!
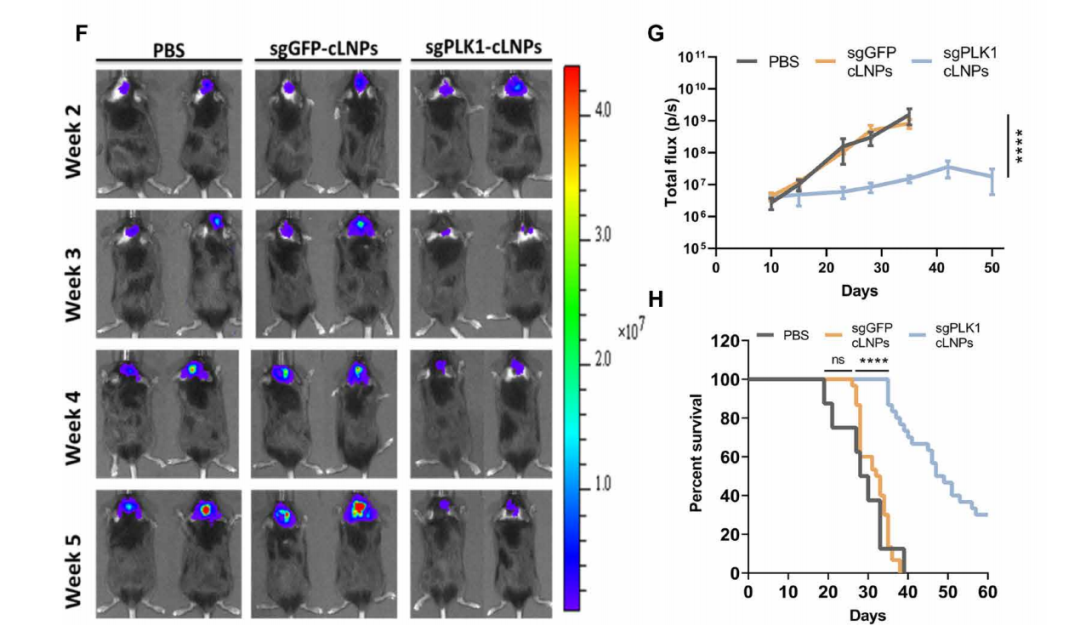
CRISPR-LNP对小鼠脑内的胶质母细胞瘤有良好的治疗效果
与此同时,卵巢癌是女性疾病死亡的重要原因,也是女性生殖系统中最致命的癌症。大多数患者确诊时已是卵巢癌晚期,此时癌细胞已经扩散到全身。尽管近年来取得了进展,但也仅有三分之一的患者能活下来。
为了治疗扩散性卵巢癌,CRISPR-LNP也被研究团队设计用于抗体靶向递送,腹腔注射EGFR靶向的CRISPR-LNP可选择性摄取到播散性卵巢肿瘤,体内可进行高达80%的基因编辑,抑制肿瘤生长,并提高小鼠80%的总生存率!
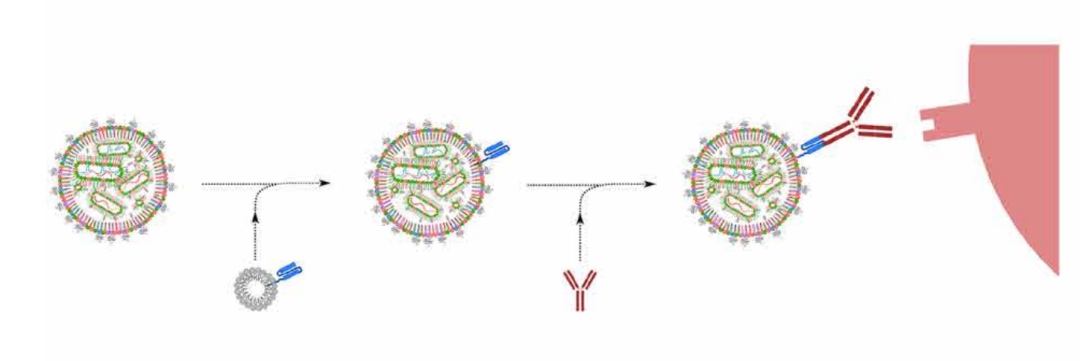
抗体靶向递送的CRISPR-LNP设计原理图
CRISPR基因编辑技术,能够识别和改变几乎任何基因片段,已经彻底改变了我们以个性化的方式破坏、修复甚至替换基因的能力,尽管CRISPR在研究中得到了广泛应用,但临床应用仍处于起步阶段,因为需要一个有效的传递系统来安全、准确地将CRISPR传递到靶细胞。
而该研究中开发的CRISPR-LNP递送系统,可以高效靶向肿瘤生存基因,这是一种创新疗法,用于治疗目前一些尚无有效疗法的恶性肿瘤。
值得一提的是,将CRISPR基因编辑技术应用于癌症治疗,并非Dan Peer团队的“一家之言”,例如2020年3月9日,武汉大学程巳雪团队就在国际著名期刊 Advanced Materials 杂志(IF=25.809)发表了题为:Aptamer/Peptide-Functionalized Genome-Editing System for Effective Immune Restoration through Reversal of PD-L1-Mediated Cancer Immunosuppression 的研究论文。
该研究开发了一种基于天然聚合物的基因治疗递送系统,能够将CRISPR-Cas9基因编辑质粒特异性递送至肿瘤细胞核,进而敲除&β;-catenin,下调肿瘤细胞上PD-L1表达,逆转PD-L1介导的肿瘤免疫逃逸,增强T细胞对肿瘤的杀伤力!

总而言之,本研究基于CRISPR基因编辑技术和脂质纳米颗粒(LNP)开发的联合系统——CRISPR-LNP在治疗胶质母细胞瘤和转移性卵巢癌小鼠模型上展示出惊人的潜力。更重要的是,这项技术具有广阔的应用前景,它将为治疗其他类型的癌症、罕见的遗传疾病和慢性病毒疾病(如艾滋病)开辟了无数新的可能性。
据悉,Dan Peer教授团队现在计划继续对血液类癌症以及杜氏肌萎缩症等遗传疾病进行相关实验,Dan Peer教授表示,这种创新疗法可能还需要一段时间才能用于人类,但对此持乐观态度。正如12年前,当我们第一次谈到基于mRNA的治疗时,人们还以为这是科幻小说。
论文链接:
https://advances.sciencemag.org/content/6/47/eabc9450
https://doi.org/10.1002/adma.202000208