DB01研究结果更新 DS-8201这匹黑马在HER2+晚期乳腺癌治疗中一骑绝尘
受新冠疫情影响,2020年第43届美国圣安东尼奥乳腺癌研讨会(San Antonio Breast Cancer Symposium,SABCS)于当地时间12月8~11日以线上会议的形式召开。SABCS作为乳腺领域规模最大、最具影响力的国际性会议,各种乳腺癌诊疗的最新研究结果应接不暇,为大众带来了一场乳腺癌的视听盛宴。其中,在HER2阳性乳腺癌领域内,本次大会进一步更新DESTINY-Breast01研究的结果,DS-8201这匹黑马又将会给大家带来怎样的惊喜呢?【肿瘤资讯】特别邀请到复旦大学附属肿瘤医院张剑教授,解读2020 SABCS会上DESTINY-Breast01研究更新结果。

DESTINY-Breast01数据更新,mPFS为19.4个月,后线解救治疗地位稳固
DESTINY-Breast01 是一项单臂、开放、全球多中心2期临床研究。研究分为两部分,在第一部分中,研究者评估了三种不同剂量(5.4 mg/kg、6.4 mg/kg、7.4 mg/kg)的疗效以确定推荐剂量;研究的第二部分旨在评估推荐剂量的有效性和安全性。最终,研究者推荐了 DS-8201(5.4 mg/kg)作为评估单药疗法治疗 HER2阳性、转移性乳腺癌患者的疗效和安全性。研究纳入了T-DM1治疗过程中或治疗后进展的HER2阳性MBC患者184例,这些患者先前已接受过2种或多种抗HER2靶向方案,治疗转移性疾病的既往疗法中位数为6。患者均接受5.4 mg/kg DS-8201治疗。主要终点是ORR, 其他终点包括DoR,PFS和OS。
在本次大会公布的更新结果中,截止2020年6月8日,中位随访时间增加至20.5个月,37名患者(20.1%)仍在接受治疗。其中,客观缓解率(ORR) 为61.4%(12例CR),中位缓解持续时间(DoR)为20.8个月,疾病控制率(DCR)为97.3%(95%CI,93.8-99.1),更新的mPFS为19.4个月(95%CI,14.1个月-NE)。12个月时估计的OS率为85%(95%CI,79%-90%),18个月时为74%(95%CI,67%-80%)。初步mOS为24.6个月(估计成熟度为35%,24个月时仅17例患者存在风险)。同时,并未发现新的安全性问题,经过9个月的随访,仅报告了3例新的DS-8201相关性间质性肺病(ILD)。
表1:DESTINY-Breast01研究数据更新对比


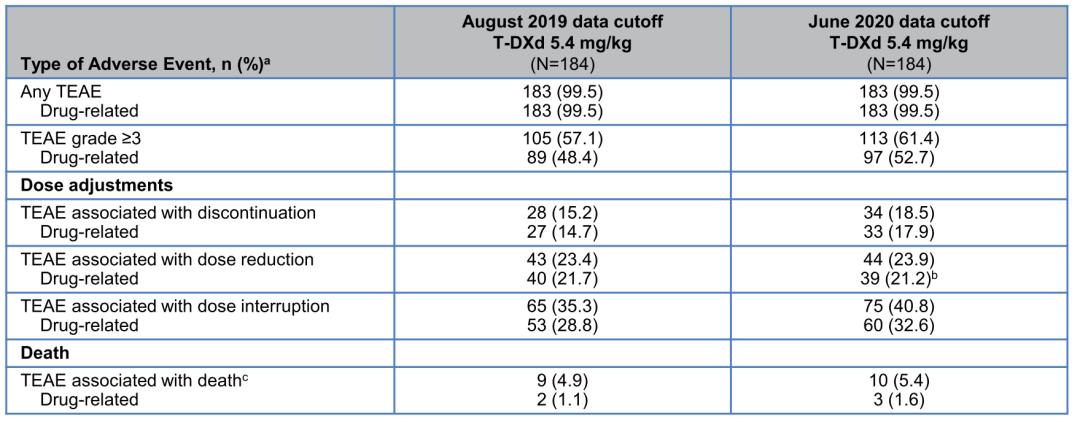
图1:DESTINY-Breast01研究中OS曲线图
2019年基于DESTINY-Breast01研究,FDA正式批准DS-8201用于HER2阳性乳腺癌的后线治疗
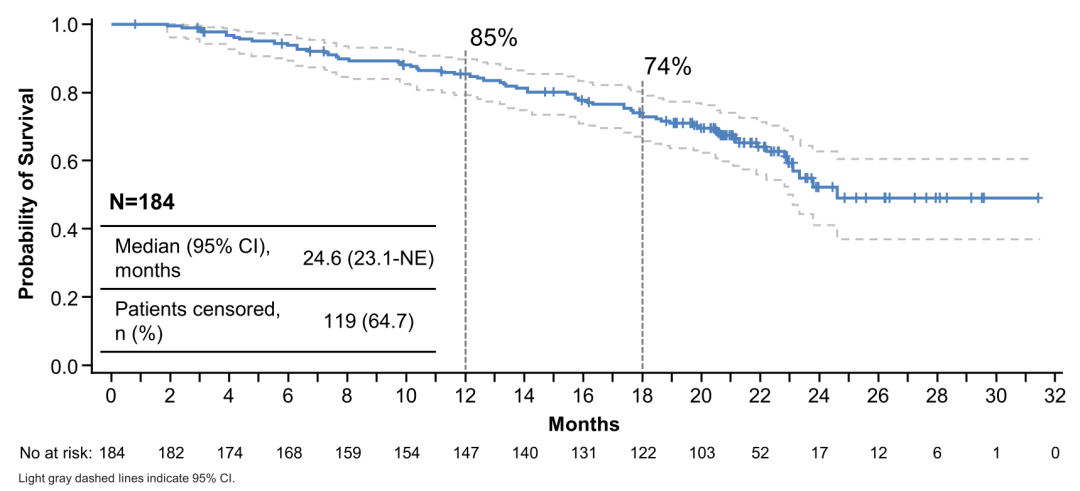
在既往的研究结果中,截止2019年8月1日,中位随访11.1个月(0.7-19.9),仍有79名患者(42.9%)正在治疗。结果显示,DS-8201作为后线治疗的ORR为60.9%(95%CI,53.4-68.0),其中完全缓解(CR)为6%(n=11),部分缓解(PR)为54.6%(n=101),疾病稳定(SD)为36.4%(n=67)。疾病控制率(DCR)为97.3%,中位缓解持续时间(DoR)为14.8个月(95%CI,13.8-16.9),中位无进展生存期(PFS)为16.4个月(95%CI,12.7-NE)。中位总生存期(OS)尚未达到,估计的一年生存率为86%。不良反应方面,消化道和血液学不良事件在治疗中较为常见,3级及以上不良事件最多为中性粒细胞减少(20.7%)、贫血(8.7%)和恶心(7.6%)。
表2:安全性相关数据
2019年全球乳腺癌会议SABCS公布DESTINY-Breast01数据的当天,其在全球顶级医学杂志《新英格兰杂志上》同期发布了II期临床数据。回顾DS-8201的历史,2017年DS-8201被美国FDA授予突破性疗法认定,用于治疗HER2阳性局部晚期或转移性乳腺癌患者。2019年10月,美国FDA接受DS-8201的生物制品许可申请(BLA),并授予其优先审评资格。2019年12月,FDA加速批准DS-8201上市。这款创新药物在这么短的时间里一路通关,充分显示了其卓越的疗效和安全性。
张剑教授点评
DS-8201是一种新型的HER2靶向抗体-细胞毒药物偶联剂,由人源化HER2单克隆抗体曲妥珠单抗偶联一种新型拓扑异构酶I抑制剂(DXd)构建而成,可将细胞毒药物DXd靶向传递至肿瘤细胞内,促进其凋亡,发挥有效的抗肿瘤作用。这一作用机制可较化疗减少细胞毒药物的暴露,在起效的同时,减少不良反应的发生,具有更好的安全性。同时,从药物本身的结构特点和作用机制出发,其偶联的DXd具有更强的膜穿透性,可发挥更强的旁观者效应。此外,DS-8201具有较高的药物抗体(DAR),可发挥更强的肿瘤杀伤效应。
在2019年SABCS上亮相的DESTINY-Breast01研究无疑为DS-8201在晚期乳腺癌的应用奠定了基础。基于此研究,2019年12月FDA加速批准了DS-8201的审批上市,以弥补HER2阳性患者三线标准治疗的空白。而在本次更新的结果,DS-8201继续保持其良好的疗效和安全性,在多线治疗后的HER2+乳腺癌患者中,疾病控制率可达97.3%,客观缓解率达61.4%,初步中位生存期(mOS)达24.6个月,其结果无疑将会改写HER2+晚期乳腺癌多线治疗的临床实践。目前,DS-8201尚未在中国获批上市。鉴于其良好的疗效和安全性,因此,期待DS-8201未来能够早日在国内上市,为晚期HER2阳性乳腺癌以及早期HER2阳性乳腺癌患者带来更大的临床获益。
HER2阳性晚期乳腺癌一线选择以曲妥珠单抗为基础的治疗,耐药后,DS-8201作为更为强效的新型ADC药物,其作为二线治疗是否会有所建树,值得期待。鉴于此,DESTINY-Breast03研究进一步在接受曲妥珠单抗联合紫杉类药物治疗的HER2阳性晚期乳腺癌中对比了DS-8201与T-DM1的疗效和安全性,对二线治疗地位发起挑战。这项全球多中心、开放标签III期研究将纳入500例患者,随机分为两组,分别接受DS-8201(5.4 mg/kg,q3w)或T-DM1(3.6 mg/kg,q3w)。研究主要终点为PFS,次要终点包括OS、ORR、DoR等,期待其结果早日公布,为临床实践提供更多有价值的参考信息。