2020 SABCS:乳腺癌内分泌治疗重磅研究盘点
2020年圣安东尼奥乳腺癌大会(SABCS)于12月8日至12日以线上虚拟会议的形式召开。乳腺癌内分泌治疗有哪些重磅研究呢?让我们一睹为快!
01
MONALEESA-7研究总生存期(OS)结果更新
背景:MONALEESA-7(NCT02278120)是一项大型III期随机试验,旨在评估内分泌治疗(ET)+ ribociclib对比ET+安慰剂用于绝经前或绝经后HR+/HER2-晚期乳腺癌的疗效和安全性。2019年发表在《NEJM》杂志上的研究显示,ribociclib+ET对比安慰剂+ET可显著改善患者OS,两组的中位OS分别为未达到和40.9个月(HR=0.71,P = 0.00973)。本次SABCS大会公布了自上次随访(中位随访约4年)之后额外20个月的OS探索性分析结果。
方法:研究纳入绝经前或围绝经期HR+/HER2-晚期乳腺癌患者,并按1:1比例随机分配接受ribociclib或安慰剂+戈舍瑞林+非甾体芳香酶抑制剂(NSAI;来曲唑或阿那曲唑)或他莫昔芬治疗。Ribociclib+NSAI已获批用于绝经前或围绝经期患者。研究排除既往接受过CDK4/6抑制剂或ET的患者(新)辅助治疗中接受ET或晚期患者既往接受至多一线化疗的患者符合入组条件。分层因素包括是否有肝/肺转移、既往是否接受过化疗、ET+NSAI或ET+他莫昔芬。研究采用Cox比例风险模型评估OS。
结果:数据截止日期为2020年6月29日,中位随访时间53.5个月时,ribociclib+ET仍显示出OS获益,ribociclib+ET和安慰剂+ET的中位OS分别为58.7个月和48个月(HR=0.76)。
NSAI亚组患者中,ribociclib+ET和安慰剂+ET的中位OS分别为58.7个月和47.7个月(HR=0.80)。亚组分析显示了与ITT人群一致的生存获益。
ITT人群中,ribociclib+ET和安慰剂+ET组的中位PFS2分别为44.2个月和31个月(HR=0.68);NSAI亚组中,两治疗组的中位PFS2分别为43.6个月和30.4个月(HR=0.69)。
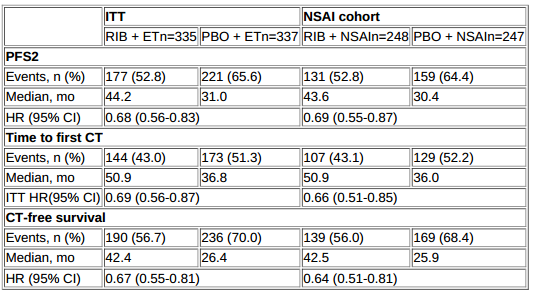
ITT人群中,ribociclib+ET和安慰剂+ET组的中位至化疗时间分别为50.9个月和36.8个月(HR=0.69);NSAI亚组中,两治疗组的中位至化疗时间分别为50.9个月和36个月(HR=0.66)。ITT人群中,ribociclib+ET和安慰剂+ET组的中位无化疗生存期分别为42.4个月和26.4个月(HR=0.67);NSAI亚组中,两治疗组的中位无化疗生存期分别为42.5个月和25.9个月(HR=0.64)。
在停止研究治疗的患者中,ribociclib+ET和安慰剂+ET分别有77.3%和78.1%患者接受了后续抗肿瘤治疗,分别有12.9%和26.1%的患者接受了后续CDK4 / 6抑制剂治疗。此外,安慰剂组中有15例患者疾病进展后交叉至ribociclib组接受治疗。
结论:更长时间随访显示,与单独ET相比,ribociclib+ET仍可明显改善绝经前或围绝经期HR+/HER2-晚期乳腺癌患者的OS。同样,ribociclib+ET也可改善患者的中位至化疗时间和中位无化疗生存期。
02
SOLAR-1研究更新:Alpelisib+氟维司群可为PIK3CA突变各亚组患者带来获益!
背景:恶性肿瘤中PI3K信号通路常被异常激活。HR+/HER2-晚期乳腺癌患者中约有40%患者为PIK3CA突变,PIK3CA基因编码p110α蛋白,该蛋白为PI3K酶的催化亚基之一。PIK3CA突变会导致PI3K信号通路的异常激活,而导致细胞增殖、药物耐药性和不良预后。
Alpelisib是一种选择性PI3Kα抑制剂。III期SOLAR-1研究显示,Alpelisib+氟维司群可明显改善芳香酶抑制剂治疗进展的PIK3CA突变、HR+/HER2-晚期乳腺癌患者的PFS。SOLAR-1研究中,使用基于PCR的分析方法检测肿瘤组织的PIK3CA突变。本研究通过第二代测序(NGS)和PCR检测肿瘤组织和ctDNA中的PIK3CA突变,并回顾性分析Alpelisib在PIK3CA突变亚组中的有效性。在这项探索性生物标记物分析中,研究者分析了PIK3CA突变(通过NGS检测ctDNA)患者的临床结局。
方法:SOLAR-1是一项随机双盲、安慰剂对照的III期研究,旨在评估Alpelisib(300mg)或安慰剂+氟维司群(500mg)用于男性和绝经后HR+/HER2-晚期女性乳腺癌的疗效和安全性。使用Foundation Medicine 324基因ctDNA panel检测基线收集的血浆ctDNA的PIK3CA基因的完整外显子区域序列。采用Kaplan-Meier方法评估PFS。
结果:在SOLAR-1研究的572例患者中,PIK3CA突变和非突变组有381例(66.6%)患者的血浆ctDNA数据可用。其中,193例(50.7%)患者为PIK3CA突变,168例(87%)患者具有PCR可检测的突变,147例(76%)患者为单突变。分别有70 例(36%)和102例(53%)患者为外显子9和20的PIK3CA突变。Alpelisib+氟维司群可延长PIK3CA突变(通过NGS检测ctDNA)患者(n=101)的PFS。在PCR检测的PIK3CA突变、单突变(n=83)、外显子9(n=34)和外显子20(n=54)突变患者中也能观察到联合治疗的临床获益。
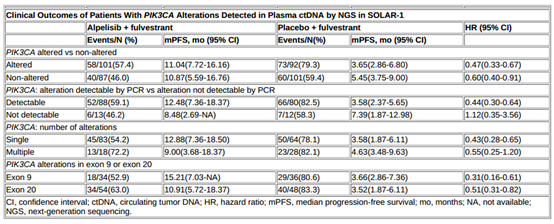
结论:Alpelisib+氟维司群可为PIK3CA突变患者带来临床获益。同时,可为单突变、外显子9和20 PIK3CA突变患者带来临床获益。总之,在PIK3CA突变(经NGS检测ctDNA)患者的各亚组患者中,Alpelisib+氟维司群均可带来生存获益。
03
再添新证:Alpelisib+来曲唑或可作为CDK4/6抑制剂进展后PIK3CA突变患者有效方案!
背景:PIK3CA突变见于~40%的HR+/ HER2-晚期乳腺癌患者中,可导致内分泌治疗的耐药。Alpelisib+氟维司群在III期SOLAR-1研究中显示出较好疗效,该研究的PIK3CA突变队列纳入了20例既往接受CDK4/6抑制剂的患者。CDK4 / 6抑制剂治疗进展的PIK3CA突变患者治疗方案的临床数据有限。
BYLieve(NCT03056755)研究是一项正在进行的多中心、开放标签、3队列非对照II期临床研究,是首个评估Alpelisib +ET(氟维司群或来曲唑)用于既往治疗(包括CDK4/6抑制剂)进展后PIK3CA突变、HR +/HER2-患者的临床研究。既往结果中,队列A(既往接受CDK4/6抑制剂+芳香化酶抑制剂)患者接受了Alpelisib+氟维司群治疗,中位随访11.7个月时,队列A达到了主要终点,结果显示,6个月时,50.4%患者仍存活且无疾病进展(PD)(n = 61),中位PFS为7.3个月(n = 72)。本次会议公布了队列B(既往接受CDK4/6抑制剂+氟维司群)的研究结果。
方法:队列B患者每日接受Alpelisib(300mg)+来曲唑(2.5mg)治疗。每个队列计划纳入112例经确认的PIK3CA 突变患者,并根据既往治疗分为三个队列,队列A:既往接受CDK4/6抑制剂+芳香化酶抑制剂;队列B:既往接受CDK4/6抑制剂+氟维司群;队列C:既往接受化疗或内分泌治疗。主要终点为6个月时研究者评估的PIK3CA 突变患者的存活率。男性和绝经前女性允许每28天皮下注射戈舍瑞林 3.6 mg或肌肉注射亮丙瑞林7.5 mg。
结果:队列B纳入了126例既往接受CDK4/6抑制剂+氟维司群的患者,其中,115例为PIK3CA突变患者。中位随访15.0个月时,58例(46.0%)转移性患者接受过≥2线治疗,其中103例(81.7%)患者接受既往芳香化酶抑制剂后进展。研究达到队列B的主要终点,6个月时,46.1%患者存活且无疾病进展。中位PFS为5.7个月。最常见任意等级的不良事件(AE)(≥25%)为腹泻(67.5%)、高血糖(63.5%)、恶心(54.8%)、食欲下降(44.4%)、口腔炎(34.1%)、疲劳(31.0%)、皮疹(31.0%)和呕吐(24.6%)。最常见的≥3级不良事件包括高血糖(25.4%)、皮疹(9.5%)和斑丘疹(7.9%)。导致停药的不良事件发生率为14.3%(n = 18),导致停药的最常见AE是皮疹(4例,3.2%,包括斑丘疹)、疲劳和腹泻(3例,各占2.4%)。
结论:Alpelisib+来曲唑在既往接受CDK4/6抑制剂治疗进展患者中有效。结果提示,Alpelisib+来曲唑或可作为既往接受CDK4/6抑制剂治疗PIK3CA突变HR+/HER2-晚期患者中的有效治疗方案。
04
高风险疾病患者能从坚持ET中获得最大获益!
背景:乳腺癌确诊时,年龄年轻是乳腺癌复发和死亡的孤立风险因素,而在HR+乳腺癌中,年龄年轻是最大的影响因素。年轻女性不太可能坚持内分泌治疗而导致不同的结局。
方法:该研究纳入2006-2016期间年龄≤40岁、诊断为HR+的I-III期女性乳腺癌患者。每年进行1-2次包括评估社会人口统计学和治疗信息在内的连续调查。病历审查用以确定分期和HR状态并确认复发性疾病类型(局部、远处或新发原发性乳腺癌)。开始内分泌治疗但在诊断后5年内停止治疗被定义为“非持续性”。利用单变量和多变量回归模型确定非持续性治疗是否为患者复发的预测因子。
结果:在607例开始接受内分泌治疗的女性患者中,诊断时中位年龄为36,I、II、III期患者分别占38%、45%和17%。16%(99/607)患者为“非持续性”,其中30%(30/99)患者在诊断后2年内停止内分泌治疗,超一半患者(54%,54/99)3年内停止治疗。多变量回归分析中,诊断时更年轻的患者(年龄≤30 vs. 36-40:OR=3.39;31-36 vs. 36-40:OR=2.81)更有可能停止治疗,而诊断时分期较高患者则不太可能终止治疗(II期 vs I期:OR=0.46;III期 vs I期:OR=0.32)。
诊断后的中位随访7.8年时,15%女性(88/607)复发或发展为新的原发性乳腺癌,其中,66%(58/88)患者为远处复发,32%(28/88)患者为局部复发,2%(2/88)为新发原发性乳腺癌。在多变量回归分析中,非持续性接受内分泌治疗患者复发的可能性较小(OR=0.43),而分期较高患者复发的可能性更高(III期vs 1期:OR=2.36)。其他因素不是疾病复发的预测因素。
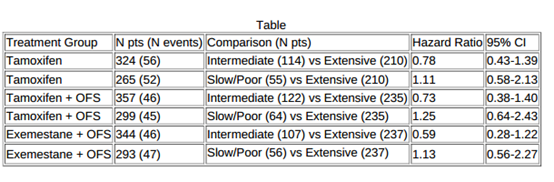
结论:约16%的HR+乳腺癌女性患者比预期更早停止内分泌治疗,但是该队列研究显示,非持续性接受内分泌治疗并不是乳腺癌复发的危险因素。重要的是,高风险疾病患者可能从坚持内分泌治疗中获益最大,因此停止治疗的可能性较小。
05
新辅助内分泌治疗模型:预测最合适的新辅助治疗方案!
背景:新辅助内分泌治疗为II/III ER+/HER2-绝经后乳腺癌患者增加了保乳手术机会。在COVID19大流行期间,有限的手术可及性凸显了新辅助内分泌治疗的实用性。诊断时无法识别内分泌治疗耐药性有可能导致疾病进展(PD),并延迟了有效治疗方案的使用。近期有研究显示,新辅助内分泌治疗开始后的2-4周的ER、PR、Ki67(> 15%vs ≤15%)和Ki67(> 10% vs ≤10%)基线水平可能会改进患者内分泌治疗的选择。
方法:基于ER、PR和Ki67的预测模型将适合进行新辅助内分泌治疗的ER+/HER2-患者分为3组:第1组:可能不合适新辅助内分泌治疗(Allred ER <6或ER 6和PgR <6);第2组:可能适合新辅助内分泌治疗,考虑在内分泌治疗后2-4周时进行Ki67分析(基于治疗过程中,Ki67>10%与预后较差相关)(2A:ER 7或8且PgR <6;2B:ER 6或7且PgR≥6);第3组:适合新辅助内分泌治疗(ER 8且PgR≥6)。ALTERNATE研究中,II或III期绝经后患者随机分配,ER +(Allred评分6-8)/HER2- 绝经后乳腺癌患者接受6个月的阿那曲唑或氟维司群或阿那曲唑+氟维司群,除非在第4周或第12周活检时,Ki67>10%,这种情况下,对患者进行分类以接受新辅助化疗或手术治疗。
结果:在随机接受6个月新辅助内分泌治疗的1299例合格患者中,214例患因缺乏Allred评分(n=41)或未进行4周Ki67测定(n = 173)而被排除在外。剩余1085例患者中,第1、2和3组患者分别占1%(n = 10)、43%(n = 468)和56%(n = 607)。治疗期间Ki67> 10%使90%(9/10,1组)、30%(141/468,2组)、17%(104/607,3组)患者从新辅助内分泌治疗转为新辅助化疗或手术(表 1)。在第2组和第3组的1075例患者中,260例(24%)患者基线时Ki67≤15%,其中仅14例(5.4%)患者4周时Ki67> 10%,相比之下,28.3%患者(231/815)基线时Ki67>15%,4周时Ki67>10%,其中2%患者因治疗时Ki67<10%仍接受内分泌治疗而发生疾病进展。
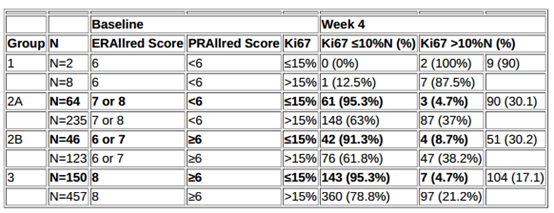
结论:ALTERNATE研究支持该模型,该模型可将诊断时的ER、PR和Ki67水平用于识别原发性绝经后ER+/HER2-乳腺癌是否适合新辅助内分泌治疗。基线ER Allred评分> 6且Ki67≤15%时,患者对内分泌治疗耐药的可能性很小;基线Ki67> 15%时,内分泌治疗的敏感性可变,治疗期间活检检测Ki67值可能有助于指导新辅助治疗,特别是当Ki67<10%时,局部疾病进展率极低。
06
延长内分泌治疗是否获益,BCI预测模型更实用!
背景:对于早期HR+乳腺癌患者,将内分泌治疗延长至5年以上可减少远期远处复发和新发原发性乳腺癌持续风险,但也与潜在严重毒性反应和不良反应相关,可能会损害患者的质量生活。建议通过临床病理因素和预后生物标志物进行风险分层以指导患者选择,而可直接预测治疗反应生物标志物具有临床实用性。乳腺癌指数(BCI)是基于基因表达的特征,提供以下信息:1)BCI预后(BCI评分),将分子等级指数(MGI)与HOXB13 / IL17BR(H / I)比率相结合,提供远期远处复发的个体化风险(5年后)信息;2)BCI预测(BCI H / I),可预测延长内分泌治疗是否获益。在这项研究中,通过比较IDEAL研究中接受治疗患者的预后风险与内分泌应答的预后风险与内分泌治疗应答,探索来曲唑延长治疗5 vs 2.5年的治疗获益。
方法:908例患者肿瘤组织纳入预设的盲法分析,主要终点为无复发间期(RFI)。高危临床风险定义为pN +和≥pT2;低危临床风险定义为pN0或pN1和pT1或G1。基因组风险由BCI预后类别定义(高风险vs低风险)。
结果:不论临床风险类别如何,高BCI(H/I)内分泌治疗反应性患者接受来曲唑治疗的5年获益明显优于2.5年,而不论临床风险类别如何,低BCI(H/I)的患者接受来曲唑治疗5年 vs 2.5年的获益无统计学意义。高BCI(H/I)(分别为12.5%和15.1%)时,高危和低危临床风险患者均获得了相似的获益。
不论BCI预后风险类别,BCI(H / I)的预测能力相当。高风险/高BCI(H/I)评分患者明显获益于延长治疗(HR=0.42,P = 0.020),而高风险/低BCI评分患者接受内分泌治疗有较大的远处复发风险(〜20%),对延长内分泌治疗无应答(HR=1.05,P=0.880)。
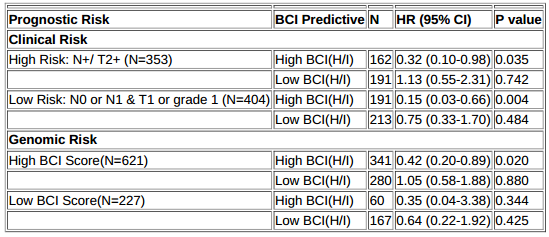
结论:结果提示,复发风险 vs 内分泌治疗反应性显示了HR+早期乳腺癌不同的肿瘤生物学特征。BCI(H/I)作为识别患者内分泌反应性的分子特征,是延长内分泌治疗和预后改善的关键决定因素。与风险评估相比,BCI(H/I)预测内分泌治疗获益是一种更实用的方法,可以个性化中止治疗或继续治疗,以及延长内分泌治疗的持续时间。
参考文献:
PD2-04-Updated overall survival(OS) results from the phase III MONALEESA-7 trial of pre- or perimenopausal patients with hormone receptor positive/human epidermal growth factor receptor 2 negative(HR+/HER2-) advanced breast cancer(ABC) treated with endocrine therapy(ET) ± ribociclib .2020 SABCS.
PD2-06-Clinical outcomes of alpelisib plus fulvestrant in hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer with PIK3CA alterations detected in plasma ctDNA by next-generation sequencing: Biomarker analysis from the SOLAR-1 study.2020 SABCS.
PD2-07-Alpelisib + letrozole in patients with PIK3CA-mutated, hormone-receptor positive(HR+), human epidermal growth factor receptor-2-negative(HER2-) advanced breast cancer(ABC) previously treated with a cyclin-dependent kinase 4/6 inhibitor(CDK4/6i) + fulvestrant: BYLieve study results .2020 SABCS.
PD2-08-Endocrine therapy non-persistence and recurrence in young women with early stage breast cancer .2020 SABCS.
PD2-10 -Validation of a predictive model for potential response to neoadjuvant endocrine therapy(NET) in postmenopausal women with clinical stage II or III estrogen receptor positive(ER+) and HER2 negative(HER2-) breast cancer(BC): An ALTERNATE trial analysis(Alliance A011106) .2020 SABCS.
PD2-11-Breast cancer index is a molecular signature of endocrine responsiveness that determines extended endocrine benefit independent of prognostic risk.2020 SABCS.