通过人类脑转移的的基因特征确定转移性肺腺癌的驱动因素
Genomic characterization of human brain metastases identifies drivers of metastatic lung adenocarcinoma
通过人类脑转移的的基因特征确定转移性肺腺癌的驱动因素
David J.H.Shih et al. Nat Genet. Apr. 2020.
背景
大约有30%的肺腺癌患者在初治时具有脑转移,最终有50%的患者发展为脑转移。肺腺癌脑转移(BM-LUAD)治疗选择很少且疗效有限,因此研究脑转移驱动基因并鉴定治疗靶点是很有必要的。
方法
为了鉴定哪些基因变异促进脑转移的发生,我们利用全外显子测序检测了73例肺腺癌脑转移(BM-LUAD)的样本,在105位孤立BM-LUAD患者中进行验证,同时在人源小鼠肿瘤模型中进行方法学评估验证。
结果
用病例对照体细胞变异分析,我们发现相比于503例来源于TCGA(The Cancer Genome Atlas)的原发肺腺癌(TCGA-LUAD)样本,BM-LUAD人群中拷贝数变异的基因发生频率更高。我们发现了BM-LUAD中3个高频扩增的区域,包括MYC(12vs6%), YAP1(7vs0.8%) 和 MMP13(10vs0.6%),以及高频缺失的区域CDKN2A/B(27vs13%)。我们证实了在孤立105位BM-LUAD患者中,MYC, YAP1和MMP13扩增频率提高。在人源小鼠肿瘤模型中,方法学评估验证了MYC, YAP1和MMP13过表达会增加脑转移的发生率。这些结果表示体细胞变异促进了脑转移发生,同时证明了足够脑转移样本量的基因测序可以揭露先前未知的转移性驱动基因。
我们利用全外显子测序检测了73例肺腺癌脑转移(BM-LUAD)的样本。用病例对照体细胞变异分析,用BM-LUAD人群与503例来源于TCGA(The Cancer Genome Atlas)的原发肺腺癌(TCGA-LUAD)样本进行比较。检测体细胞拷贝数变异(SCNAs)时发现,相比于TCGA-LUAD ,BM-LUAD中含有CDKN2A/B纯合缺失的表达显著升高。与此同时,BM-LUAD中有3个区域扩增显著升高,包括含有MYC的区域,包含YAP1、BIRC3和TMEM123的区域,以及包含EDNRA, ARHGAP10 和NR3C2(图1)。
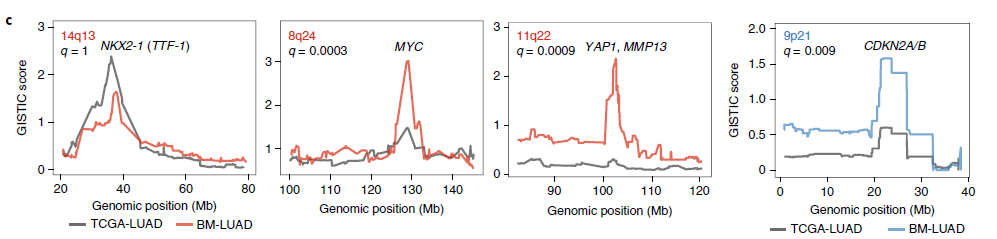
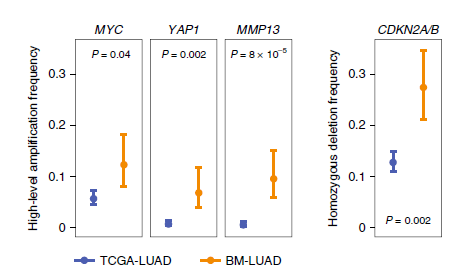
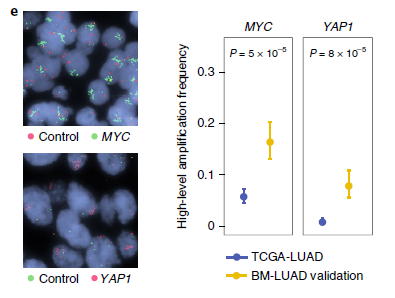
我们进一步证实了候选SCNA驱动基因在BM-LUAD要显著高于TCGA-LUAD。MYC 扩增在BM-LUAD 和TCGA-LUAD的发生率为12% vs 6%;YAP1扩增发生率为7% vs 0.8%;MMP13扩增发生率为10% vs 0.6%;CDKN2A/B缺失发生率为27% vs 13%(图2)。我们获得了105例BM-LUAD孤立验证样本,FISH显示98例样本中9例有YAP1和MMP13的扩增;94例样本中有20例MYC的扩增。相比于TCGA-LUAD,BM-LUAD人群中显著增加(图3)。
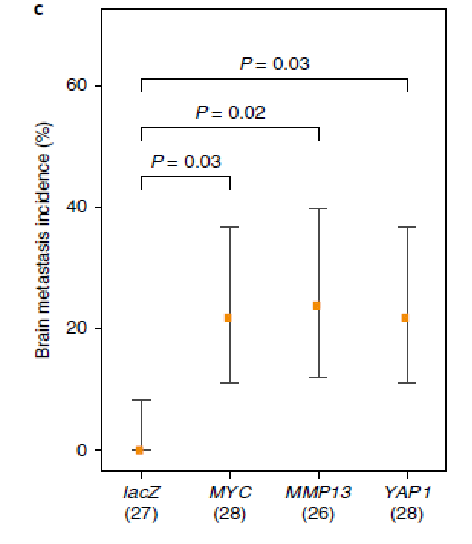
我们进一步利用LUAD转移的PDX模型验证MYC,MMP13和YAP1扩增。27例注射lacZ表达的小鼠并没有发展成任何可测量脑转移病灶,而28例,26例,28例注射MYC,MMP13和YAP1过表达的小鼠中分别有5例,5例以及5例发展成为脑转移(图4)。同时,MYC,MMP13和YAP1扩增增加了肿瘤细胞发展为脑部微环境的可能性。这些研究证实了这3个基因中任意一个基因的过表达可以促进脑转移的形成。
结论
我们的结果证实测序足够脑转移样本,将体细胞变异样本与组织匹配的原发肿瘤进行对比,可以有效的揭示既往未知的促进肿瘤进展和脑转移的体细胞变异。我们鉴定的候选的基因可能可以作为潜在的脑转移治疗靶点,如YAP1扩增的脑转移患者可以用Hippo通路抑制剂治疗。CDK通路抑制剂Palbociclib、Abemaciclib在脑转移患者中已经开展了临床试验。这些结果表示体细胞变异促进了脑转移发生,同时证明了足够脑转移样本量的基因测序可以揭露先前未知的转移性驱动基因。
小编有话说
肺腺癌脑转移(BM-LUAD) 引起很高的患者死亡率。为了确定哪些基因组转变促进脑转移,我们对73例BM-LUAD进行了全外显子基因组测序。确定了三组高扩增区域:MYC(12%vs6%), YAP1(7%vs0.8%)和 MMP13(10%vs0.6%)及基因缺失区域CDKN2A/B(27%vs13%) 。从105例患者的队列研究中,我们发现以下三种基因MYC and YAP1/MMP13的扩增频次明显升高。功能性评价在PDX小鼠模型中得到验证。这些结果表明,体细胞改变有助于脑转移形成以及,大样本量转移瘤的基因组测序可以揭示新的肿瘤转移驱动基因。