张会来教授点评B细胞淋巴瘤重要研究进展

R-DA-EPOCH±ASCT作为伴有MYC和BCL-2和/或BCL-6基因重排或拷贝数增加的侵袭性B细胞淋巴瘤的一线治疗疗效分析
Oral and Poster Abstracts 2131
时间:2020年12月6日星期日,下午2:00
背景
我们此前报道过6个疗程R-DA-EPOCH对伴有MYC和BCL-2和/或BCL-6重排(DHL/THL)或基因拷贝数增加(ICN)的侵袭性B细胞淋巴瘤患者的短期疗效(Tucci et al,Blood S1:4154,2017)。此次我们报告一个例数更大、非随机的长期随访结果,目的是进一步证实我们的初步结果,并确定R-DA-EPOCH诱导缓解后自体干细胞移植(ASCT)的巩固价值。
方法
研究对象包括在意大利四个中心连续就诊的患者。对于年龄小于71岁、在6个R-DA-EPOCH疗程后至少达到PR的II-IV期患者进行ASCT巩固治疗。
结果
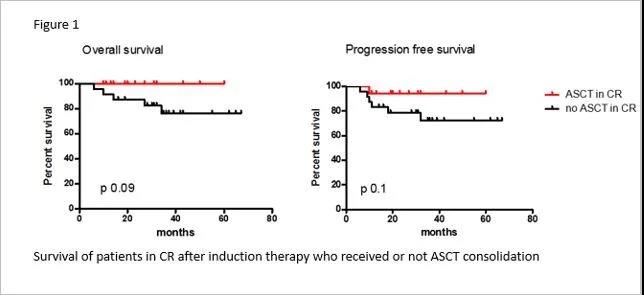
63例患者中DLBCL 为51例, HGBCL有7例,其中16例为惰性淋巴瘤转化的大B细胞淋巴瘤。中位年龄为63岁(23-79岁),43例(68%)为男性。54例(86%)为III/IV期,18例(28%)有B症状,41例(65%)为高中危/高危患者,79%的患者有结外病变,主要发累及部位为骨和胃肠道。FISH:DHL 34例,THL 10例,c-MYC-ICN 19例。根据IHC,73%为双表达,Ki-67的中位数为91%(35%~100%)。其中24例患者(17例CR,6例PR和1例PD)接受了移植巩固治疗(1例PR患者接受异基因SCT)。中位随访时间为32个月。ORR为81%,其中CRR为68%,3年PFS和OS分别为67%和69%。2例患者在化疗期间死于严重感染。10例难治性患者均死于病情进展。单因素分析中,IPI>3和THL与预后不良显著相关,c-MYC-ICN和接受ASCT的患者则预后较好。多因素分析提示只有ASCT与生存显著相关(HR 0.146, IC 95% 0.032~0.667, p 0.013)。在R-DA-EPOCH后获得CR的17例患者均接受移植且全部存活(移植后中位随访27个月)。诱导治疗后CR的患者接受和未接受ASCT巩固治疗的3年OS和PFS分别为100% vs 76%和94% vs 72%(图1)。
结论
以上结果证实了R-DA-EPOCH治疗MYC和BCL-2和/或BCL-6重排或基因ICN的患者的良好疗效。ASCT的巩固作用令人鼓舞,但仍有待于前瞻性随机研究的进一步证实。难治性患者的不良预后仍未得到改善,期待CAR-T治疗能够进一步提高该类患者的生存。
大剂量化疗(HDC)联合自体干细胞移植(ASCT)后巩固放疗(RT)治疗复发或难治性原发纵膈大B细胞淋巴瘤(R/R PMBCL):MD安德森癌症中心(MDACC)20年经验
Oral and Poster Abstracts 3331
时间:2020年12月7日,星期一,上午9:00
背景
大多数PMBCL患者通过一线化学免疫治疗±RT可达到治愈。关于HDC/ASCT对R/R PMBCL的作用以及HDC/ASCT治疗后应用RT的报道很少。
方法
我们回顾性分析了2000年1月1日至2019年12月31日在MDACC接受HDC/ASCT治疗的所有R/R PMBCL患者。
结果
接受HDC/ASCT治疗共58例患者:R-BEAM组36例;利妥昔单抗/吉西他滨/白消安/美法仑±伏立诺他(R-GemBuMel)组22例(表1)。R-GemBuMel组:既往治疗>2线的患者比例为55%,高于R-BEAM组的28%(p=0.025);CR的患者较少(41% vs 69%,p=0.01);ASCT时PD/SD的患者比例较高(32% vs 3%,p=0.01)。29例患者(20例R-BEAM,9例R-GemBuMel,P=0.27)移植前RT的中位剂量为44(36~48)Gy。19例(89%的患者在SCT时未达到CR)未接受全剂量放疗的患者接受了SCT后放疗(BEAM组6例,R-GemBuMel组13例,P<0.001),放疗中位剂量为40(36~48)Gy。R-BEAM组有2例治疗相关死亡,R-GemBuMel组未出现相关死亡。中位随访69.1个月,所有患者的EFS为57.6%:R-GemBuMel组为 67.6%;R-BEAM 组为52.7%(图1a)。总OS为69.3%,R-GemBuMel组和R-BEAM组分别为 81.1%和63.9%(图1b)。在Cox回归分析中,R-GemBuMel(vs. R-BEAM)(HR = 0.29,p = 0.05)和1个器官受累(vs>1)(HR 0.28,p = 0.009)与EFS改善相关;R-GemBuMel(HR = 0.16,p = 0.03)和1个器官受累(HR = 0.17,p = 0.004)与OS显着改善相关。
结论
对于移植时未达到CR的R/R PMBCL患者给予HDC/ASCT以及SCT后放疗可使患者生存获益,并且与R-BEAM相比,R-GemBuMel±伏立诺他似乎可以进一步改善患者的EFS和OS。

自体干细胞移植与异基因干细胞移植治疗复发双表达淋巴瘤患者的疗效分析:MD安德森癌症中心(MDACC)
Oral and Poster Abstracts 3331
时间:2020年12月6日,星期日,下午2:00
背景
MYC和BCL2蛋白的双表达(Double Expressor Lymphoma-DEL)是弥漫大B细胞淋巴瘤(DLBCL)患者的重要不良预后因素。研究表明,即使接受自体干细胞移植(autoSCT),DEL患者的生存仍较差。因此异基因干细胞移植(alloSCT)因其潜在的移植物抗淋巴瘤作用而备受推崇。然而,关于autoSCT和alloSCT治疗的复发DEL患者的预后数据仍有限。
方法
对我中心首次接受autoSCT和alloSCT的复发DEL/DLBCL患者的资料进行分析。免疫组织化学法(IHC)确定MYC和BCL2双表达的界值分别为40%和70%。84%的autoSCT患者接受了干细胞化学动员和利妥昔单抗(R)的体内净化;同时在BEAM的基础上,+1和+8天加用R(J Clin Oncol 2005; 23:2240-7; Clin Cancer Res 2018; 24:2304-11)。alloSCT的预处理包括清髓性(n=16,50%),减低强度(n=6,19%)和非清髓性(n=10,31%)。
结果
2000年至2018年期间共161例autoSCT和32例alloSCT患者纳入此研究。中位年龄分别为59岁(18~80岁)和55岁(21-66岁)(P = 0.009)。男性比例分别为62.7%和50.0%(P =0.234)。51例(32.5%)autoSCT患者和9例(28.1%)alloSCT患者的血清LDH升高(P =0.683)。41/148(27.7%)autoSCT患者和11/25(44.0%)alloSCT患者在研究开始时PET阳性(P =0.106)。从诊断到移植的时间分别为20.0个月和25.2个月(P =0.068),两组之间的移植年数分布相似(P =0.317)。两个治疗组的既往化疗程度、疾病状态、分期和移植时HCT-CI评分均有显著性差异。接受alloSCT的患者在移植前接受了强度更高的治疗[中位治疗线数3 vs 2,P =0.0001],同时移植时患者分期较晚(P =0.035)以及患者多为难治性疾病(P =0.010)。此外,alloSCT组HCT-CI>4患者的比例更高(28.1%vs 10.2%,P =0.018)。
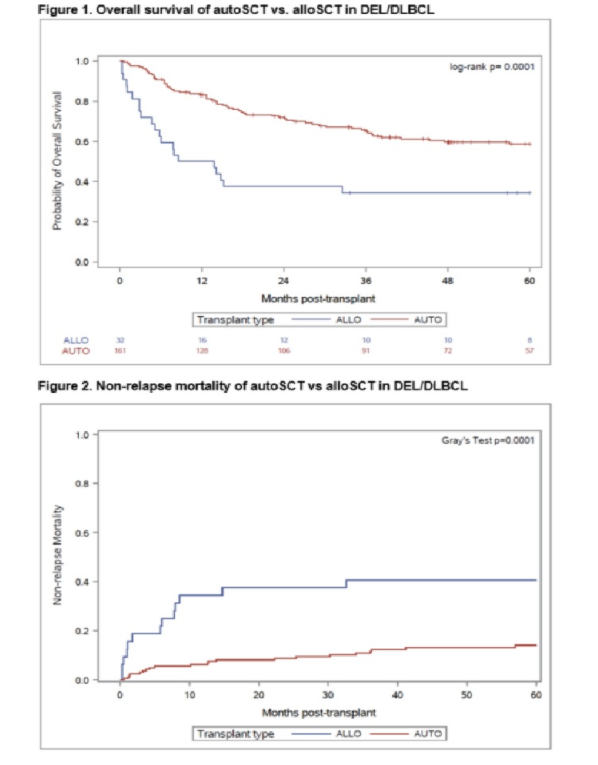
autoSCT组的中位随访期为65个月(5~217个月),alloSCT组为93个月(34~124个月),5年的OS分别为59%和34%(P =0.0001)(图1),5年的PFS分别为49%和31%(P =0.002)。AutoSCT的复发率与alloSCT相似,但非复发死亡率(NRM)的发生率较低。5年复发率分别为37%和28%(P =0.611),5年NRM分别为14%和41%(P =0.0001)(图2)。alloSCT组的II-IV级和III-IV级100天急性GVHD分别为37.5%和9.4%。1年慢性GVHD为25.0%。
结论
这项研究首次表明与alloSCT相比,autoSCT对于复发DEL/DLBCL患者具有更高的生存率,并且结果得到长期随访的支持。
张会来教授点评
随着对DLBCL的分子发病机制研究的深入,DLBCL的治疗取得了重大进展。例如双抗、CART、抗体偶联药物、B细胞受体信号传导抑制剂、免疫调节剂、免疫检查点抑制剂和蛋白酶体抑制剂等等。但是自体造血细胞移植(auto-HCT)仍是复发的侵袭性NHL的标准治疗方案。对于具有高风险特征的患者,包括多线治疗后仍复发的、难治性疾病和auto-HCT后复发的患者,allo-HCT仍然是治疗的选择之一。
此次ASH会议上,意大利学者报道了多中心应用R-DA-EPOCH±ASCT治疗伴有MYC和BCL-2和/或BCL-6基因重排或拷贝数增加的侵袭性B细胞淋巴瘤患者的疗效,同时报道了对年龄小于71岁、在6个R-DA-EPOCH疗程后至少达到PR的II-IV期患者进行ASCT巩固治疗的结果。中位随访时间为32个月。ORR为81%,其中CRR为68%,3年PFS和OS分别为67%和69%。在R-DA-EPOCH后获得CR的17例患者均接受移植且全部存活(移植后中位随访27个月)。2例患者在化疗期间死于严重感染。10例难治性患者均死于病情进展。以上结果证实了R-DA-EPOCH治疗MYC和BCL-2和/或BCL-6重排或基因ICN患者的良好疗效。虽然从生存分析中CR后移植与非移植患者的OS和PFS无显著性差异,但是ASCT的巩固作用仍不可忽视。从生存曲线可以看到移植后3年的PFS仍高达94%,但有待于前瞻性随机对照研究的进一步证实。但是难治性患者的不良预后仍未通过自体移植得到改善,我们期待CAR-T治疗能够进一步改善该类患者的生存。
PMBCL具有独特的临床病理和分子学特征,其中75%-80%的患者可以通过常规化疗联合放疗获得长期生存,但仍有部分患者无法通过常规治疗方法获得完全缓解。目前对于R/R PMBCL患者,CD30单抗、PD-1抑制剂和CAR-T这些新的靶向治疗及细胞免疫治疗成为新的治疗手段。MDACC通过分析20年中接受HDC/ASCT治疗的R/R PMBCL患者的数据再次明确对于移植时未达到CR的R/R PMBCL患者给予HDC/ASCT以及SCT后放疗可使患者生存获益,并且与R-BEAM相比,R-GemBuMel±伏立诺他似乎可以进一步改善患者的EFS和OS。但是因为此病多见于年轻女性,因而仍需要进一步探讨如何对R/R PMBCL患者进行个体化治疗,以期达到延长生存和改善生活质量的目的。
目前对于R/R DEL患者的治疗,R-DHAP、R-ICE挽救治疗加自体干细胞移植的结局仍然极差;对于之前接受过强化治疗的患者,推荐参加新药的临床研究;异基因造血干细胞移植似乎可克服双表达患者的不良预后因素,但因样本量过小,仍需大量前瞻性研究加以证实。本次ASH上MDACC报道了该中心近200例接受干细胞移植的R/R DEL患者的生存分析。我们可以看到共161例autoSCT和32例alloSCT患者纳入此研究。5年的OS分别为59%和34%(P =0.0001);5年的PFS分别为49%和31%(P =0.002)。AutoSCT的复发率与alloSCT相似,但NRM的发生率较低。虽然接受alloSCT治疗的患者的分期较晚、难治性患者比例较多等因素导致alloSCT的预后差,但是综合疗效和毒性,与alloSCT相比,autoSCT对于复发DEL/DLBCL患者具有更高的生存率,并且结果得到长期随访的支持,因而对于R/R DEL患者初次移植建议应用autoSCT。