常建华教授:2020年度晚期肺癌免疫治疗新进展
编者按:11月27~29日,2020国家癌症中心肿瘤精准医疗论坛暨深圳市肿瘤内科治疗质控年会召开北京、深圳线上/线下学术会议,中国医学科学院肿瘤医院深圳医院常建华教授对2020年晚期肺癌免疫治疗新进展进行盘点,本文将简要介绍这项报告的主要内容。

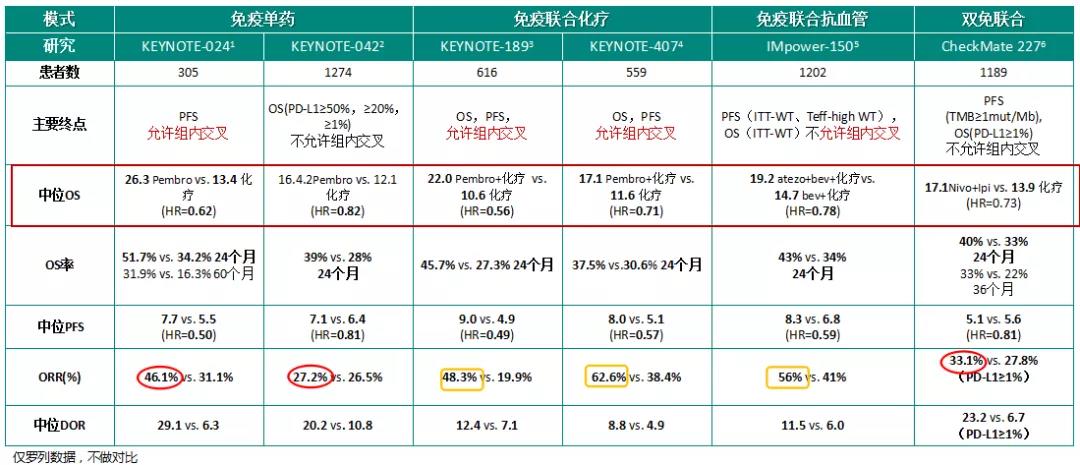
免疫治疗已全面改变非小细胞肺癌(NSCLC)治疗格局,免疫治疗模式也从单药走向多种形式联合,免疫单药仅覆盖PD-L1阳性人群,ORR有待提高,而免疫联合治疗将驱动基因阴性人群全覆盖,ORR较免疫单药明显提高。以下介绍2020年免疫单药、免疫联合化疗、免疫联合抗血管、双免联合和其他联合治疗模式的进展。
一、免疫单药治疗的研究进展
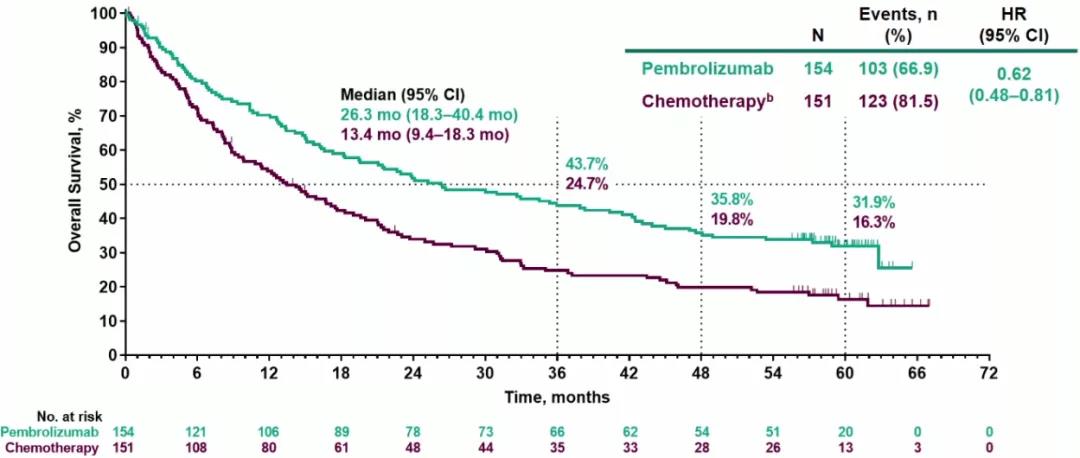
KEYNOTE-024是首个报道晚期NSCLC一线免疫治疗5年OS的III期研究。2020年ESMO发布了5年研究数据,中位生存期分别为26.3个月(化疗组13.4个月),5年生存率31.9%(化疗组16.3%),驱动基因阴性晚期NSCLC患者离“长生存”目标更近(2020 ESMO LBA#51)。
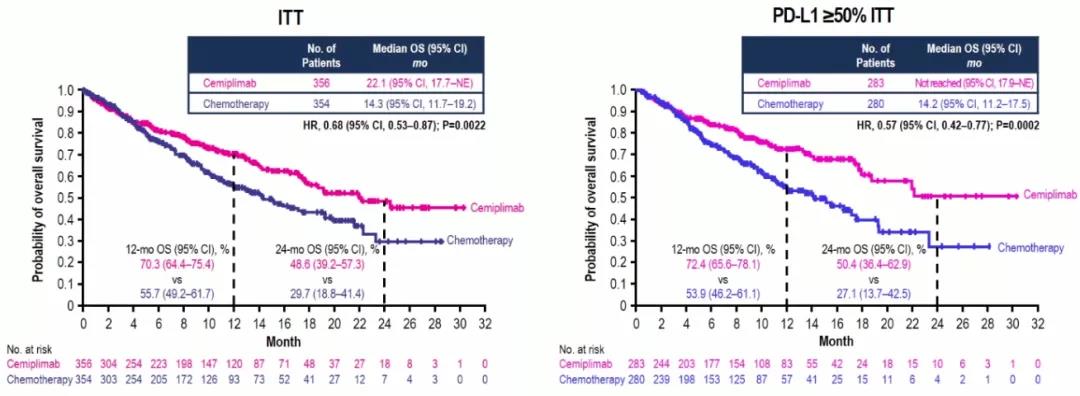
EMPOWER-Lung 1研究评估了PD-1抗体Cemiplimab单药治疗PD-L1高表达患者的疗效和安全性。在PD-L1≥50%的ITT患者群中,Cemiplimab中位OS尚未达到,单药24个月OS率达50.4%(单纯化疗组仅27.1%),中位PFS 8.2个月(单纯化疗组为5.7个月)(2020 ESMO LBA#52)。
二、免疫联合化疗
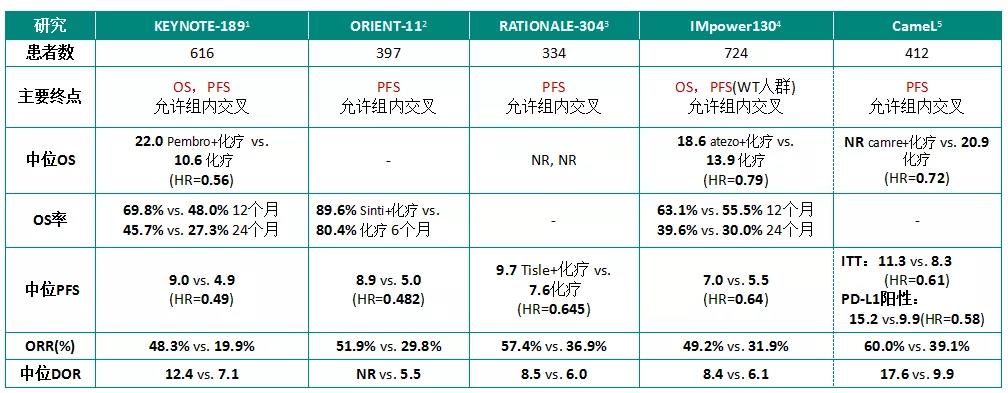
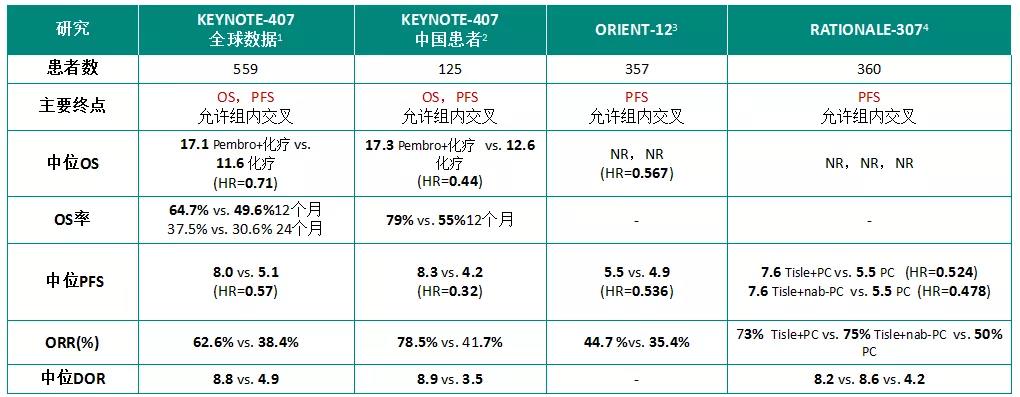
基于ORIENT-11和ORIENT-12研究,信迪利单抗证实了联合不同化疗方案在局晚/转移性非鳞NSCLC和鳞状NSCLC都能显著提升患者的远期疗效。在鳞状NSCLC患者中,信迪利单抗联合GP方案化疗一线治疗的中位PFS为5.5个月,安慰剂联合化疗为4.9个月(HR=0.536),12个月PFS率分别为22.3%和3.1%;ORR分别为44.7%和35.4%(2020 ESMO LBA#56)。
RATIONALE-304和RATIONALE-307评估了替雷利珠单抗+化疗治疗非鳞NSCLC和鳞状NSCLC中国患者。在非鳞NSCLC患者中,替雷利珠单抗+化疗的中位PFS为9.7个月,单纯化疗的中位PFS为7.6个月(HR=0.645);ORR分别为57.4%和36.9%;OS尚未达到(2020 ESMO P#1263)。III期RATIONALE 307临床试验也达到PFS终点(2020 ASCO abs 9554)。
KEYNOTE-189研究是帕博利珠单抗联合培美曲塞及铂类药物治疗晚期一线非鳞NSCLC患者的III期随机化临床试验。最终分析显示,帕博利珠单抗加化疗组的OS和PFS超越对照组2倍,2年OS率达45.7%。实验组中56位患者完成了35周期的治疗,ORR达到 85.7%,中位OS未达到。不同PD-L1表达人群均能从帕博利珠单抗联合化疗中显著获益(2020 ASCO abs 9582)。
以下列出免疫联合化疗在非鳞NSCLC和鳞状NSCLC中开展的多项研究数据汇总(仅罗列数据,不做对比):
三、免疫联合抗血管
IMpower-150评估了阿替利珠单抗+贝伐珠单抗+化疗一线治疗非鳞NSCLC患者。患者分为三组:A组:阿替利珠单抗+卡铂+紫杉醇;B组:阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇;C组:贝伐珠单抗+卡铂+紫杉醇。2020 AACR发布的最终分析显示,四联方案(B组)在各亚组可以带来获益(2020 AACR Abs CT216)。
TASUKI-52评估了纳武利尤单抗+贝伐珠单抗+卡铂+紫杉醇四药联用一线治疗NSCLC。非鳞NSCLC患者的mPFS为12.1个月,安慰剂+贝伐珠单抗+化疗组(对照组)的mPFS为8.1个月(HR=0.56);ORR分别为61.5%和50.5%;中位DOR分别为11.0个月和7.0个月;中位OS为25.4个月和24.7个月(2020 ESMO LBA#54)。
LEAP-006第一阶段安全性研究的结果表明,仑伐替尼+帕博利珠单抗+化疗一线治疗转移性非鳞NSCLC患者,安全性和耐受性可控,具有初步的抗肿瘤作用(2020 ESMO P#1313)。
WJOG @Be study是一项单臂、II期临床研究,纳入39例PD-L1高表达的晚期非鳞NSCLC患者,患者接受阿替利珠单抗联合贝伐珠单抗治疗,ORR为64.1%,中位PFS为15.9个月,中位DOR为10.4个月(2020 ESMO LBA#55)。
下表为免疫联合抗血管治疗研究数据汇总:
四、双免疫联合
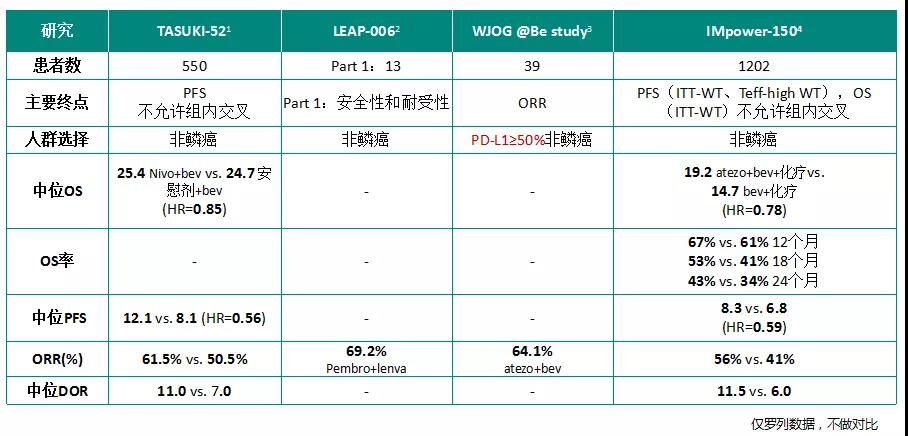
2020 ASCO公布的CheckMate-227三年随访数据证实,纳武利尤单抗+伊匹木单抗双免疫治疗无驱动基因突变的晚期NSCLC患者,相比化疗显著改善OS数据,PD-L1≥1%患者的3年OS率分别为33% vs 22%;PFS、ORR及DOR等研究终点也获得阳性结果。NIVO+IPI组有77%出现任何级别治疗相关AEs,33%出现3~4级治疗相关AEs(2020 ASCO abs 9500)。
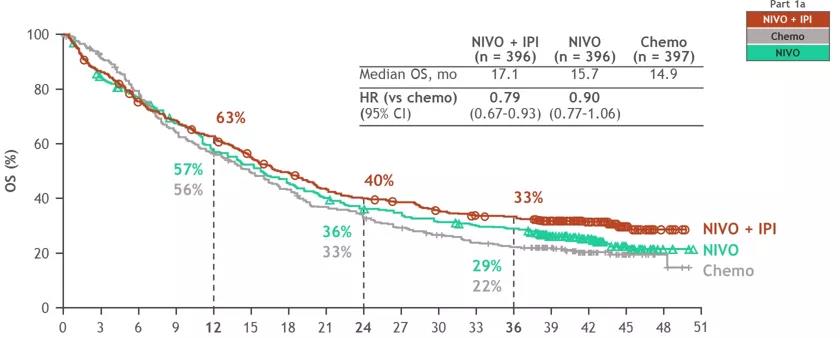
CheckMate-9LA探索了双免疫+2周期化疗的治疗模式,2020 ASCO首次公布了研究结果,纳武利尤单抗+伊匹木单抗+2周期化疗可获得OS获益,加用2短程化疗有助于尽早控制病情。NIVO+IPI+化疗组92%出现任何级别治疗相关AEs,47%出现3~4级治疗相关AEs(2020 ASCO abs 9501)。
2020 ESMO公布了CheckMate-227/9LA亚洲人群数据,证明了双免方案、双免+2周期化疗与传统化疗相比在全球不同人种中获益的一致性。
II期临床研究EMPOWER-lung 4评估了PD-1抗体Cemiplimab单药标准剂量、单药高剂量以及Cemiplimab联合伊匹木单抗的疗效,Cemiplimab+伊匹木单抗二线治疗的ORR高于Cemiplimab单抗标准剂量或高剂量治疗(45.5%vs 0% vs11.1%)(2020 ESMO Poster #1269)。
五、免疫新联合方案
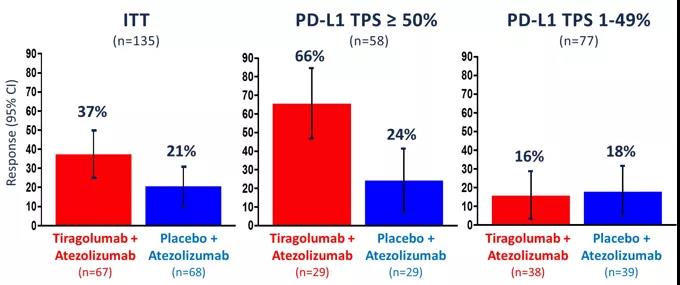
TIGIT和PD-L1在免疫抑制中均起着重要作用。CITYSCAPE研究探索了同时阻断TIGIT/PD-L1是否增强抗肿瘤活性。II期CITYSCAPE研究纳入135例EGFR/ALK野生型、PD-L1≥1%的IV期NSCLC患者,评估TIGIT靶向抗体Tiragolumab联合阿替利珠单抗对比阿替利珠单抗单药一线治疗NSCLC的有效性和安全性,结果发现ORR(37% vs21%)和PFS(5.55 vs 3.88个月)均有临床获益(2020 ASCO abs 9503)。
Canakinumab是一种靶向IL-1β的人源化单克隆抗体,可靶向肿瘤炎症反应,并减少免疫抑制,发挥抗肿瘤效应。在III期CANTOS研究中,Canakinumab可显著降低心肌梗死的发生率,意外发现Canakinumab可显著降低CRP≥2mg/L患者的肺癌发生率和死亡率(2020 AACR CT214)。基于CANTOS的意外发现,四项全球NSCLC相关的II/III期临床研究同时开启。
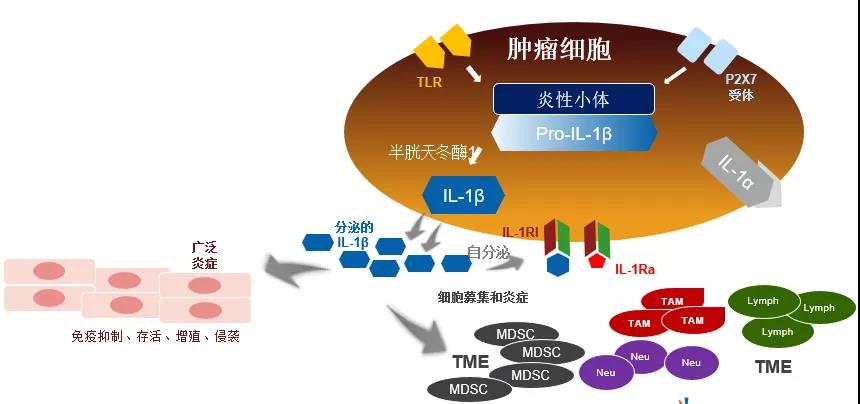
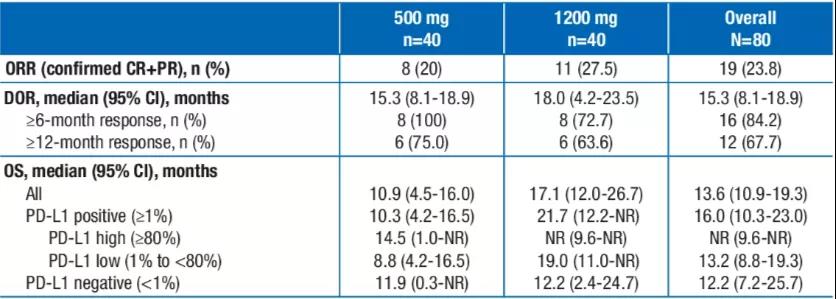
针对PD-L1和TGF-β的双功能融合蛋白M7824(Bintrafusp alfa)可通过同时拮抗PD-L1和“诱捕”TGFβ,提升抗肿瘤治疗效果。M7824用于晚期NSCLC二线单药治疗(用药剂量1200 mg q2w或500mg q2w)的研究中,总体ORR为23.8%,中位OS 13.6个月,18个月和24个月OS率分别为40.6%和34.6%(2020 ASCO abs 9558)。国内也有多个免疫双特异性抗体已进入临床/IND阶段。
小结
免疫治疗开启了晚期NSCLC治疗的新时代,多种策略取得成功,极大地改善了晚期NSCLC患者的生存。免疫单药、免疫联合化疗、免疫联合抗血管和双免联合的研究的循证医学证据不断积累,以下通过表格的形式总结晚期NSCLC四种免疫治疗模式的数据:
未来需要进一步探索肿瘤发生发展及耐药机制,筛选有效的生物标记物,探索新的联合治疗策略,寻找更为有效的治疗靶点。期待更多更优的治疗模式开启NSCLC治疗新篇章。
常建华教授在《肿瘤瞭望》的采访中提到,既往PD-1单药一线治疗晚期NSCLC的研究中,主要获益人群是PD-L1≥50%的患者。而免疫联合化疗、双免疫等联合模式的研究发现,免疫联合治疗可覆盖PD-L1阴性人群在内的驱动基因阴性晚期NSCLC患者,显示出较化疗更好的疗效。目前免疫治疗的精准生物标志物仍未明确,为了精准地为患者选择单药或联合模式,未来需要对更多的biomarker进行探索,包括疗效的预测因子,不良反应的预测因子等等,建立复合的标志物预测模式。