免疫微环境下肝癌的免疫治疗

樊嘉院士
肝癌仍是最大挑战之一
2018年统计数据显示,全球范围内肝癌发病率居第六位,死亡率居第四位。中国新发肝癌占全球的55%,总体5年生存率仅7~10%,仅有30%患者有手术切除机会,术后5年转移/复发率为60%~70%。治疗结果及预后差异巨大。
肝脏是免疫器官
肝脏由肝脏细胞和非肝脏细胞组成,其中肝脏细胞占60%~80%。免疫细胞占细胞总数的10%~20%,在维持机体耐受中发挥了重要作用。
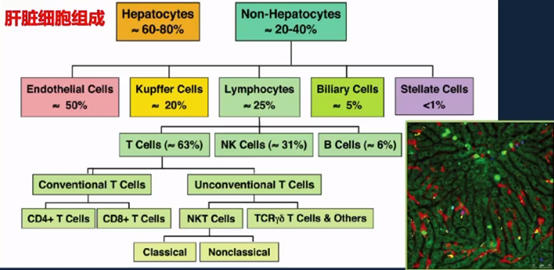
肝脏微环境易发生癌转移,肝癌发展与微环境相关
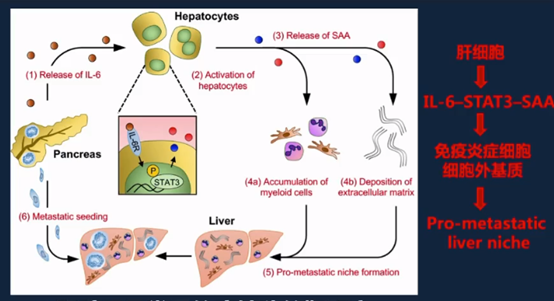
肝脏是最常见的癌转移靶器官,肝细胞和免疫细胞共同营造了“促转移微环境”。肝癌发生发展也与微环境密切相关:多种因素导致微环境紊乱,从而促进肝癌发生,微环境免疫炎症反应的失衡是最关键机制之一。
肝脏微环境决定肝癌病理类型
在凋亡微环境下,通过免疫炎症表观调控,最终形成肝细胞癌;坏死微环境下,通过免疫炎症表观调控,最终形成胆管细胞癌。
调控肝癌微环境是重要治疗手段
多激酶抑制剂是同时针对肝癌细胞和肝癌微环境研发的靶向药物,包括调控微环境血管生成、免疫调控、炎症反应。而仅针对肝癌细胞的单激酶抑制剂在随机临床研究多以失败告终,例如C-MET抑制剂,潜在的原因可能在于:激活了癌细胞内在的免疫抑制机制(PD-L1表达上调)。
阐明肝癌免疫微环境是重中之重
PD-1/PD-L1抗体在肝癌中的有效率居于各类药物之首,但仍有待提高。因此,深入阐明肝癌免疫微环境调控机制,具有重大临床意义。
肝癌免疫微环境:系列探索
樊嘉院士从免疫微环境细胞成分、免疫微环境调控因子、免疫微环境的异质性、免疫微环境的可塑性、免疫治疗策略及展望五个方面阐述了樊嘉院士团队关于免疫微环境的系列探索。
免疫微环境细胞成分
微环境Treg/CTL平衡决定肝癌预后
2007年,樊嘉教授团队发表在《JCO》杂志的研究综合评价了淋巴细胞的密度、部位、亚群和功能状态。结果显示:活化的杀伤性T细胞(CTL)/调节性T细胞(Treg)比例的平衡决定了肝癌预后。
微环境中Treg与巨噬细胞(MΦ)协同促进耐药
2016年樊嘉教授团队发表在《Gastroenterology》的研究显示,缺氧等应激因素可导致Treg与MΦ聚集,而促进索拉非尼耐药;当去除或抑制微环境Treg与MΦ的聚集,可部分逆转索拉非尼耐药。
微环境Treg抑制&γ;&δ;T的杀伤能力
&γ;&δ;T细胞是执行固有免疫功能的T细胞,利用细胞毒效应杀伤肿瘤细胞是其功能之一。2013年发表的一项研究显示:在肝癌微环境中,&γ;&δ;T细胞中NKG2D及IFN&γ;表达下调。Treg通过TGF-&β;、IL-10抑制&γ;&δ;T细胞的杀伤能力,从而导致免疫激活与免疫抑制失衡,最终免疫耐受。
微环境B细胞和CD8细胞协同抗癌
研究显示,微环境B细胞主要表现为IgD-IgG+CD27-CD38-记忆表型,B细胞通过IFN&γ;、granzymeB、TEAIL与CD8协同抗癌。
微环境免疫细胞的总体特征
最新的一项研究中,单细胞技术揭示肝癌微环境免疫细胞亚群的总体特征,该研究结果已被《cell discovery》接收。
免疫微环境调控因子
微环境免疫检查点:PD-L1表达
微环境PD-L1高表达与预后较差显著相关,PD-L1诱导以Treg为主的促癌微环境形成。2009年,樊嘉院士团队开展的研究探索了PD-1抗体预防肝癌术后复发的个体化方案。目前,多中心随机对照研究正在进行中。
微环境免疫检查点:PD-Ls扩增
癌细胞中,PD-L1/L2呈现一定比例的扩增,癌细胞免疫抑制与PD-L1/L2高表达显著相关。
微环境免疫检查点:B7-H3
B7-H3在肝癌细胞及微环境免疫细胞特异性表达上调,B7-H3高表达导致免疫细胞杀伤及增殖能力下降。
微环境免疫检查点:补偿机制
免疫细胞可同时表达多种免疫检查点分子,是多种联合治疗方案开发的基础。既往研究显示,PD1+CD8+T细胞可进一步分为TIM3+和TIM3-两个亚群。
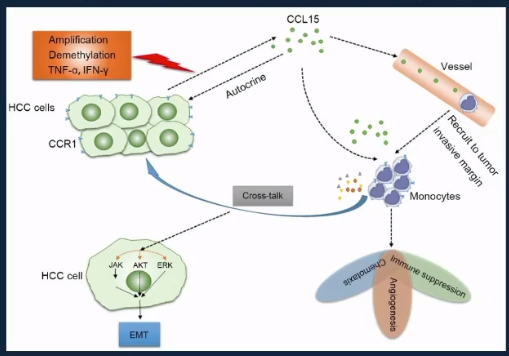
趋化因子调控微环境单核细胞
微环境和癌细胞内在因素共同导致CCL15大量分泌,CCL15招募CD14+单核细胞最终导致免疫抑制和血管生成,从而促进肿瘤快速发展。
趋化因子调控微环境巨噬细胞
肝癌细胞通过M-CSF募集CSFR1+巨噬细胞(TAM),巨噬细胞可分化为M2亚型最终促进肝癌进展。
趋化因子调控微环境中性粒细胞
肝癌细胞通过CXCL5、IL-8等招募中性粒细胞(TAN),微环境中性粒细胞可分化为N2亚型可促进肝癌进展。
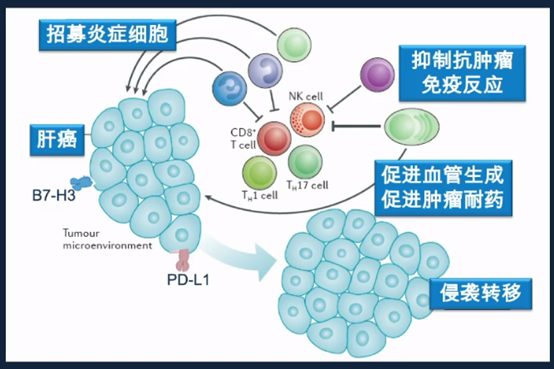
肝癌细胞与免疫细胞共同构建了促癌微环境。通过招募炎症细胞、抑制抗肿瘤免疫反应、促进血管生成/促进肿瘤耐药最终导致了肝癌的发生,并导致侵袭和转移。
免疫微环境的异质性
免疫微环境的空间异质性
免疫细胞不同空间位置上(癌旁、交界、癌内)存在异质性,即形成了所谓的热肿瘤、冷肿瘤等免疫分型。
免疫微环境的时间异质性
肝内转移灶发生了HLA LOH等抗癌递呈系统异常。今年樊嘉院士团队发表在《J Hepatol》的研究显示,在T1、T2、T3三个亚克隆肿瘤细胞中,T3亚克隆HLA-B24:02缺失而导致其无法被特异性TCR所识别,转移灶借此逃避了抗体特异性T细胞的攻击和杀伤。
多发肝癌的免疫微环境异质性
同样,今年嘉院士团队发表在《J Hepatol》杂志的研究中探索了多发肝癌的免疫微环境异质性。研究显示,多中心起源的肿瘤细胞中,微环境CD8+ T细胞多,微环境间异质性强;单中心起源的肿瘤细胞中,微环境巨噬细胞多,微环境间异质性弱。
微环境新抗原及TCR异质性
今年发表在《J Hepatol》杂志的研究显示:新抗原存在显著的时空异质性(源于突变的异质性)。进一步的探索发现,微环境T细胞TCR的克隆状态和多样性更加复杂。
微环境免疫编辑的效力有限
另一项发表在《J Hepatol》杂志的研究显示,免疫编辑会清除突变的癌细胞,但在肝癌中免疫编辑效力却严重不足,进一步研究显示:免疫编辑与微环境CD8+ T细胞呈正相关,存在着空间异质性。
免疫微环境:原发 vs 复发
另一项研究利用ScRNAseq探索了肝癌原发和早期复发灶的微生态系统,已被《Cell》杂志接收,该研究利用单细胞RNAseq分析了16498个细胞,发现12例原发灶(PT),6例早期复发灶(RT)。并利用单细胞RNAseq和Bulk RNAseq和免疫组化进行了验证。
研究者发现了肝癌早期复发的免疫微环境特征:与原发肝癌相比,早期复发肝癌的免疫微环境截然不同,DC和CD8+ T细胞增加,但杀伤力降低,而Treg细胞减少。
早期复发灶CD8+ T细胞功能特点:PT和RT CD8+ T细胞所处的蜂窝状态完全不同;RT CD8+ T细胞的状态特征:低细胞毒性、低耗竭状态,虽然CD8+ T细胞多,但并不会杀伤肿瘤细胞的作用。
同时研究发现了肝癌早期复发新靶点(CD161+CD8+T细胞):在RT CD8+ T细胞特征性表达谱中,耗竭信号通路和OX40信号通路相关蛋白表达下调,提示CD8+ T细胞处于非激活状态;CD8+ T细胞特异性表达KLRB1基因,即CD161分子。T细胞毒性:CD161+CD8+ T细胞毒性低于CD161-CD8+ T细胞。对于CD161+CD8+ T细胞增加肿瘤细胞,其二次复发风险也增高。
复发肿瘤细胞移植抗原提呈:与PT相比,RT肿瘤细胞中PD-L1和CTLA4的表达上调。RT肿瘤细胞表达PD-L1能竞争性结合DC细胞CD80分子,抑制DC细胞与CD8+ T细胞间CD80-CD28共刺激信号,而导致CD8+ T细胞杀伤毒性降低。
免疫微环境的可塑性
免疫微环境抗癌与促癌的转化
2019年樊嘉院士团队在《Clin Cancer Res》杂志发表的研究显示,粘膜相关T细胞(MAIT)类似于TAM、TAN,会导致功能重塑。微环境因素驯化下,MAIT由抗癌表型项促癌表型转化。
微环境免疫细胞分化状态
微环境B细胞从初始状态到浆细胞有7个分化状态。分化过程中的异质性是B细胞抗癌/促癌双重作用的重要基础。
微环境免疫细胞的基因效应表型
一项正在进行的研究显示,各个T细胞亚群在微环境的记忆效应表型显著不同;不同微环境中,T细胞记忆效应表型会发生动态变化。
部分治疗策略与展望
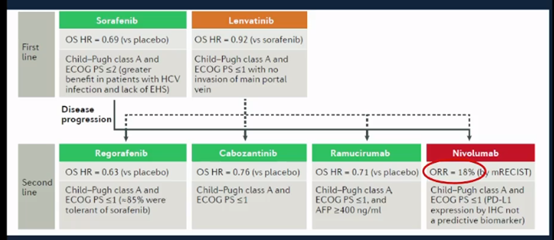
帕博利珠单抗已获批用于肝癌的二线治疗,是基于一项开放标签II期单臂KEYNOTE-224研究,该研究纳入104例经索拉非尼治疗进展的患者,结果显示,客观缓解率(ORR)达到17%,疾病控制率(DCR)达62%,中位无进展生存期(PFS)和总生存期(OS)分别达到4.9个月和12.9个月。
I/II期CheckMate 040研究中,146例既往接受索拉非尼治疗的患者按1:1:1 比例随机分配接受不同剂量的纳武利尤单抗+伊匹木单抗治疗,结果显示,在三个治疗组均观察到了获益。其中接受纳武利尤单抗(1mg/kg,Q3W)+伊匹木单抗(3mg/kg,Q3W)的中位OS为22.8个月,ORR达32%。纳武利尤单抗+伊匹木单抗也已获批用于肝癌的二线治疗。
今年晚期肝癌一线治疗迎来较大突破,基于IMbrave150研究结果,阿替利珠单抗+贝伐珠单抗已获批用于肝癌的一线治疗。IMbrave150是一项在501例既往未接受过系统性治疗的不可切除的肝癌患者中开展的全球性Ⅲ期研究。患者按2∶1比例随机接受阿替利珠单抗+贝伐珠单抗或索拉非尼治疗。结果显示,阿替利珠单抗+贝伐珠单抗组和索拉非尼组的中位OS分别为未达到和13.2个月(HR= 0.58,P=0.0006),两组的ORR分别为27.3%和11.9%。
此外,今年ASCO上公布的一项II期研究显示,纳武利尤单抗用于肝癌新辅助治疗的病理完全缓解率(pCR)达到37.5%。
策略
抗原疫苗、DC疫苗等手段,提高“新”抗原负荷。
通过表观调控等方法,促“冷肿瘤”为“热肿瘤”。
通过联合治疗包括免疫+放化疗、免疫+靶向,提高免疫治疗疗效。
展望
利用并开发新技术,明确微环境复杂的细胞成分、鉴定新亚群和治疗靶点;微环境细胞呈现连续、动态、可逆的变化,把握关键节点,促进抗癌方向转变;重视微环境细胞的空间分布和时间发展的异质性,及其对治疗敏感性的影响!