乳腺癌保乳术后大分割放疗亚临床心脏损伤的前瞻性研究
放射性心脏损伤是放疗引起的一系列心血管并发症的统称,从无症状的亚临床异常到可诊断的临床疾病均包括在内[1]。乳腺癌保乳术后患者几乎均需要行放疗,但由于解剖位置的影响,当乳腺作为放疗靶区时,位于胸壁后方的心脏则不可避免地受到照射,存在放射性心脏损伤的风险。
然而,既往回顾性研究多以恶性心血管事件或心血管死亡为观察终点,缺乏对早期放射性心脏损伤的认识[2]。近年来,一些小样本的前瞻性研究显示,在放疗后数周或数月内,一些无症状的亚临床心脏损伤即可出现[3,4,5]。与此同时,随着放疗技术的改进,三维适形和调强放疗技术的应用使心脏及其亚结构的剂量得到准确评估。大分割放疗的应用取得了与常规分割放疗同样的疗效,且明显缩短了治疗时间,已成为乳腺癌放疗的标准治疗原则[6,7]。
目前,关于乳腺癌放射性亚临床心脏损伤的发生率,以及心脏事件的剂量效应关系的前瞻性研究报道很少。临床上缺乏统一的心脏剂量限制标准,特别是大分割放疗的心脏剂量限定经验。本研究中,我们观察了左侧乳腺癌保乳术后大分割照射后2年内心脏损伤的发生情况,探讨大分割放疗与心脏损伤的剂量效应关系,并分析其他可能影响心脏事件发生的肿瘤治疗因素与个人因素,现报告如下。
资料与方法
▶ 入组条件:
(1)18~70岁女性;(2)左侧乳腺癌;(3)保乳术后全乳±区域淋巴结大分割放疗;(4)无基础心脏病史(包括急性心功能不全、慢性心功能不全、心律失常、冠心病、心脏瓣膜病、心肌病、心包疾病和先心病等);(5)放疗前心脏基线检查结果正常。
应用深吸气屏气(deep inspiration breath-hold, DIBH)治疗的患者需符合以下条件:熟练配合DIBH呼吸装置,保证每次屏气时间>35 s,吸气容积>1 L,并可连续重复上述动作≥5次。
2017年1月至2018年9月前瞻性非随机纳入103例患者,中位年龄48岁。根据患者个人意愿、呼吸控制条件,选择采用DIBH技术治疗或常规自由呼吸(free breathing, FB)治疗,即DIBH治疗组(54例)和FB治疗组(49例)。本研究获中国医学科学院肿瘤医院伦理委员会批准(审批号17-039/1362),并取得患者知情同意。
▶ CT定位、靶区勾画、心脏剂量参数评估:
患者仰卧于乳腺托架上,DIBH组患者佩戴呼吸控制装置,在与训练相同的吸气容积下进行CT定位扫描,而FB组患者在常规自由呼吸下进行CT定位扫描,图像上传至Pinnacle计划系统。勾画全乳±瘤床±淋巴引流区的临床靶体积(clinical target volume, CTV),外放成计划靶体积(planning target volume, PTV)。
计划设计时,全组患者均予处方剂量全乳95% PTV 43.5 Gy,分15次完成;其中82例(79.6%)患者瘤床补量95% PTV 49.5 Gy,分15次完成;11例(10.7%)患者接受全乳+锁骨上下区照射95% PTV 43.5 Gy,分15次完成;制定切线野为主的调强放疗(intensity-modulated radiotherapy, IMRT)计划。记录各患者全心脏、左心室(left ventricle, LV)、右心室(right ventricle, RV)和冠状动脉左前降支(left anterior descending coronary artery, LAD)的平均剂量(Dmean)、最大剂量(Dmax)以及受到5~40 Gy照射的相对体积分数(V5~V40)。
▶ 放疗实施、心脏检查与随访:
入组患者分别接受DIBH或FB技术的大分割放疗。放疗前2周内行心脏基线检查,包括B型脑钠肽前体(N-terminal pro-B-type natriuretic peptide, NT-proBNP)、十二导联心电图和门控心肌核素显像,并分别于放疗第2周、放疗结束时、放疗后1个月、之后每半年进行规律随访和相应心脏检查,直至放疗后2年。随访资料来源于患者本院复诊时的门诊检查结果。
▶ 心血管相关危险因素评分:
采用Framingham评分系统,纳入因素包括年龄、收缩压最高值、总胆固醇水平、高密度脂蛋白水平、糖尿病病史、吸烟史。分值越高,发生冠心病的风险越高,其中≤6分:10年绝对风险≤5%;7~10分:10年绝对风险为6%~10%;11~15分:10年绝对风险为11%~20%;>15分:10年绝对风险>20%[8]。
▶ 心脏事件的定义:
心脏事件包括亚临床事件和临床事件。亚临床事件包括下列任一项或多项:(1)心肌酶亚临床事件[9]:NTproBNP为放疗前基线水平升高1.5倍,但未达临床异常;(2)心电图亚临床事件[3,10]:放疗后出现无症状的房性早搏、室性早搏、QT间期延长(QTc> 460 ms)、ST-T改变,尚无需治疗;(3)心肌核素亚临床事件[11]:左心室射血分数(left ventricular ejection fraction, LVEF)较基线水平下降>10%,但不低于50%。
临床事件包括下列任一项或多项:NTproBNP临床检测异常、有症状的心电图异常、LVEF低于50%。观察终点为亚临床心脏事件发生率和临床心脏事件发生率。发生时间始于放疗开始日至放疗后2年内任意心脏事件发生的日期。
▶ 统计学方法:
采用SPSS 25.0统计软件进行统计学分析,计数资料之间的比较采用χ2检验,计量资料之间的比较采用t检验(正态分布)或非参数检验的Wilcoxon秩和检验(非正态分布)。单因素分析的组间差异采用Kaplan-Meier法,并行log rank检验,多因素分析采用Cox回归模型。采用Maxstat方法确定放疗和化疗剂量,以及Framingham评分对亚临床心脏事件发生率影响的最佳界值。检验水准为&α;=0.05。
结果
▶ 两组患者的临床病理特征比较:
由表1可见,DIBH组和FB组患者的临床病理特征差异均无统计学意义(均P>0.05)。DIBH组和FB组的中位Framingham评分分别为2分和4分,差异无统计学意义(P=0.116)。
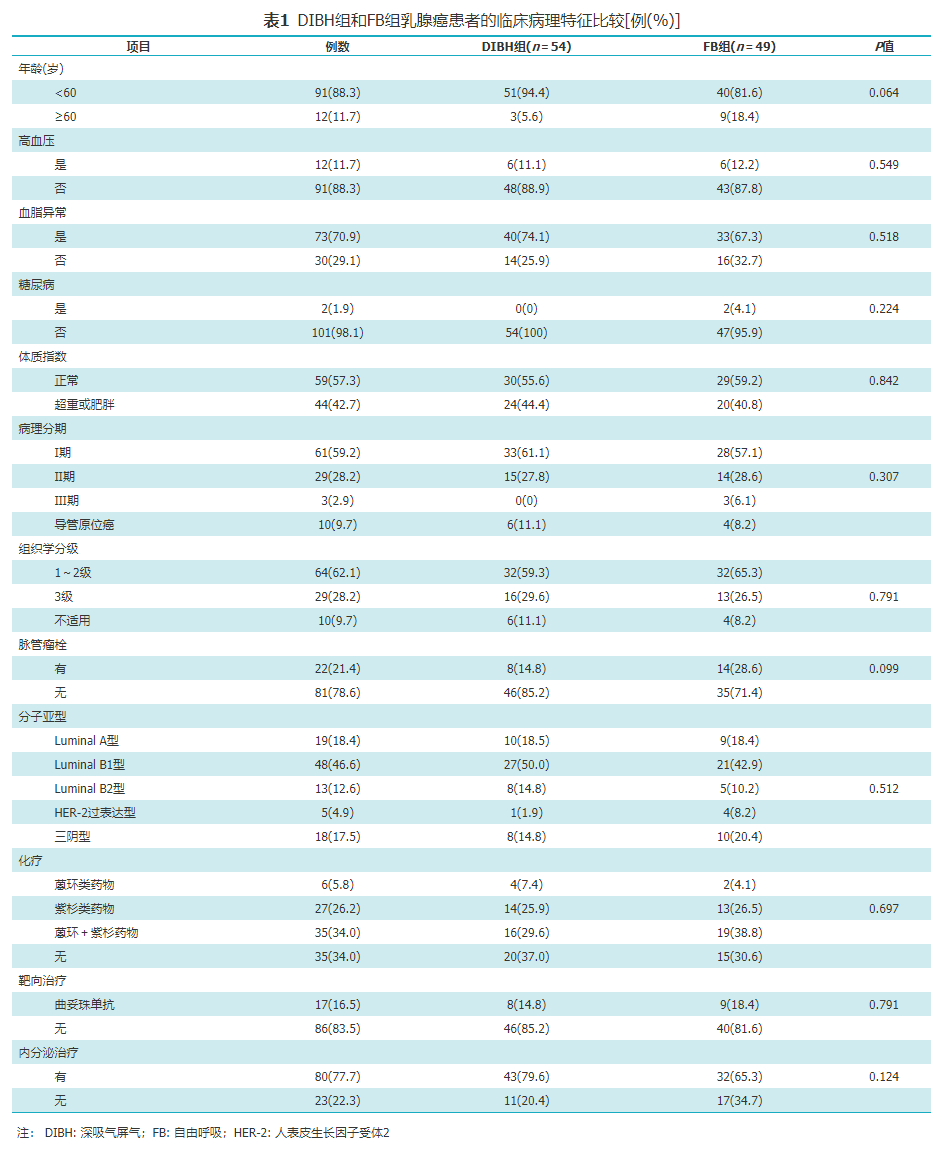
DIBH组和FB组乳腺癌患者的临床病理特征比较[例(%)]
(点击查看大图)
▶ 两组患者的心脏和心脏亚结构剂量-体积参数的比较:
全组患者的心脏、LAD、LV和RV的Dmean分别为4.0、16.9、6.3和4.4 Gy。DIBH组与FB组比较,全心脏、LAD、LV和RV的Dmean、Dmax和V5~V40均明显降低(均P<0.001,表2)。DIBH组和FB组的心脏Dmean分别为2.5 Gy(0.6~7.5 Gy)和5.7 Gy(0.9~1.0 Gy)。
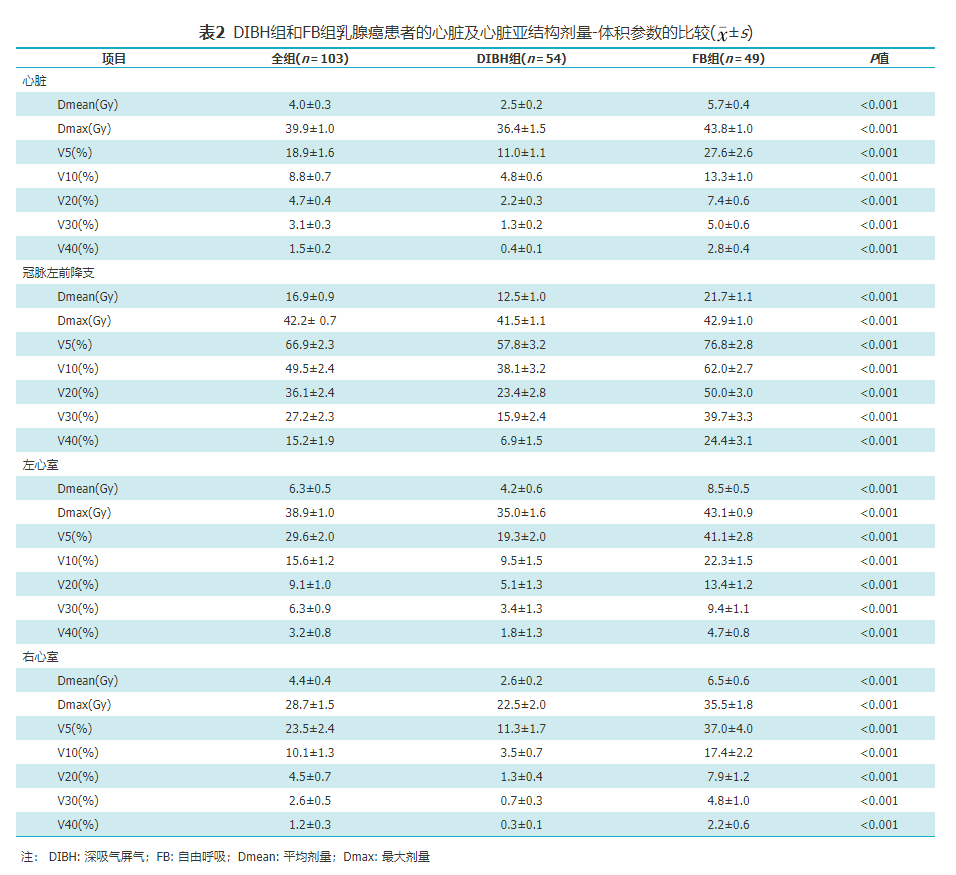
DIBH组和FB组乳腺癌患者的心脏及心脏亚结构剂量-体积参数的比较(±s)
(点击查看大图)
▶ 亚临床心脏事件发生率:
中位随访13.4个月,全组无一例患者出现临床心脏事件,但有44例(42.7%)患者发生亚临床心脏事件,其中单纯心肌酶事件21例,单纯心电图事件12例,心肌酶合并心电图事件9例,单纯LVEF下降1例,心电图合并LVEF下降1例。
全组患者放疗后1、6和12个月的心脏亚临床事件发生率分别为23.5%、31.6%和41.3%。与DIBH组比较,FB组中有更多患者发生亚临床心脏事件,累积事件发生率分别为49.0%(24/49)和37.0%(20/54),DIBH组和FB组12个月亚临床心脏事件的发生率分别为35.3%和48.1%,差异无统计学意义(P=0.206,图1)。
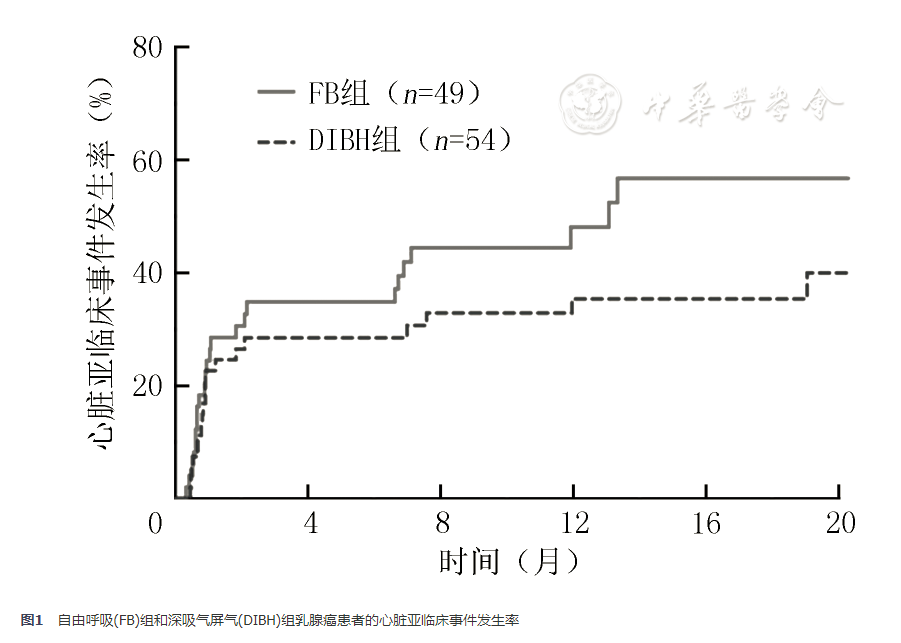
自由呼吸(FB)组和深吸气屏气(DIBH)组乳腺癌患者的心脏亚临床事件发生率
(点击查看大图)
▶ 亚临床心脏事件发生率的影响因素:
Maxstat计算出影响亚临床心脏事件发生率的心脏剂量和化疗药物累积剂量包括:心脏Dmean>4 Gy、LAD V40>20%、左心室Dmean>6 Gy、右心室Dmean>7 Gy、蒽环或紫杉类药物累积剂量>300 mg/m2(均P<0.05)。
单因素分析显示,心脏Dmean>4 Gy、LAD V40>20%、左心室Dmean>6 Gy、右心室Dmean>7 Gy的乳腺癌患者心脏亚临床事件的发生率升高(均P<0.05),化疗、靶向治疗和内分泌治疗与乳腺癌患者的心脏亚临床事件发生率无关(均P>0.05),而蒽环或紫杉类药物累积剂量>300 mg/m2的乳腺癌患者心脏亚临床事件发生率升高(P=0.033,表3)。
将单因素分析中P值<0.1的变量纳入多因素分析,结果显示,左心室Dmean和右心室Dmean是心脏亚临床事件发生率的孤立影响因素(HR=2.082,95%CI为1.028~4.220,P=0.042;HR=2.307,95%CI为1.142~4.661,P=0.020;表4)。
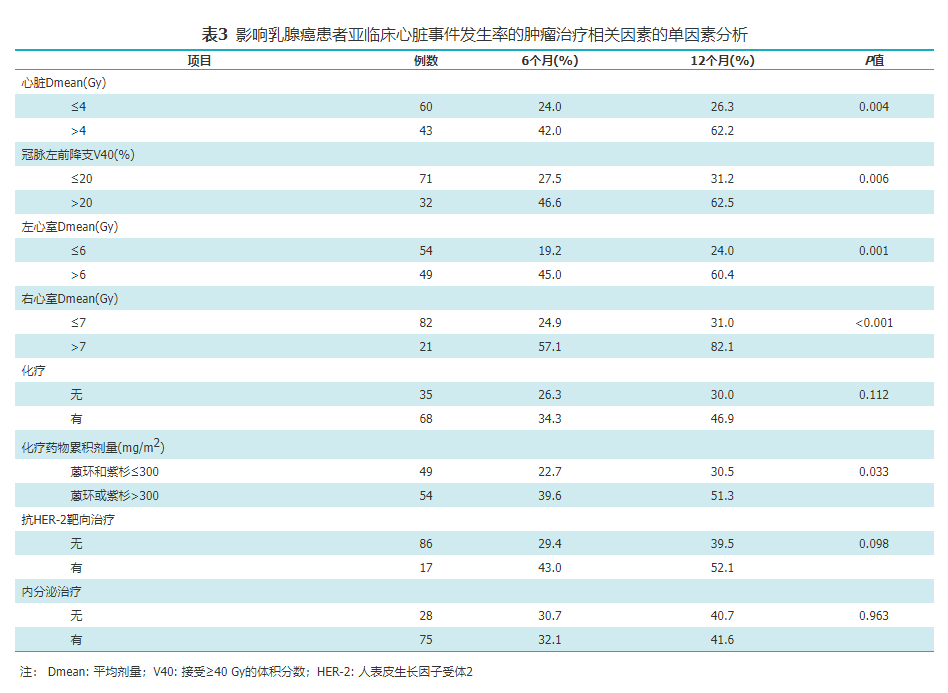
影响乳腺癌患者亚临床心脏事件发生率的肿瘤治疗相关因素的单因素分析
(点击查看大图)
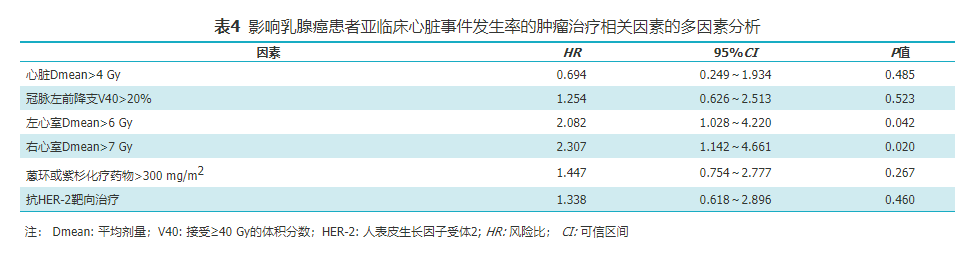
影响乳腺癌患者亚临床心脏事件发生率的肿瘤治疗相关因素的多因素分析
(点击查看大图)
讨论
放射性心脏损伤是乳腺癌放疗后最需重视的并发症,其发生风险与心脏受照射剂量有关[12,13]。
本研究显示,左侧乳腺癌保乳术后患者接受以切线野为主的调强放疗后,在短期内即可出现无症状的亚临床心脏损伤。这种亚临床心脏损伤的发生和放疗心脏剂量、蒽环或紫杉类化疗药物累积剂量有关,而左、右心室的平均照射剂量是影响亚临床心脏事件发生的孤立因素。
放射性心脏损伤的发生与心脏受照射剂量有明显的相关性,心脏平均照射剂量每增加1 Gy,发生急性冠脉事件的相对风险增加7.4%~16.5%,且没有安全的阈值剂量[12,13]。一项荟萃分析显示,乳腺癌放疗的心脏平均剂量值为4.4 Gy,与未放疗相比,心脏病死亡的相对风险为1.3,且心脏平均剂量每增加1 Gy,相对风险增加0.04[14]。
然而,上述研究均基于回顾性研究的系统评价或模型预测,研究终点为严重的心血管事件或心血管死亡。由于放射性心脏损伤临床表现特异性低,乳腺癌患者生存时间长,随着年龄的增长和其他心血管高危因素的累积,不除外存在放疗以外的大量混杂因素。因此,诊断和判别放射性心脏损伤并非易事。
随着对乳腺癌治疗引起的心脏损伤关注和认识的增加,近年来的研究结果显示,在出现明显的临床心脏损伤之前,放疗后的数周或数月内,心功能检查即可捕捉到一些亚临床变化。
亚临床心脏损伤的诊断与评价指标包括:外周血生物标志物,如肌钙蛋白TNI、BNP及其前体NTproBNP,心电图,超声心电图,门控心肌核素显像等[9,15,16,17,18]。有研究显示,左侧乳腺癌患者的NTproBNP在放疗后3年较治疗前基线水平明显升高,且升高幅度与心脏Dmean和左心室Dmean有关[16]。
Portaluri等[17]对29例中位年龄63岁既往无心脏疾病、未行化疗患者的研究结果显示,心脏和左心室Dmean>3.0 Gy者BNP升高。放射性心脏损伤的心电图表现以ST-T改变发生率最高,并且与心脏Dmean有关,可用于放疗后心脏损伤的筛查[3]。有研究显示,在无临床干预的情况下,放疗后半年内有58%~70%的患者可恢复正常[18,19],而LVEF在检测早期心功能变化方面不是一个非常敏感的指标,本研究中仅2例患者出现亚临床性LVEF减低,其敏感性低于心电图和心肌酶检查。
Chung等[20]的研究中纳入32例左侧乳腺癌患者,分别于放疗前后行心肌核素检查,结果显示,放疗后心肌灌注与LVEF无明显变化,表明心脏Dmean<5 Gy是相对安全的。此外,一些先进的心脏检查技术,如心脏弹力超声可以评估左室长轴整体收缩期应变和应变率,应变率的下降能更好地反映心肌收缩功能和左室功能的细微损伤,是比LVEF更优的心脏事件预测指标,在乳腺癌放疗患者中有少量探索性研究[5,21,22]。
然而,亚临床心脏损伤是否会发展成临床可诊断的心脏损伤,目前尚无法判断。鉴于个体心血管相关因素如年龄、血压、血脂、血糖、体质指数等可随时间变化,心脏事件与心脏剂量效应关系需经过长时间的随访和基于人群的大样本验证。因此,本研究结果仍需要长期随访,观察亚临床心脏事件对长期心脏损伤的影响。
为了减少放疗后的心脏损伤,最直接有效的方法是降低心脏受量。DIBH技术是乳腺癌放疗降低心脏剂量的有效方法。通过改变心脏与放疗靶区的相对位置,可使心脏Dmean降低35%~60%,使LAD Dmean降低40%~70%[23,24,25]。但由于随访时间长,混杂因素多,这种剂量学获益可降低多少心血管事件的发病风险,仍处于假设阶段。本研究显示,DIBH组患者发生亚临床心脏事件的比例较低,但与FB组相比,差异无统计学意义。
一项纳入89例乳腺癌患者的小样本研究显示,使用DIBH可使心脏Dmean降低35%,预测模型显示DIBH与FB相比,可降低放射性心脏损伤造成的总生存时间损失(0.07和0.11年)[26]。
目前,调强放疗技术下,乳腺癌心脏Dmean基本控制在5 Gy以下。Taylor等[27]分析了2003—2013年发表的有关乳腺癌患者心脏剂量的149篇研究,结果显示,左侧全乳腺切线野放疗时,心脏Dmean的均值为4.1 Gy。但目前放射性心脏损伤与小范围高剂量照射有关,还是与大面积低剂量散射更为密切尚不清楚。从损伤部位来看,放疗后出现重大心脏事件的乳腺癌患者中,90%为左心室损伤。左侧乳腺癌切线野放疗后心肌缺血发生风险较高的部位依次为心尖、室间隔和左室前壁,而冠脉狭窄易出现于LAD的中远段,其次为近段[28,29]。
因此,不仅要考虑全心脏的Dmean评估,而心室剂量、LAD高剂量区亦应成为心脏剂量学的关注点。本研究显示,心脏Dmean、心室Dmean以及LAD高剂量区(V40)是影响心脏亚临床事件发生率的影响因素。Darby等[12]的研究同样证实,与LAD Dmean相比,心脏Dmean是更好的剂量预测指标。Cao等[30]研究显示,同步曲妥珠单抗放疗的左侧乳腺癌患者,左室舒张功能减低不仅与心脏Dmean,而且与心脏部分结构低剂量照射(心脏D10~D30、V5~V20,左心室V6~V15)均有关。由于多数前瞻性研究样本量小,观察终点标准不一,因而乳腺癌放疗的心脏剂量限制标准仍需进一步探讨。
对于常规分割放疗,尚无统一的心脏剂量限制标准,丹麦乳腺癌协作组对早期乳腺癌放疗的心脏剂量限定为,LAD V20=0和心脏V20≤10%,且认为LAD剂量限制的优先级别高于全心脏的剂量限制[31]。目前,大分割放疗已作为乳腺癌放疗的标准治疗[9,10]。
大样本的回顾性研究结果显示,左侧乳腺癌大分割和常规分割放疗者的15年心脏病死亡率分别为4.8%和4.2%,差异无统计学意义[32]。Berg等[33]的研究结果显示,左侧乳腺癌大分割比常规分割放疗的心脏Dmean偏低。然而,目前尚缺乏大分割放疗时放射性心脏损伤与心脏剂量关系的研究结果。本研究的初步结果为乳腺癌大分割放疗的心脏剂量学限定提供参考,为前瞻性放射性心脏损伤研究设计提供依据。
乳腺癌化疗药物累积剂量对心脏同样有损伤作用,而且可能与放射性心脏损伤有协同作用。蒽环类药物导致浦肯野纤维中动作电位的延长,表现出多发性心律失常,可导致QT间期延长、室上性和室性心律失常[34]。ESMO临床指南推荐,当阿霉素累积剂量为300 mg/m2 , 表阿霉素为450 mg/m2时应定期进行心功能检测[15]。
有研究显示,临床相关浓度的紫杉醇可刺激阿霉素糖苷配基的形成,这是一种可能参与心脏毒性可逆期的代谢产物。因此,紫杉类具有促进阿霉素代谢成心肌毒性物质的潜在作用[35]。然而,紫杉类药物单独使用时,亦可导致心功能减低。
Osman等[36]前瞻性纳入50例接受紫杉类药物治疗的患者,分别于化疗前及化疗后每6个月进行LVEF检测,直至化疗后30个月,有10例患者在化疗后出现不同程度的LVEF减低(5%~20%),但全部在2年内恢复至基线水平,说明紫杉类药物心脏损伤存在可逆性。本研究显示,蒽环或紫杉类药物累积剂量>300 mg/m2的心脏亚临床事件发生率升高,说明化疗药物剂量与心脏损伤存在累积效应,药物叠加使用或累积剂量较高时,仍需密切监测心功能状态。但需要指出的是,本研究入组患者的基线心脏检查是在化疗后、放疗前进行,因此化疗前后的心脏检查指标变化无法得到真实体现。
综上所述,左侧乳腺癌保乳术后患者放疗后可在短期内检测到无症状的亚临床心脏损伤,这种亚临床心脏损伤的发生与心脏剂量有关。本研究作为乳腺癌大分割放疗心脏剂量学的初步探讨,将有助于临床医师制定合理的心脏剂量参数限制标准,评判放射性心脏损伤的发生风险,采取有效方法降低高风险患者的心脏剂量,以达到降低放射性心脏损伤、提高乳腺癌患者生存质量的目的。