胃癌D2术后辅助化疗优于放化疗;双免疗法一线治疗恶性胸膜间皮瘤拟纳入优先审评
要点提示
1.Ann Oncol:胃癌D2术后辅助化疗优于放化疗
2.Ann Oncol:乳腺癌新辅助化疗期间ctDNA阳性患者预后较差
3.CCR:普萘洛尔联合帕博利珠单抗治疗晚期黑色素瘤安全有效
4.CCR:基因组分析显示,FAM20C突变患者使用顺铂神经毒性更高
5.CCR:Debio1143与含有顺铂的同步放化疗联合治疗局部晚期HNSCC,安全可控
6.新药:纳武利尤单抗联合伊匹木单抗一线治疗恶性胸膜间皮瘤拟纳入优先审评
01
Ann Oncol:胃癌D2术后辅助化疗优于放化疗
日前,Annals of Oncology在线发布一项随机对照试验证实,胃癌D2术后辅助化疗(CT)患者的5年总生存率显著高于辅助放化疗(CRT)。

CRITICS试验是一个随机对照试验,纳入788例Ib–Ⅳa期可切除的胃腺癌或胃食管交界癌患者。所有患者随机接受术后CT或CRT。
结果显示,788名患者中有478人按照方案开始术后治疗,其中CT组233人(59%),CRT组中245人(62%)。两组患者和肿瘤特征在术后开始治疗前无差异。中位随访时间6.7年后,CT组患者5年生存率为57.9%(95%CI 51.4%-64.3%),CRT组为45.5%(95%CI 39.2%-51.8%)(HR 1.62,95%CI 1.24-2.12;p=0.0004)。CRT组中腹膜转移明显增多。
研究表明,在调整了所有已知混杂因素后,术后辅助CT组患者5年总生存率显著高于CRT组。
02
Ann Oncol:乳腺癌患者新辅助化疗期间血浆ctDNA阳性与其预后较差有关
日前,Annals of Oncology在线发布一项研究证实,乳腺癌患者新辅助化疗期间血浆ctDNA阳性与其预后较差有关。

该研究纳入84例接受标准新辅助化疗(NAC)或NAC联合MK-2206(AKT抑制剂)的高危早期乳腺癌患者,并在预处理(T0)、紫杉醇治疗3周后(T1)、紫杉醇和蒽环类方案之间(T2)或手术前(T3)采集患者血液,随后从收集的291份血浆中分离游离DNA(cfDNA)。
结果显示,T0时,84例患者中有61例(73%)ctDNA阳性,且随时间呈下降趋势(T1:35%;T2:14%;T3:9%)。T1时,与ctDNA清除的患者[52%患者未达病理完全缓解(pCR)]相比,ctDNA阳性患者(83%患者未达pCR)接受NAC后有残余肿瘤的可能性较大。
同时,NAC后,所有达pCR的患者的ctDNA为阴性(n=17,100%)。在未达pCR的患者(n=43)中,ctDNA阳性患者(14%)的转移复发风险显著增加(HR=10.4;95%CI 2.3–46.6)。此外,未达pCR但ctDNA阴性患者(86%)结局较好,与达pCR患者相似(HR=1.4;95%CI 0.15–13.5)。
研究表明,乳腺癌患者NAC期间ctDNA阳性是患者反应较差和转移复发的重要预测因子,即使在未达pCR的患者中,ctDNA阳性也与生存率较高有关。
03
CCR:普萘洛尔联合帕博利珠单抗治疗晚期黑色素瘤安全有效
11月20日,Clinical Cancer Research在线发表的一项研究显示,普萘洛尔和帕博利珠单抗联合治疗局部晚期转移性黑色素瘤的I期临床试验展现出较好的活性、安全性和耐受性,并制定II期推荐剂量(RP2D)为帕博利珠单抗(200 mg,每3周一次)联用每日2次各30 mg普萘洛尔。

此前的基础研究表明,&β;-肾上腺素受体信号激活可以促进免疫抑制微环境的产生。而临床前研究也表明,抑制&β;-肾上腺素受体信号激活可以增强PD-1检查点抑制剂的活性。
本研究中,研究人员招募了9名晚期黑色素瘤患者进行试验,使用普萘洛尔每日2次,帕博利珠单抗(200 mg,每3周一次)的治疗方案进行3+3剂量递增试验,并确定RP2D。
结果发现,二者联合的客观有效率为78%。患者在普萘洛尔单次剂量分别为10、20和30mg时,未观察到剂量限制性毒性。治疗过程中,44%的患者出现治疗相关不良事件(TRAEs),最常见的是皮疹、疲劳和白癜风,1例患者出现2件3级以上的TRAEs。
这一结果表明,普萘洛尔联合帕博利珠单抗治疗原发性转移性黑色素瘤是安全的,显示出良好的疗效。根据安全性、耐受性和初步抗肿瘤活性,在帕博利珠单抗的基础上,确定RP2D为每日2次各30 mg普萘洛尔。
04
CCR:基因组分析显示,FAM20C突变患者使用顺铂神经毒性更高
2020年11月20日,CCR在线发表了一项研究表明,FAM20C突变是顺铂神经毒性的潜在危险因素之一。

顺铂是癌症常用的一线化疗药物,但是常常会引起神经毒性,包括耳鸣和周围神经病变。但是,目前尚无全面的研究探讨其神经毒性的危险因素。
通过logistic回归对300位顺铂治疗后幸存的睾丸癌患者进行多因分析,评估年龄、病史、生活方式、行为因素、顺铂累积量等多重因素与多种严重的神经毒性症状(包括耳鸣、听力丧失、周围神经病变等)之间的关系。
研究人员发现,年龄(P=6.4×10-16)越大、顺铂累积量(P=5.4×10-4)越多,则发生神经毒性的风险越大。通过校正年龄和顺铂累积量发现,吸烟(既往吸烟,P=0.001;现在吸烟P=0.002)和高血压(P=0.01)也与神经毒性的发生呈正相关。此外,全基因组分析显示基因RGS17(P=3.9×10-5)和基因FAM20C(P=5.5×10-5)突变有显著意义。
具体来说,FAM20C表达降低与顺铂相关的神经毒性风险升高密切相关。
05
CCR:Debio1143与含有顺铂的同步放化疗联合治疗局部晚期HNSCC,安全可控
2020年11月20日,CCR在线发表的一项研究显示,凋亡蛋白抑制剂的拮抗剂Debio1143与含有顺铂的同步放化疗联合治疗局部晚期头颈部鳞癌(LA-HNSCC)安全有效。

该研究纳入的患者为未经治疗的LA-HNSCC患者,共14例。使用Debio1143(100,200,300mg/天,每3周进行14天治疗)与同步放化疗方案(顺铂100mg/m2,每3周一次,共3周期;常规放疗,70Gy/7周)联合治疗。在联合治疗9周之后,进行剂量限制性毒性(DLT)的评估。
结果显示,在使用Debio1143 200mg/天的6例患者中,2例发生了DLT,该剂量被认为是最大耐受剂量和Ⅱ期临床研究推荐剂量。在本研究中,常见的3~4级不良反应包括吞咽困难(36%)、黏膜炎(29%),实验室检查的数据尽管异常频率高,但是均为轻度。18个月时总体局部控制率为85%,总体有效率为85%,完全缓解(CR)率为69%,2年无进展生存(PFS)率为74%。
总之,Debio1143与含有顺铂的同步放化疗联合治疗LA-HNSCC安全可控,前期的疗效数据喜人,建议进一步探索。
06
新药:纳武利尤单抗联合伊匹木单抗一线治疗恶性胸膜间皮瘤拟纳入优先审评
11月23日,中国国家药监局药品审评中心(CDE)位点最新公示,PD-1抑制剂纳武利尤单抗和CTLA-4抗体伊匹木单抗联合疗法以“符合附条件批准的药品”拟纳入优先审评,拟开发适应症为:用于治疗初治的不可切除的非上皮样型恶性胸膜间皮瘤成人患者。
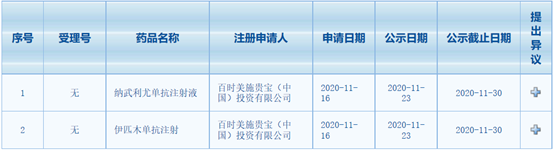
CheckMate-743是一项多中心、随机、开放标签的III期临床试验,研究共纳入605名受试者,并被随机分配到试验组和对照组。其中,试验组受试者接受长达2年的纳武利尤单抗联合伊匹木单抗治疗,对照组受试者接受6轮培美曲塞加顺铂或卡铂治疗。
中期分析数据显示,与化疗相比,联合疗法让患者中位OS延长4个月(18.1个月 vs 14.1个月),并降低了患者死亡风险26%。在24个月时,试验组仍有41%患者存活(vs 27%)。其中,上皮型和非上皮型患者的中位OS分别为18.7个月(vs 16.5个月)和18.1个月(vs 8.8个月)。
基于该研究数据,纳武利尤单抗联合伊匹木单抗有望成为这类患者新的标准治疗。
参考资料:
1.W.O.de Steur,R.M.van Amelsfoort,H.H.Hartgrink,et.al.Adjuvant chemotherapy is superior to chemoradiation after D2 surgery for gastric cancer in the per-protocol analysis of the randomized CRITICS trial.2020.11.20.https://doi.org/10.1016/j.annonc.2020.11.004.
2.M.J.M.Magbanua,L.BrownSwigart,H.T.Wu,et.al.Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival.2020.11.21.https://doi.org/10.1016/j.annonc.2020.11.007.
3.Shipra Gandhi,Manu R.Pandey,Kristopher Attwood,et.al.Phase I Clinical Trial of Combination Propranolol and Pembrolizumab in Locally Advanced and Metastatic Melanoma:Safety,Tolerability,and Preliminary Evidence of Antitumor Activity.Clin Cancer Res November 20.2020.https://clincancerres.aacrjournals.org/content/early/2020/11/20/1078-0432.CCR-20-2381
4.Trendowski MR,Wheeler HE,El-Charif et.al.Clinical and Genome-Wide Analysis of Multiple Severe Cisplatin-Induced Neurotoxicities in Adult-Onset Cancer Survivors.Clin Cancer Res.2020 Sep 30.
5.Le Tourneau C,Tao Y,Gomez-Roca C,et al.Phase I Trial of Debio 1143,an Antagonist of Inhibitor of Apoptosis Proteins,Combined with Cisplatin Chemoradiotherapy in Patients with Locally Advanced Squamous Cell Carcinoma of the Head and Neck[published online ahead of print,2020 Sep 29].Clin Cancer Res.2020;10.1158/1078-0432.CCR-20-0425.doi:10.1158/1078-0432.CCR-20-0425
6.https://mp.weixin.qq.com/s/1a03duGeD5kAezuPqSICpw