非高危人群的肺癌筛查策略

非高危人群的肺癌筛查策略
周耀东1,2,3,陈宗炜3,4,陈海泉1,2,3
1.复旦大学附属肿瘤医院胸外科,复旦大学上海医学院肿瘤学系,上海 200032;
2.基因工程重点实验室,上海 200032;
3.复旦大学胸部肿瘤研究所,上海 200032;
4. 复旦大学附属中山医院胸外科,上海 200032
[摘要] 低剂量螺旋计算机断层扫描(low-dose spiral computed tomography,LDCT)筛查肺癌可以将高危人群的死亡率降低20.0%。但是现行的高危人群筛查标准存在局限性,并不能覆盖非高危人群,因此需要有新的具体的筛查策略应对非高危人群的肺癌筛查。现在有些单位把肺癌CT筛查当作员工福利,不分年龄、基线CT结果和其他因素,每年都做1次,不但浪费医疗资源,而且对员工的身心健康亦有害。我们建议将第1次基线LDCT的时间提前至30岁附近,并根据基线CT的发现结果,结合不同年龄段和其他危险因素将随访间隔延长2~10年。针对非高危人群应当采取折中的筛查策略,不但能早期发现肺癌,还能减少CT的辐射暴露。
[关键词] 低剂量螺旋计算机断层扫描;肺癌;非高危人群;不吸烟者;惰性
[Abstract] Low-dose spiral computed tomography(LDCT) screening for lung cancer reduced mortality in high-risk groups by 20.0%. The current screening criteria for high-risk groups have limitations and cannot be applied to non-high-risk groups. New specific screening strategies are needed. Now some companies put lung cancer CT screening as a benefit, regardless of age and other factors to do once a year, which is not only a waste of medical resources, but also harmful to physical and mental health. It is recommended to advance the time of the first baseline LDCT to near the age of 30 years, and to extend the follow-up interval from 2 to 10 years according to the findings of baseline CT combined with different age groups and other risk factors. A compromise screening strategy should be adopted for non-high-risk groups to detect lung cancer early and reduce CT radiation exposure.
[Key words] Low-dose spiral computed tomography; Lung cancer; Non-high-risk population; Non-smokers; Indolent
肺癌居全球肿瘤发病和死亡的第1位;2018年全球肺癌新发2 093 876例,死亡人数1 761 007例,占所有肿瘤死亡人数的近1/5(18.4%)[1]。国内情况大致相同,国家癌症中心最新的统计数据表明,肺癌居中国男性恶性肿瘤发病的第1位和女性的第2位;2015年新发患者数为78.7万例;其中,男性新发病例约52.0万例,女性约26.7万例;2015年肺癌死亡人数约为63.1万例,死亡率约为45.87/10万[2]。无论国内还是国外,死亡率如此之高最重要的原因是不能做到早发现、早诊断和早治疗。有数据表明,57%的患者发现时已经是晚期[3]。所以肺癌的5年总体生存率只能维持在14%~18%[4],但是Ⅰ期患者的5年生存率可达67%[5]。因此,肺癌的早期筛查、早期诊断的重要性不言而喻。
1 高危人群肺癌筛查的现状
肺癌的早期筛查方法经历了20世纪50和60年代的胸片(chest X-ray,CXR)和痰脱落细胞检查,到70年代的支气管镜检查,一直到90年代的低剂量螺旋计算机断层扫描(low-dose spiral computed tomography,LDCT)等缓慢的发展过程。最早的筛查研究可追溯到1960年英国伦敦的肺癌研究计划,结论是CXR可以早发现肺癌,但是无法降低死亡率。1993年美国的前列腺癌、肺癌、结直肠癌和卵巢癌筛查试验(Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial,PLCO)队列研究也得到了类似结果[6]。直到2011年,美国国家肺部筛查试验(National Lung Screening Trial,NLST)的初步结果显示,与CXR相比,应用LDCT作为筛查方法,高危人群的肺癌死亡率下降了20%[7]。另外,荷兰的NELSON研究表明,接受LDCT筛查的男性肺癌死亡率降低26%,女性肺癌死亡率降低61%[8],并且2020年初再次在《新英格兰医学杂志》(New England Journal of Medicine,N Engl J Med)上发表了10年随访研究结果,对于高危人群,接受LDCT筛查者的肺癌死亡率明显低于未接受LDCT筛查者[9]。如此振奋人心的研究结果,促成LDCT筛查在全球普遍开展。中国也于2009年在国家医改重大专项“农村癌症早诊早治”项目中将肺癌纳入试点,启动了中国肺癌高危人群筛查工作。目前已涵盖6个省/直辖市的11个肺癌高危人群筛查项目点,每年在20 000多肺癌高危人群中开展肺癌LDCT筛查[10]。但是,问题依然存在,因为能够从肺癌筛查中获益的人群是经过筛选的,即所谓的高危人群。高危人群的定义是指年龄在55~74,吸烟指数(pack-year)30包/年或过去15年内戒烟的既往吸烟人群。那么在此范围之外的人群,即非高危人群,是否能从肺癌筛查中获益呢?
2 高危人群肺癌筛查存在的问题
2013年,Kovalchik等[11]报道,通过对肺癌人群危险度分层研究发现,非高危人群的死亡率并没有下降,即他们并不能从现有的肺癌筛查手段中获益。不仅如此,按NLST的高危人群筛查标准,在Nemesure等[12]研究的1 046名曾经吸烟者中,40%的吸烟者没有达到肺癌筛查试验年龄的要求,20%的吸烟者没有30包/年以上的吸烟史,30%的吸烟者在诊断前15年就戒烟了,由此认为他们不适合筛查。而事实上,依这样的标准至少要漏掉50%需要筛查的人。因此,NLST的筛查标准不但存在明显的局限性,也无法覆盖非高危人群。而在这些人群中占有主体比例的是不吸烟人群,他们罹患肺癌的流行病学特征、发病机制、病理生理学改变都与吸烟型肺癌大相径庭[13]。因此,对不同的人群所采取的筛查策略也不应雷同。因此,当前急需确立不同的策略来应对非高危人群的筛查,从而降低非高危人群的肺癌死亡率。
3 非高危人群肺癌筛查的必要性
反对非高危人群筛查的一个核心研究于2013和2014年分别在N Engl J Med和PLoS Med上由Martin团队发表,主要是基于PLCOm2012和PLCOm2014两个肺癌风险模型的研究而得出的结论[14-15],即不吸烟者不需要筛查,尤其亚裔人群,有无吸烟史罹患肺癌风险无差别。因为预防1例肺癌死亡所需筛查的非高危人群数是5 276人,而高危人群只需要筛查161人,所以研究认为非高危人群筛查耗时费力,效能太低,为了追求最大的效益成本比,不应该进行筛查。但是,这个研究存在一个最大的偏倚,其纳入的人群主要是高加索人,亚裔人群只有2 000人,且其中只有7人罹患肺癌,说服力有限。因为亚洲非高危人群中的肺癌呈现完全不一样的发病特点。
3.1 非高危群人肺癌的独特性
复旦大学附属肿瘤医院做过两项临床研究,第一项是从2013年8月—2014年8月,在上海市闵行区几个社区对11 332名参与者进行LDCT筛查。与吸烟者(159.06/105)相比,非吸烟参与者中原发性肺癌的发生率为336.97/105[16]。第二项研究是2012—2018年通过LDCT对来自中国不同地区的6家医院(上海3家、山东1家、江苏1家、广东1家)的8 392名医院员工进行的定期健康检查以及韩国首尔国立大学Bundang医院的数据[17]。女性的肺癌检出率明显高于男性(2.5% vs 1.3%,P=0.001)。同样,非吸烟者的检出率也比吸烟者高(2.2% vs 1.4%,P=0.092)[17]。不仅如此,上海市疾病预防控制中心发布的数据也印证了这些发现[18],年轻且不吸烟女性肺癌发病率显著上升[16-18]。日本与韩国的研究也得到了类似结果[19-20]。也就是说,非高危人群的肺癌发病率并不低。因此,至少在亚洲,非高危人群肺癌高发的程度需要引起重视,并且给予妥善的预防和筛查。
3.2 非高危群人肺癌的异质性
Detterbeck等[21-22]根据肿瘤生长率的巨大差异提出以“惰性(indolent)”、“低侵袭性(less aggressive)”和“侵袭性(aggressive)”这3个词来描述各组肺癌。这种分类,可以加深对肺癌生物学行为的理解,并有可能制订出更有针对性的筛查方案。肺癌筛查的普遍开展必然不成比例地检出这三种类型的肺癌,尤其会较多发现诸如低侵袭性和惰性这样生长较缓慢的肿瘤。这些肿瘤无症状存在的时间更长,更容易被忽视,而筛查则易发现这些肿瘤。从目标角度来看,高危人群的筛查更多的是为了覆盖一部分希望被发现的低侵袭性肺癌,从而降低死亡率;而非高危人群的筛查则主要针对的是惰性和少部分低侵袭性肺癌。从动态角度来看,这三种类型的肺癌在生长过程中并不是一成不变的,虽然尚无明确报道进展期肺癌可以自发消退,但是临床上确实可以观察到肺内磨玻璃密度影(ground-glass opacity,GGO)肺癌逐渐变成实性结节肺癌而危及患者生命。事实上,2019年已有文献报道,惰性和低侵袭性的磨玻璃样结节,就算经历5年随访平稳期,之后依然会进展为侵袭性肿瘤,需要手术治疗[23]。正因为这种明显的异质性,所以非高危人群肺癌筛查的开展就显得更有必要,也更有价值。
4 非高危人群筛查的策略
在提出非高危人群肺癌筛查策略之前,有两个不可回避的经典问题。
第一个是检查中CT的辐射伤害问题。每次检查时LDCT有效的放射剂量估计为1.5 mSv,增强CT检查,其剂量可达8.0 mSv;正电子发射断层扫描(positron emission tomography,PET)/CT可达14.0 mSv[24-25]。反复接受检查辐射危害很多,而且具有蓄积效应。有数据表明,每筛查2 500个人中,CT辐射可能导致1例癌症患者死亡[25]。因此有效避免辐射伤害对参加筛查的人群至关重要。非高危人群筛查的目的并不意味着要多做CT,恰恰相反,而是为了减少做CT的频率,通过审慎而规范的随访流程,最大程度地减少辐射伤害。
另一个问题就是过度诊断和过度治疗。这是全世界反对筛查的学者经常用来讨论的话题。过度诊断简单来说就是发现在没有筛查的情况下原本无法诊断出的需组织学检查证实的癌症。一项来自意大利的观察研究认为,肺癌筛查伴随的过度诊断率可达25.0%[27],而一项基于NLST数据模型预估出的过度诊断率也达18.5%[28]。过度诊断之后可能会带来不必要的过度治疗,由此很多良性结节会被手术切除,增加患者的患病风险和痛苦,加重社会经济负担。国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)认为手术的良性比例应该控制在15%以下[29]。作者认为,这样的良性比例指标确实算宽松的。复旦大学附属肿瘤医院每月进行的发病率和死亡率(morbidity and mortality,MM)汇报数据显示,基本上肺结节的良性率控制在6%~8%。我们认为,严格的流程、审慎地评估以及足够的随访时间是控制良性结节比例最有效的方法。由此看来,过度诊断和过度治疗是完全可以合理控制的,因噎废食并不可取。综上,我们提出针对非高危人群的肺癌筛查策略,以求最少的CT次数、最合理的CT间隔达到早期筛查出肺癌的目的。
4.1 策略1:提前基线CT(baseline CT)时间到30岁附近
30岁是所有肺癌研究的起点,提前基线CT时间最主要的目的是,尽早发现早期肺癌以及为后续制定筛查计划做量化铺垫。非高危人群的肺癌和高危人群的肺癌最大的不同在于肿瘤人群的年轻化和生物学行为的惰性化,所以进行第一次CT检查的时间需要提前才能保证覆盖范围更广。不仅如此,已有研究表明,年轻人中的肺癌因为容易被忽视所以发现较晚,进展迅速而导致预后较差[30-31]。而实际上,在临床实践中,大中心的门诊上遇到就诊的30岁左右的年轻肺癌患者绝不罕见[32-33]。其中有一些往往是因为转移而被首次诊断,有的术后较短时间又发生了转移。中国Li等[32]回顾性分析了2013年11月—2018年10月在中国医学科学院肿瘤医院收治的30岁及以下的肺癌患者103例,其中有8例(8.1%)患者分别出现局部复发(2例,2.3%)和远处转移(6例,6.8%)。在年轻的肺癌患者中,磨玻璃结节可能出现得较早而进展较慢,因此会留有很长一段外科可介入的时间窗口。对于这些患者,不应该仅因为不符合成本效益原则或工作量大等原因就放弃筛查,建议在有条件的国家应该合理开展。在中国,筛查科普深入人心,等待检查时间、检查价格较欧美国家有优势,因此可以对非高危人群展开科学的肺癌筛查工作,对筛查出的肺癌患者予以治疗,提高患者的生存率。作者近期遇到两个病例,具有一定的代表性,却是一正一反的结果,分享如下:第1例患者是1例14岁女孩,由于持续发热和咳嗽而于2018年5月11日在患者所在地医院进行胸部CT检查,结果显示,右下背部肺段有一个6 mm的磨玻璃样结节(图1A)。观察1年后(2019年5月31日),结节仍然存在并且比以前大2 mm(图1B)。经过3个月的进一步观察,结节无明显变化。后在2019年8月进行胸腔镜亚肺叶切除术,术后病理学诊断为微浸润性腺癌。若不是偶然地一次胸部CT检查,那么这个磨玻璃样结节在10年后会给这个小女孩带来什么样的后果?20年后又会怎么样?另1例是38岁、3 cm混杂磨玻璃样结节的女性(图1C),接受了胸腔镜下右上肺叶切除加纵隔淋巴结清扫术。术后病理学检查结果显示为腺癌,但第12组(1/9)淋巴结转移,TNM分期为T2aN1M0(ⅡB分期)。如果她在5~10年前接受过肺癌筛查并进行了浸润前的手术,预后将截然不同。

图 1 1例14岁和l例38岁患者胸部CT影像
Fig. 1 CT scan images of 14-year-old and 38-year-old patients
A: CT scan on May 11, 2018; B: CT scan on May 31, 2019; C: CT scan of a 38-year-old patient before surgery. The white arrows indicated nodules
因此,我们建议非高危人群应在30岁附近进行第1次的基线LDCT检查。很多时候这种检查都是非刻意就完成的,有可能是对其他疾病进行检查或鉴别诊断的需要,或是体格检查等。即使刻意完成1次LDCT,也是值得和需要的,因为单次的LDCT辐射低,代价小,但这次的检查结果将成为以后筛查、随访、甚至复查的基准和证据。需要着重指出的是,必须把握好CT检查的度。现在有些科普重点宣传肺部磨玻璃结节却忽略CT检查频次问题,有些单位把包括CT在内的体检当成“福利”送给员工去做,每年完成1次,有些人因为“疑病、恐癌”反复不停地进行CT检查等,这些不正确、不科学的行为不但会严重浪费医疗资源,让真正需要检查的人排队等待,更重要的是辐射会对受检者造成辐射剂量蓄积和不可逆转的伤害。临床上我们遇到很多初诊患者,2周内做过3次CT:1次体检CT,2次不同医院CT,其中有的CT可能还是增强的,就这还不包括紧接的随访CT,频次之高,辐射剂量之大,令人咂舌。
4.2 策略2:随访的间隔时间应更加延长
在我们的建议中,第1次LDCT后,如果结果为阴性,则间隔时间将根据年龄和其他危险因素而有所不同(图2),旨在最大程度地减少诊断前CT随访的次数和增加发现癌症进展的机会。对于50岁以下的人群,间隔时间可以延长到5~10年。但是对于50~60岁的人群,如果没有其他危险因素,则间隔时间为5年;如果存在至少一种其他危险因素,则间隔时间缩短至3年。同样,对于60和70岁的人群,建议分别间隔3年和2年。对于70岁以上的人群,无论其他危险因素如何,建议的间隔时间均为2年。如果在第1次LDCT检查时发现有结节,则该患者应进入另一个结节评估和诊疗过程。
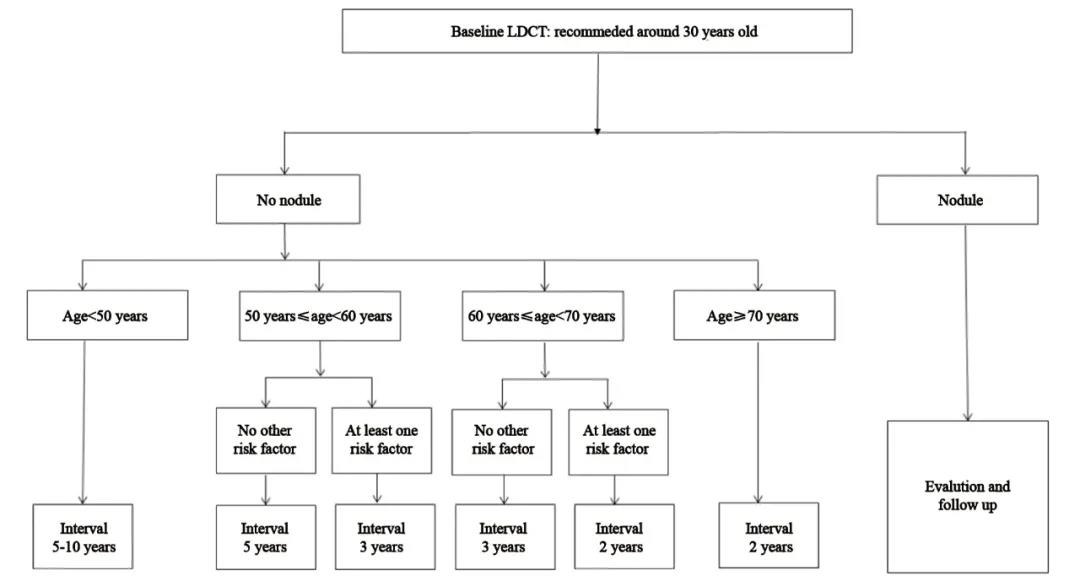
图 2 随访策略
Fig. 2 Follow-up strategy
5 总结
总而言之,非高危人群的肺癌需要引起更多的重视;频繁的肺癌CT筛查不但浪费医疗资源,而且对受检者的身心健康也明显有害。对于非高危人群的筛查应当遵循折中、妥当、不保守、不激进的策略,即提前基线CT的时间在30岁附近和延长随访的间隔2~10年。这对发现早期肺癌,提高肺癌患者生存率,减少辐射伤害是大有裨益的。
[参考文献]
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin, 2018, 68(6): 394-424
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志, 2019, 41(1): 19-28.
ZHENG R S, SUN K X, ZHANG S W, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28.
Cancer Stat Facts: lung and bronchus cancer lung cancer from 2010–2016[EB/OL]. https://seer.cancer.gov/statfacts/.
YOULDEN D R, CRAMB S M, BAADE P D. The international epidemiology of lung cancer: geographical distribution and secular trends[J]. J Thorac Oncol, 2008, 3(8): 819-831.
MOUNTAIN C F. Revisions in the international system for staging lung cancer[J]. Chest, 1997, 111(6): 1710-1717.
OKEN M M, HOCKING W G, KVALE P A, et al. Screening by chest radiograph and lung cancer mortality: the Prostate, Lung, Colorectal, and Ovarian(PLCO) randomized trial[J]. JAMA, 2011, 306(17): 1865-1873.
ABERLE D R, ADAMS A M BERG C D, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409.
DE KONING H J, VAN DER AALST C M, HAAF K T, et al. PL02.05 Effects of volume CT lung cancer screening: mortality results of the NELSON randomised-controlled population based trial [J]. J Thorac Oncol, 2018, 13: S185.
DE KONING H J, VAN DER AALST C M, DE JONG P A, et al. Reduced lung-cancer mortality with volume CT screening in a randomized trial [J]. N Engl J Med, 2020, 382(6): 503-513.
ZHOU Q, FAN Y, WU N, et al. Demonstration program of population-based lung cancer screening in China: rationale and study design [J]. Thorac Cancer, 2014, 5(3): 197-203.
KOVALCHIK S A, TAMMEMAGI M, BERG C D, et al. Targeting of low-dose CT screening according to the risk of lung-cancer death[J]. N Engl J Med, 2013, 369(3): 245-254.
NEMESURE B, PLANK A, REAGAN L, ALBANO D, et al. Evaluating efficacy of current lung cancer screening guidelines[J]. J Med Screen, 2017, 24(4): 208-213.
SUN S, SCHILLER J H, GAZDAR A F. Lung cancer in never smokers-a different disease[J]. Nat Rev Cancer, 2007, 7(10): 778-790.
TAMMEMÄGI M C, KATKI HA, HOCKING W G, et al. Selection criteria for lung-cancer screening[J]. N Engl J Med, 2013, 368(8): 728-736.
TAMMEMÄGI M C, CHURCH T R, HOCKING W G, et al. Evaluation of the lung cancer risks at which to screen ever- and never-smokers: screening rules applied to the PLCO and NLST cohorts[J]. PLoS Med, 2014, 11(12): e1001764.
LUO X, ZHENG S, LIU Q, et al. Should nonsmokers be excluded from early lung cancer screening with low-dose spiral computed tomography? Community-based practice in Shanghai[J]. Transl Oncol, 2017, 10(4): 485-490.
ZHANG Y, JHEON S, LI H, et al. Results of low-dose computed tomography as a regular health examination among Chinese hospital employees[J]. J Thorac Cardiovasc Surg, 2020, 160(3): 824-831.
LIANG F, WU C, GU H, et al. Lung cancer incidence in female rises significantly in urban sprawl of Shanghai after introduction of LDCT screening[J]. Lung Cancer, 2019, 132: 114-118.
KIM H Y, JUNG K W, LIM K Y, et al. Lung cancer screening with low-dose CT in female never smokers: retrospective cohort study with long-term national data follow-up[J]. Cancer Res Treat, 2017, 50(3): 748–756.
SAGAWA M, NAKAYAMA T, TANAKA M, et al. A randomized controlled trial on the efficacy of thoracic CT screening for lung cancer in non-smokers and smokers of <30 pack-years aged 50-64 years(JECS study): research design[J]. Jpn J Clin Oncol, 2012, 42(12): 1219-1221.
DETTERBECK F, GIBSON C. Turning gray: the natural history of lung cancer over time[J]. J Thorac Oncol, 2008, 3(7): 781e92.
DETTERBECK F C. Cancer, concepts, cohorts and complexity: avoiding oversimplification of overdiagnosis[J]. Thorax, 2012, 67(9): 842-845.
LEE H W, JIN K N, LEE J K, et al. Long-term follow-up of ground-glass nodules after 5 years of stability[J]. J Thorac Oncol, 2019, 14(8): 1370-1377.
METTLER F A JR, HUDA W, YOSHIZUMI T T, et al. Effective doses in radiology and diagnostic nuclear medicine: a catalog[J]. Radiology, 2008, 248(1): 254-263.
SMITH-BINDMAN R, LIPSON J, MARCUS R, et al. Radiation dose associated with common computed tomography examinations and the associated lifetime attributable risk of cancer[J]. Arch Intern Med, 2009, 169(22): 2078-2086.
BACH P B, MIRKIN J N, OLIVER T K, et al. Benefits and harms of CT screening for lung cancer: a systematic review[J]. JAMA, 2012, 307(22): 2418-2429.
VERONESI G, MAISONNEUVE P, BELLOMI M, et al. Estimating overdiagnosis in low-dose computed tomography screening for lung cancer: a cohort study [J]. Ann Intern Med, 2012, 157(11): 776–784.
PATZ E F JR, PINSKY P, GATSONIS C, et al. Overdiagnosis in low-dose computed tomography screening for lung cancer[J]. JAMA Intern Med, 2014, 174(2): 269-274.
FIELD J K, SMITH R A, ABERLE D R, et al. International Association for the Study of Lung Cancer computed tomography screening workshop 2011 report[J]. J Thorac Oncol, 2012, 7(1): 10-19.
DECARO L, BENFIELD J R. Lung cancer in young persons[J]. J Thorac Cardiovasc Surg, 1982, 83(3): 372-376.
YONEYAMA R, SAJI H, KATO Y, et al. Clinicopathological characteristics and treatment strategies for young lung cancer patients[J]. Ann Transl Med, 2019, 7(5): 100.
LI F, HE H, QIU B, et al. Clinicopathological characteristics and prognosis of lung cancer in young patients aged 30 years and younger[J]. J Thorac Dis, 2019, 11(10): 4282-4291.
GALVEZ-NINO M, RUIZ R, PINTO J A, et al. Lung cancer in the young[J]. Lung, 2020, 198(1): 195-200.