机制不明,肠道菌群...哈佛耶鲁科学家《Cell》揭开其抗病毒机制的面纱

众所周知,肠道菌群对人体健康具有包括从心理健康到生理健康的一系列深远影响,而且已经得到了充分证实。然而,肠道菌群在天然抵抗病毒感染中发挥重要作用的这一机制至今还未查明。
现在,这一领域有了新的进展。
北京时间11月19日,发表在《Cell》上的一项新研究中,来自哈佛医学院和耶鲁大学的研究人员在小鼠研究中鉴定出特定的肠道细菌,可以诱导免疫细胞释放出一种被称为1型干扰素(IFN-1)的抗病毒化学物质。重要的是,他们进一步精准确定并分离出广泛的肠道细菌所共有的分子,补充这种分子足以恢复整个肠道菌群的保护作用

研究通讯作者、哈佛医学院Blavatnik研究所免疫学教授Dennis Kasper说:“考虑到干扰素在疾病和健康中的关键作用,我们鉴定的细菌分子可以诱导干扰素保护信号,这将为开发增强抗病毒免疫的治疗性化合物开辟新的途径。”
在我们出生后不久,体内都存在低水平的干扰素信号,它在没有主动感染的情况下提供抗病毒保护,然而该信号传导途径和方式是一直是未知的。
这项新研究为这一现象提供了证据,证明这种保护性反应来自于位于结肠壁的免疫细胞。研究表明,这些细胞在受到特定肠道细菌膜上的表面分子刺激时会释放出保护性干扰素。
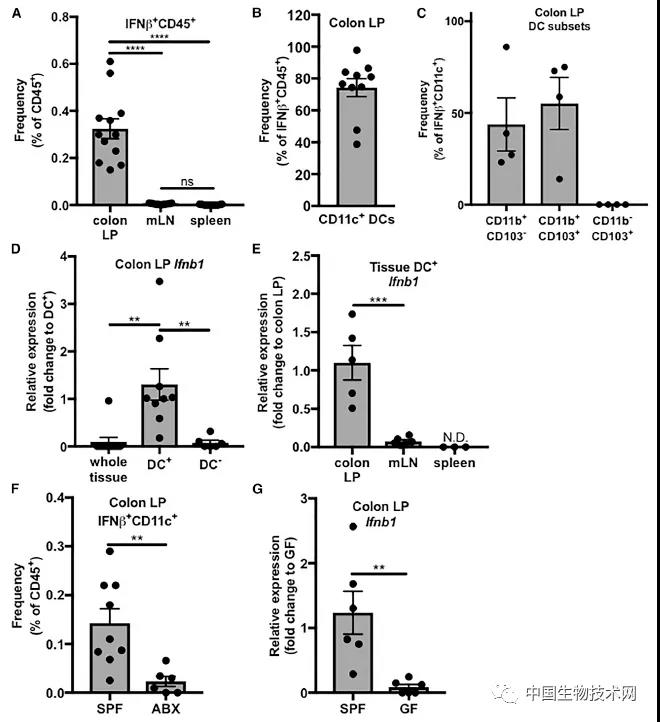
在对细胞和动物进行的一系列实验中,研究人员发现这些微生物中的一种,即脆弱拟杆菌(b.fragilis)存在于大多数人体肠道中,它是最常见的一种厌氧菌,能分解糖。正常情况下,它可以启动一系列信号级联反应,以诱导结肠中的免疫细胞释放一种叫做β干扰素(IFNβ)的蛋白质,这是一种重要的免疫化学物质,可通过两种方式提供抗病毒保护:它既能诱导感染病毒的细胞自我毁灭,也能刺激其他类型的免疫细胞攻击病毒。
这项新研究证实细菌表面的一个分子通过激活TLR4-TRIF信号途径来触发β干扰素的释放。该途径由先天免疫系统中九种toll样受体(TLR)中的一个启动。当免疫细胞表面的蛋白质识别出感染性生物体表面的特定分子模式,一种toll样受体对这些入侵者进行免疫防御,同时这一途径就被激活。
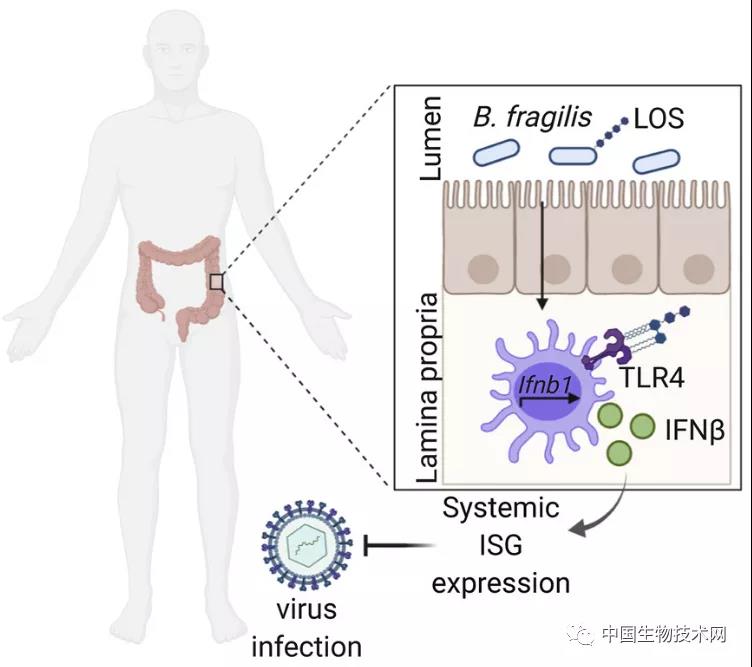
研究团队接下来进行的实验表明,当脆弱拟杆菌表面的分子通过TLR4-TRIF受体与结肠的免疫细胞通讯时,就会开启其中一条信号途径,从而分泌出对抗病毒的β干扰素。
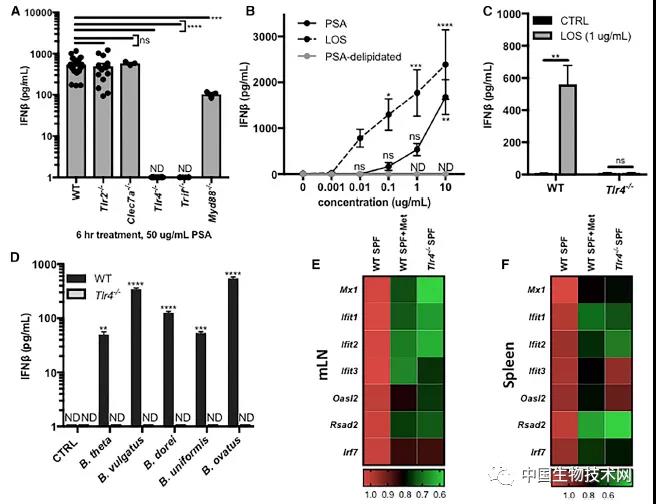
研究人员发现,开启这一级联反应的特定表面分子并不是脆弱拟杆菌所特有的,它也存在于同一家族的其他多种肠道细菌中。因此,研究人员测试了携带该分子的其他细菌是否也能触发类似的免疫信号。
在一组小鼠中进行的实验表明,含有这种分子的膜可以成功地启动类似的信号,这种分子存在于多种拟杆菌家族细菌中。这一发现表明,广泛的免疫保护信号在许多肠道细菌中都很普遍存在。
为了确定脆弱拟杆菌是否能保护动物不受感染,研究人员对两组小鼠进行了测试:一组用抗生素治疗以耗尽肠道菌群,另一组使用完整的肠道菌群。接下来,研究人员让接受治疗和未接受治疗的动物接触水泡性口炎病毒(VSV),这种病毒几乎可以感染所有的哺乳动物,但在人体中主要导致无症状的感染。
实验表明,与未接受抗生素治疗且肠道菌群完好的小鼠相比,接受抗生素治疗且肠道菌群耗尽的小鼠在接触病毒后更易发生主动感染,而且感染后的病情会更加严重。
这一结果证实了肠道微生物在诱导保护性干扰素信号和增强对病毒感染的自然抵抗力方面的作用。
有趣的是,缺少干扰素受体的小鼠无论肠道菌群是否完整,它们之间都没有差异。因此,研究结果表明,共生菌群正是通过干扰素信号来发挥其保护作用的。
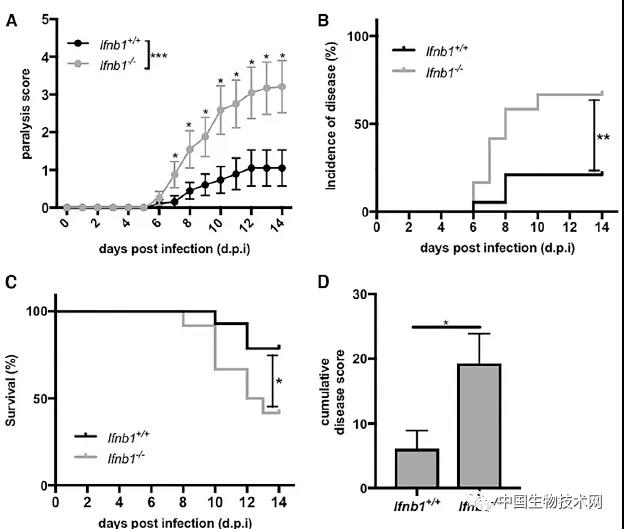
最后,为了研究脆弱拟杆菌表面的分子是否也能调节动物对病毒感染的反应,研究人员在耗尽肠道菌群的小鼠饮用水中添加了一种纯化分子。几天后,当动物暴露于VSV时,那些预先用这种分子治疗的动物感染明显温和,存活率与那些肠道菌群和免疫防御系统完整的小鼠相同。
研究结果表明,在肠道菌群耗尽的动物中,补充这种共生微生物分子足以恢复整个菌群的保护作用。
该研究团队提示,这些结果还需要在进一步的动物实验中得到证实,然后再在人体上进行复制,但这些现提出了一种新的策略,可以帮助增强人类的抗病毒免疫力。
论文链接:
https://doi.org/10.1016/j.cell.2020.10.047