死亡风险降低35%,K药联合化疗获批三阴乳腺癌一线疗法
近日,默沙东(MSD)宣布,凭借KEYNOTE-355优异的临床研究结果,PD-1抑制剂Keytruda(K药)联合化疗,治疗肿瘤表达PD-L1(CPS≥10)的不可切除局部复发性或转移性三阴性乳腺癌(TNBC)患者已获得美国FDA加速批准。该项治疗方案的获批,标志着Keytruda在乳腺癌治疗领域再下一城,为三阴性乳腺癌患者带来新的治疗希望。
挑战不可能,“K药”再续传奇
根据2018年国家癌症中心报告,乳腺癌是女性最常见的癌症,也是癌症死亡的主要原因。乳腺癌分为四个亚型,分别为luminalA型、luminalB型、HER2型和三阴乳腺癌。
三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体(HER-2)均呈阴性的的一种乳腺癌亚型,占比为15%-20%,且病情进展迅速,侵袭性最强,预后极差。
由于“三阴性”的特点,激素治疗药物和HER2靶向疗法均无效。目前,化疗仍然是晚期TNBC主要的系统治疗手段,但疗效欠佳,患者的中位生存时间仍仅为12-25.7个月。因此,三阴性乳腺癌患者迫切需要新的治疗方案打破僵局。
功夫不负有心人,凭借IMpassion130研究的优异数据,阿替利珠单抗被FDA加速批准与白蛋白紫杉醇联合应用于治疗PD-L1阳性的晚期TNBC患者,成为第一款获批乳腺癌的免疫治疗药物(详细内容见链接:总生存期提高7.5个月,免疫联合化疗重塑三阴乳腺癌一线治疗格局)
而文章开头提及的三阴乳腺癌又一款获批免疫药物,就是大名鼎鼎的“K药”。此次批准是基于名为KEYNOTE-355的III期临床试验的结果。
KEYNOTE-355:K药联合化疗将疾病进展和死亡风险降低35%,PFS 9.7个月。
KEYNOTE-355是一项“K药+化疗”对比“安慰剂+化疗”用于初治的局部复发且不可手术或转移性三阴性乳腺癌(mTNBC)的随机、双盲、Ⅲ期研究。研究旨在评估K药联合化疗一线治疗mTNBC的有效性和安全性。研究的主要终点是总体人群和PD-L1阳性人群(CPS ≥10 和 CPS ≥1)的无进展生存期(PFS)和总生存期(OS)。次要研究终点包括:客观缓解率(ORR)、反应持续时间(DOR)、疾病控制率(DCR)。
研究共纳入局部复发不能切除或转移的TNBC患者847例,将患者随机(2:1)分配到K药联合化疗组(K药组 n=566)或安慰剂联合化疗组(安慰剂组 n=281)。化疗药物为紫杉醇、白蛋白结合型紫杉醇(白紫)或吉西他滨和卡铂或相同化疗方案(图1)

研究结果:
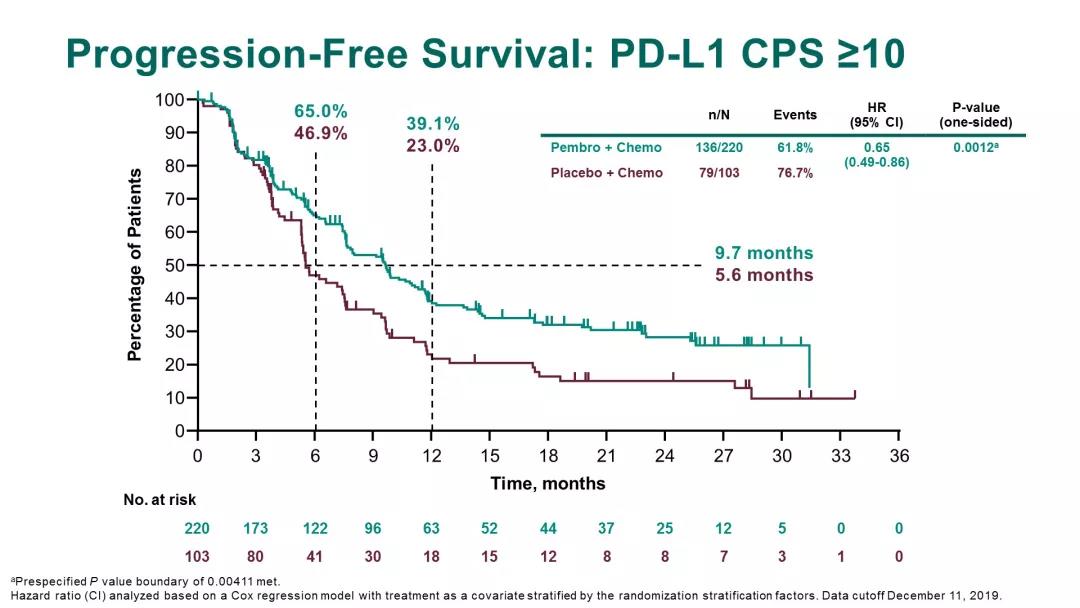
PD-L1(CPS≥10): K药组和安慰剂组共纳入323名肿瘤表达PD-L1(CPS≥10)的TNBC患者。K药组与安慰剂组相比35%。K药组的中位无进展生存期(PFS)为9.7个月,安慰剂组为5.6个月,达到了研究主要终点。
结果表明:K药联合化疗组显著改善患者的无进展生存期,具统计学意义和临床意义。凭借这一数据结果,FDA批准K药联合化疗用于治疗肿瘤表达PD-L1(CPS≥10)的不可切除局部复发性或转移性TNBC。
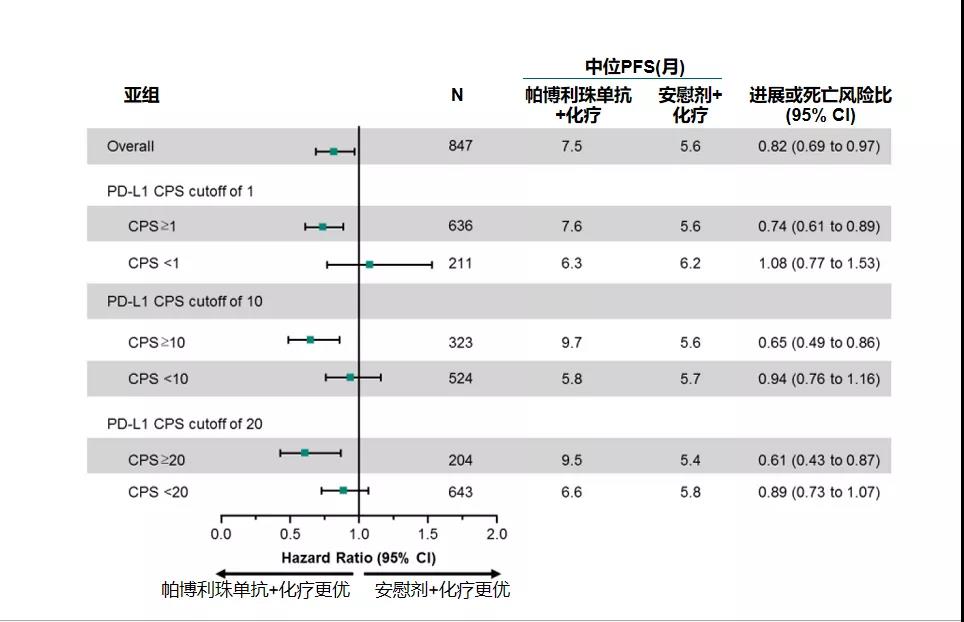
PD-L1(CPS≥1):K药组和安慰剂组中位PFS分别为7.6个月和5.6个月。尽管 K药组的PFS有延长,但未达到统计学差异。同样,在意向人群(ITT)中, K药组和安慰剂组中位PFS分别为7.5个月和5.6个月,但无统计学差异。
但通过对CPS ≥10,CPS ≥1或ITT人群的比较,研究发现K药联合化疗的PFS较安慰剂联合化疗组均有延长。也就是说,K药联合化疗对所有亚组患者均有疗效。
通过CPS的不同界值对比发现,K药联合化疗在CPS ≥20的人群中获益最为显著,其次为CPS ≥10的人群和CPS ≥1的患者。由此可以得出结论,即在PD-L1高表达水平患者中,K药联合化疗的疗效提高趋势明显。
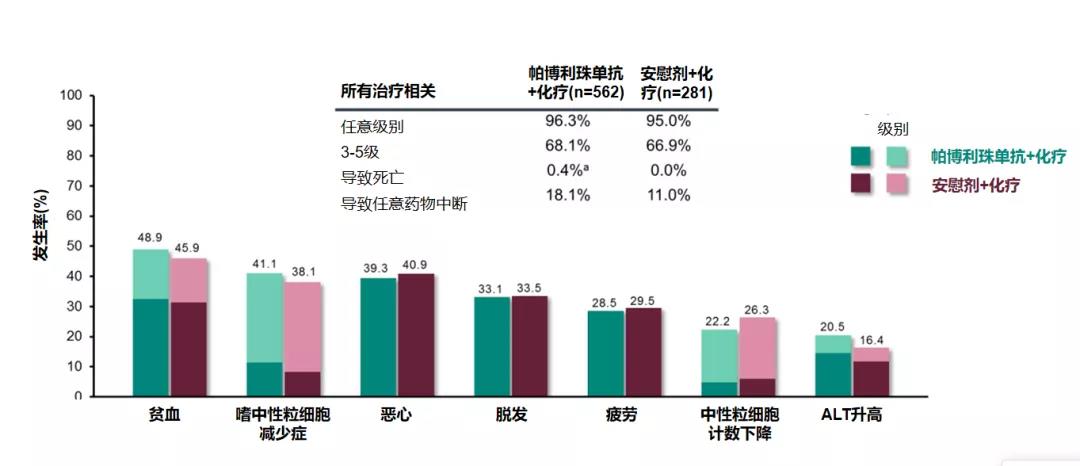
在安全性方面,K药组与安慰机组主要的不良反应事件为贫血、嗜中性粒细胞减少症、恶心等,3-5级治疗不良事件发生率分别为68.1%(2例死亡)和66.9%(0例死亡)。这与既往免疫治疗研究的报道类似。
小结
KEYNOTE-355研究证实了K药联合化疗TNBC的疗效和安全性,说明在一线治疗中,以往标准化疗方案加入K药的重要作用。尤其是对PD-L1(CPS≥10)患者来说,疗效更加显著。同时我们也注意到,K药联合化疗获批的适应症中,化疗方案的广泛性,包括紫杉醇、白蛋白紫杉醇、吉西他滨,卡铂,使研究结果更有代表性,更易在临床上推广,也为医生提供了更多的选择性。
声明:本资料中所涉及的信息仅供参考,请遵循医生或其他医疗卫生专业人士的意见或指导。
参考文献
[1].FDA Approves Merck’s KEYTRUDA®(pembrolizumab) in Combination With Chemotherapy for Patients With Locally Recurrent Unresectable or Metastatic Triple‑Negative Breast Cancer Whose Tumors.Express.PD-L1.(CPS≥10). Retrieved.November.13,2020,fromhttps://www.businesswire.com/news/home/20201113005691/en
[2].https://www.merck.com/news/merck-announces-two-us-regulatory-milestones-for-keytruda-pembrolizumab-in-triple-negative-breast-cancer-tnbc/