邵志敏教授:三阴性乳腺癌精准治疗的探索之路
第十六届全国乳腺癌会议暨第十五届上海国际乳腺癌论坛于10月23日至25日在线上顺利召开。本届会议是一场形式多样、内容丰富、涉及广泛的乳腺肿瘤学术盛宴。会议主题为“疫”起进入精准医学时代。会议期间,复旦大学附属肿瘤医院邵志敏教授分享了三阴性乳腺癌(TNBC)的多组学研究和精准治疗。

邵志敏 教授
首批教育部长江学者特聘教授
复旦大学肿瘤研究所所长、乳腺癌研究所所长
复旦大学附属肿瘤医院大外科主任兼乳腺外科主任
中国抗癌协会乳腺癌专业委员会名誉主委
中华医学会肿瘤学分会副主任委员
上海市抗癌协会乳腺癌专业委员会名誉主任委员
乳腺癌的治疗已经进入了分子分型时代,部分亚型已经找到了有效的治疗靶点。Luminal型占乳腺癌的67%~70%,主要使用抗雌激素内分泌治疗;HER2阳性占乳腺癌的20%~25%,主要使用抗HER2靶向治疗;TNBC占比为15%~20%,化疗是主要的系统治疗手段。
TNBC是临床“难治性乳腺癌”,ER、PR、HER2表达均呈阴性,早期复发风险较高,预后差。目前仍没有明确治疗靶点,主要以化疗为主。
三阴性乳腺癌精准治疗的探索之路
复旦大学附属肿瘤医院邵志敏教授研究团队深耕数年,逐渐在TNBC精准治疗之路上摸索出前进的方向。经历了寻找优选的化疗方案、多组学揭示分子本质、分子分型基础上的精准治疗、优化分型拓展内涵四个阶段。
寻找优选的化疗方案
复旦研究:探索复发/转移性TNBC患者优选方案
由复旦大学附属肿瘤医院胡夕春教授牵头的CBCSG006研究揭示:GP方案(吉西他滨+顺铂)为复发转移性TNBC一线治疗的优先方案,研究结果于2015年发表在《柳叶刀肿瘤学》杂志。CBCSG006研究是一项多中心III期临床试验,256例复发转移性TNBC患者,1:1随机接受GP方案或GT(吉西他滨+紫杉醇)方案。结果显示,与GT方案相比,GP方案的中位无进展生存期(PFS)显著延长,分别为7.73个月和6.47个月(HR=0.692,P=0.009)。
复旦研究:探索TNBC术后辅助治疗方案
由邵志敏教授牵头的CBCSG010研究揭示:卡培他滨加入TNBC辅助治疗可改善预后。研究结果今年发表于《JCO》杂志。CBCSG010研究是一项多中心III期临床研究,585例早期TNBC患者,随机接受辅助TX(卡培他滨+多西他赛)序贯XEC(卡培他滨+表柔比星+环磷酰胺)或T(多西他赛)序贯FEC(氟尿嘧啶+表柔比星+环磷酰胺)方案化疗。结果显示,加用卡培他滨可显著延长无病生存期(DFS),5年DFS率分别为86.26%和80.23%(HR=0.66,P=0.038)。
复旦研究:探索TNBC术后辅助治疗方案
由邵志敏教授和余科达教授团队开展的PATTERN研究显示:紫杉醇+卡铂是可手术TNBC患者可替代的辅助化疗方案。PATTERN研究是一项多中心、随机对照III期临床研究,探索了含铂方案(PCb[紫杉醇+卡铂])与标准化疗方案(CEF[环磷酰胺+表阿霉素+氟尿嘧啶]序贯T[多西他赛])在TNBC辅助治疗中的有效性。
结果显示,中位随访62个月时,与CEF-T组相比,PCb组5年DFS率绝对获益为6.4%,两组分别为86.5%和80.3%(HR=0.65,P=0.03)。PCb组的5年无复发生存率(RFS)明显高于CEF-T组,分别为91.2%和84.4%(HR=0.54,P=0.01)。两组的5年无远处疾病生存率(DDFS)分别为92.6%和87.9%(HR=0.59,P=0.05)。探索性分析显示,同源重组修复(HRR)缺陷TNBC患者中,PCb组的DFS显著更优(88.4% vs 76.3%,HR=0.39,P=0.04)。相比之下,非携带者中,两治疗组的DFS无明显差异(85.9% vs 81.2%,HR= 0.70,P =0.15)。
PATTERN临床试验首次报道卡铂在TNBC辅助治疗中的有效地位,在总人群和同源重组修复缺陷亚组人群中,PCb组的疗效均显著优于CEF-T组。
多组学揭示分子本质
邵志敏教授团队通过利用TNBC多组学研究(转录组、基因组、蛋白组、代谢组、影像组和病理组),进行分子分型、靶点挖掘、机制探索更细化的探索,以期实现分子分型基础上的精准治疗。
早期的研究主要集中在TNBC转录组分型,通过相关研究初步建立了分型系统,揭示了TNBC非常强的异质性,并探索了亚型特征。2016年发表的研究揭示了各分子亚型特异性高表达分子标志物及潜在靶点。
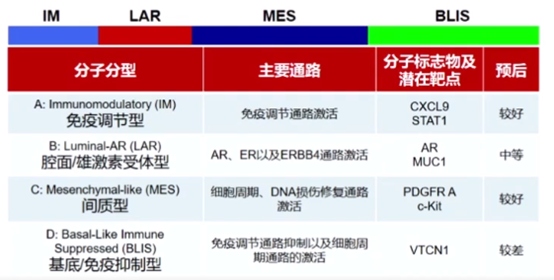
同时,利用全转录组数据构建了首个包含mRNA和lncRNA的TNBC复发风险模型。基于全转录组数据,研究者构建了TNBC预后预测模型,区分了术后高危、低危复发风险组。
基于模型开展前瞻性临床试验
转录组单层面研究具有局限性,亚型特异性分子标志物无法直接靶向。研究者假设术后TNBC高危患者可能从更高强度的化疗(含铂类)中获益,通过“TNBC预后预测模型”识别的高危患者将接受更高强度的化疗,通过对比高低危组中同样方案患者预后转归,最后对模型的预后判别能力进行评估。预计研究结果将于2021年公布。
中国人群TNBC精准治疗的基础
大概5年前,邵志敏研究团队从转录组和基因组两个层面深入探索了TNBC的分子分型。相关结果对于临床试验有一定的借鉴意义,结果于2019年发表在《Cancer Cell》杂志。
研究者进一步建立了全球最大的单中心TNBC多组学队列(n=465,基因组+转录组)。结果显示,在TNBC基因组变异图谱中(体细胞突变+胚系突变),中国人群富集RAD51D新型胚系突变,提示了特殊的发病机制和对铂类及PARP抑制剂的敏感性,同时提示了中国人群基因图谱与欧美人群存在着较大差异。研究结果今年发表在《JNCI》。
研究证实了表达谱四分型为最优分型方法,揭示了TNBC各亚型对应的分子靶标,建立分子分型基础上的精准治疗策略。
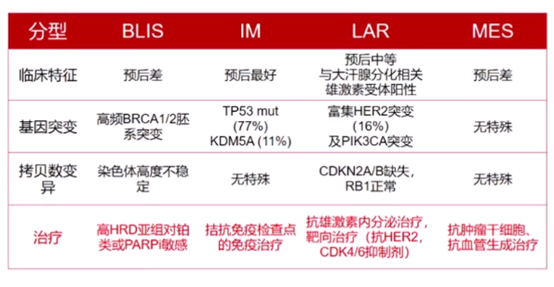
分子分型基础上的精准治疗
TNBC精准治疗的未来模式为分类治疗与精准治疗齐头并进:分型基础上的精准治疗。
TNBC分子分型的简化和临床推广
通过免疫组化实现临床实用分型方法,临床上用AR、CD8、FOXC1、DCLK1四个免疫组化指标将TNBC分为四个亚型,免疫组化分型与表达谱分型高度吻合(符合度76.7%),符合度数值与HER2+、Luminal型乳腺癌分型结果相当,因此可用于临床实践。
FUTURE研究(FUSCC-TNBC-Umbrella)
研究纳入多线治疗失败后的局部晚期或复发性转移性TNBC,取新鲜组织病理标本,同时进行多基因精准PANEL和病理免疫组化检测,将TNBC分为LAR、IM、BLIS、MES四个亚型,根据相关靶点设置7个治疗组。
初步结果显示,69例患者纳入FUTURE试验,ITT人群的客观缓解率(ORR)达到29%,高于常规化疗(10%~15%)。在IM型(C组)患者中,ORR达到52.6%,大部分患者疗效持续时间较长。BLIS型(E组)患者中,ORR达到26.1%,疗效异质性较强,且最终多发生进展。A、F、G组入组人数较少,但已显示出不错的疗效,等待继续入组。B组和D组疗效不佳,几乎所有患者均在首次评估时进展。相关结果今年发表在《Cell Research》杂志。
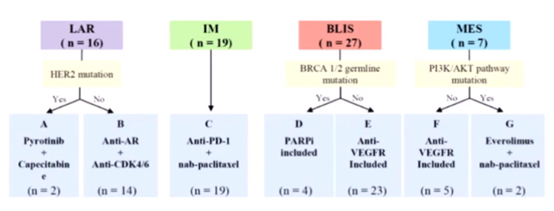
TNBC分子分型基础上精准治疗的新模式改善了患者预后,基于基因组和转录组的研究体系并未解决TNBC治疗的所有问题,如LAR和BLIS亚型疗效不佳。因此,需增加组学层次,寻找新的切入点。
优化分型拓展内涵
邵志敏研究团队通过更丰富的组学维度(蛋白组、代谢组、影像组和病理组),优化TNBC复旦分型体系、探索基因-蛋白/代谢产物关联、攻关LAR和BLIS亚型治疗靶点。
TNBC蛋白/磷酸化蛋白组学分型
研究者建立了全球最大的单中心TNBC蛋白组学队列(n=90),将TNBC分为四个蛋白亚型,与转录组分型有一定吻合。蛋白2型对应转录组LAR亚型,预后较差;蛋白3型对应转录组IM蛋白亚型,预后较好。研究发现,LAR亚型/蛋白2型中,AR下游分子FASN在肿瘤组织中特异高表达,初步结果提示,FASN抑制剂可以成为LAR亚型/蛋白2型的治疗方案。
同时,建立了全球最大的肿瘤代谢组学队列(n=330)。TNBC代谢全景图显示,TNBC存在糖基化代谢物、脂质代谢物的显著富集,从转录组和代谢组两个角度进行分析,均发现TNBC的代谢特征存在显著异质性,且可以被分为3个不同的代谢亚型。因此,TNBC代谢分型进一步优化了mRNA四分型:TNBC mRNA四分型与代谢亚型相关,LAR型以脂质代谢物(尤其神经酰胺类)富集和脂质代谢通路活跃为主,BLIS型内部存在代谢异质性,多数BLIS型氧化和基因转运以及糖酵解通路明显活跃。
TNBC代谢治疗策略
以能量代谢为切入点探索治疗策略,LAR和BLIS亚型对脂代谢和糖代谢的依赖程度不同。对于LAR亚型肿瘤,靶向脂肪酸内源性合成;对于BLIS亚型肿瘤,靶向糖酵解通路,且靶向乳酸脱氢酶能增加免疫治疗疗效。研究结果今年发表于《Cell Metabolism》杂志。
总结
TNBC是“难治性乳腺癌”,其本质是一群混合型乳腺癌。基于基因组和转录组研究提出的分子分型基础上的精准治疗是TNBC乳腺癌治疗的模式,但仍有改进空间。丰富组学层次,拓展TNBC精准治疗的内涵是未来发展方向。