再给患者一次选择机会 赫赛汀是这样帮他实现23个月PFS的
病例介绍
患者初诊信息:
杨某某,男,63,因“上腹部隐痛半个月”于2017年06月06日入院。伴恶心、呕吐,呕吐胃内容物后症状好转。无呕血、黑便等不适。患病以来体重无明显增减。
查体:神清。腹软,上腹部剑突下轻压痛。体重:64Kg。体重指数(BMI):24.69kg/㎡。营养风险评分NRS-2002:1分。
个人史:患者既往体健。吸烟史30年,约10~20支/日,2年前已戒烟;偶有少量饮酒。否认家族病史。
外院胃镜(2017.05):胃底见一隆起凹陷性病变,约2.0cm,表面覆污苔,边缘结节状隆起,糜烂。
胃镜病理:(胃底)腺癌,HP-;
免疫组化:HER2(2+)。
常规检验及肿瘤标志物:无异常。
全腹部CT增强扫描(2017.06.08):胃底壁增厚,增强后均匀中度强化,大小范围约20*19mm;伴膈下区一枚肿大淋巴结,大小约10.4*15.4mm。左侧肾上腺增生首先考虑;后腹膜多发小淋巴结。
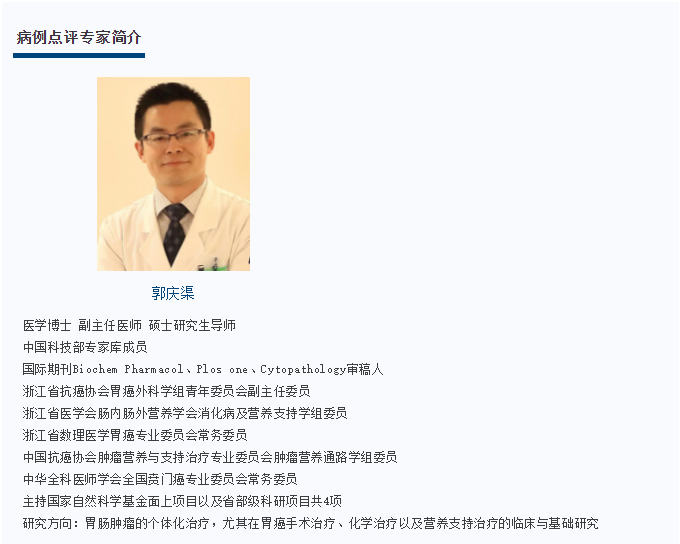
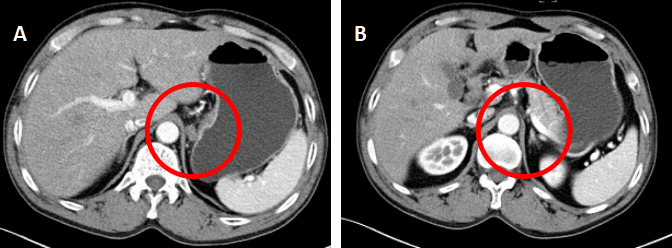 图1. 代表性术前CT图像。
图1. 代表性术前CT图像。
A:术前CT增强(2017.06.08)示胃底部病灶及膈下淋巴结肿大;B:左侧肾上腺增生首先考虑;后腹膜多发小淋巴结。
诊断:胃癌(cT3N1M0,cⅢ期)
诊疗经过
一、初诊治疗
1、手术治疗:
患者于2017.06.13全麻下开腹行“胃癌根治术(全胃切除+D2淋巴结清扫+食管空肠Roux-en-Y吻合)+空肠营养管置入术”。
术中所见:腹腔内无明显积液。肝脏、胆囊、脾脏、横结肠、腹壁及盆腔均未见明显转移灶,肝脏表面光滑。肿瘤位于胃底部大弯侧,范围约3*3cm大小,呈Borrmann Ⅲ型,质硬,尚未浸润至浆膜外,胃小弯可及多发质软的小淋巴结。
术后恢复:顺利,术后10日出院。
术后病理:(全胃+大网膜切除标本)胃底后壁,低分化腺癌,Lauren分型:弥漫型。Borrmann Ⅲ型,溃疡型,大小1.8*1.5cm,浸润至深肌层。脉管侵犯阳性,神经侵犯阴性。上、下切缘均阴性。
淋巴结转移阴性(第1组淋巴结)0/11阳性(第2组淋巴结)0/1阳性(第3组淋巴结)0/1阳性(第4组淋巴结)0/2阳性(第5组淋巴结)0/2阳性(第6组淋巴结)0/6阳性(第7、8、9组淋巴结)0/11阳性。
免疫组化结果:c-erbB-2(GC) 3+,阳性;c-Met +,EGFR -,EMA +,E-Cadherin +++,P53 ++,p16 ++,Ki-67 70%,Muc-2 -,Muc-6 -,SDHB +。
术后病理分期:pT2N0,pIB期。
2、术后辅助化疗:
2017.07.27行术后第1次SOX方案化疗(奥沙利铂 200mg 静滴 D1 + 替吉奥 50mg 口服BID D1-D14,3周方案)。
患者因个人原因,未遵嘱完成后续化疗。
二、肿瘤复发转移
1、随访检查
(1)全腹部CT增强扫描(2018.04.13):膈下新发淋巴结转移。
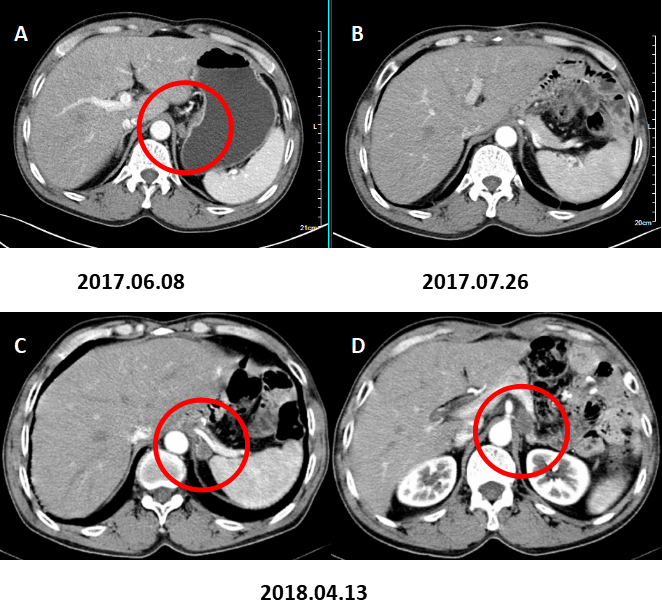 图2. 代表性CT图片提示膈下新发淋巴结转移。
图2. 代表性CT图片提示膈下新发淋巴结转移。
A:术前CT增强(2017.06.08)示膈下淋巴结肿大;B:术后CT增强复查(2017.07.26)示膈下未见肿大淋巴结;C、D:术后CT增强复查(2018.04.13)示左侧膈肌后下方2枚新发淋巴结转移。
肿瘤标志物等未见特殊异常。
患方决定继续观察随访。
(2)全腹部CT增强扫描(2018.07.16):膈下淋巴结转移。左侧肾上腺区及腹膜后多发肿大淋巴结,转移考虑,较前片(2018.04.13)增多增大。肝内多发转移瘤。
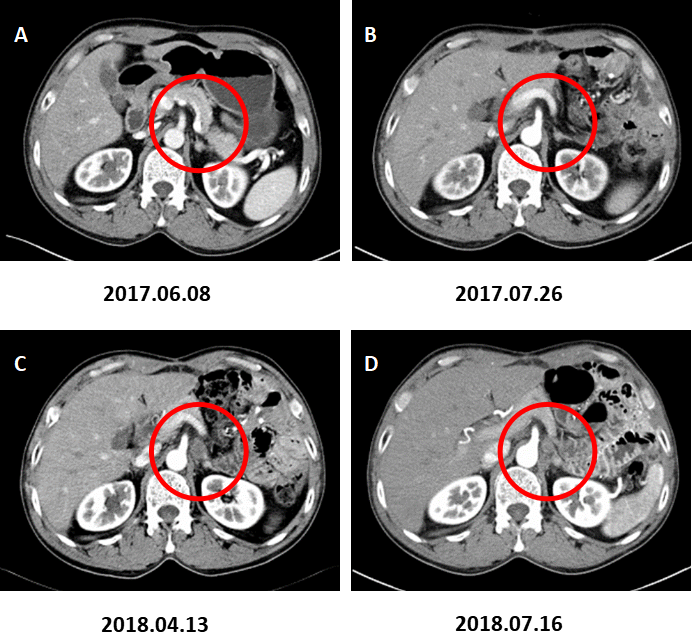
图3. 膈下淋巴结转移。
A:术前CT增强(2017.06.08)B:术后CT增强复查(2017.07.26)示膈肌脚处未见肿大淋巴结;C:术后CT增强复查(2018.04.13)示左侧膈肌脚处新发肿大淋巴结。D:术后CT增强复查(2018.07.16)示左侧膈肌脚处肿大淋巴结与C相仿。
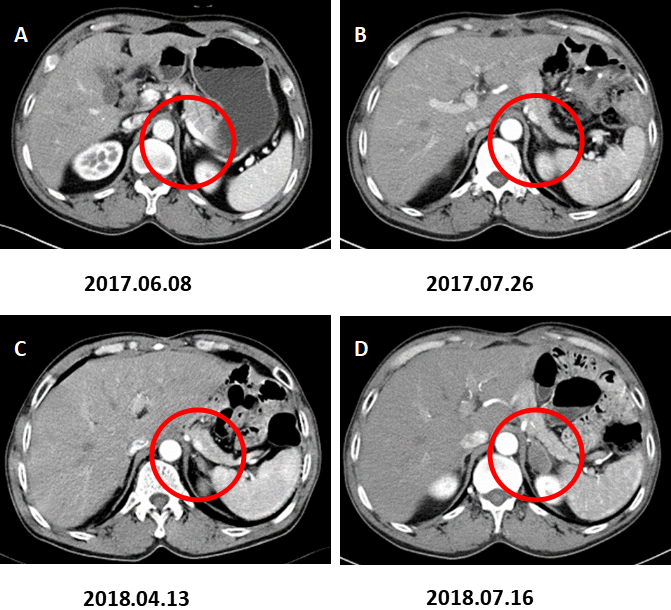 图4. 左肾上腺转移。
图4. 左肾上腺转移。
A:术前CT增强(2017.06.08)、B:术后CT增强(2017.07.26)、C:术后CT增强(2018.04.13)示左肾上腺增粗,增生考虑。D:术后CT增强复查(2018.07.16)示左肾上腺结节,约2.8×1.8cm,增强后不均匀强化,转移考虑。
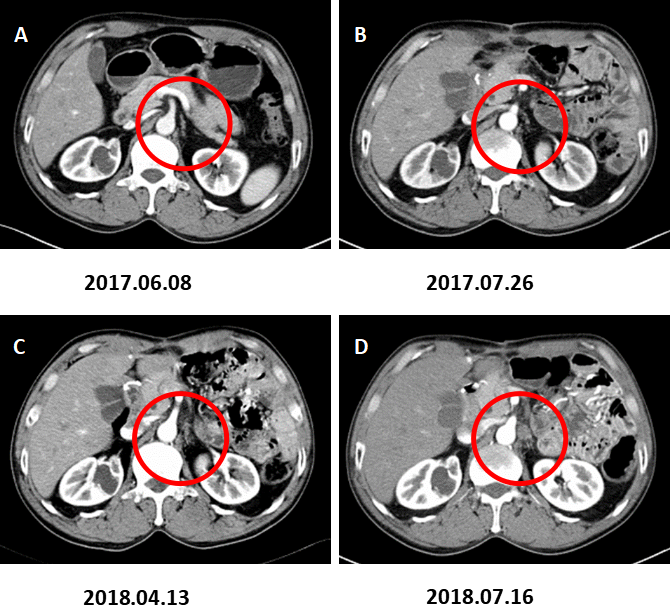 图5. 腹膜后淋巴结转移。
图5. 腹膜后淋巴结转移。
A:术前CT增强(2017.06.08)B:术后CT增强(2017.07.26)、C:术后CT增强(2018.04.13)示腹膜后小淋巴结。D:术后CT增强复查(2018.07.16)示腹膜后多发肿大淋巴结,转移考虑。
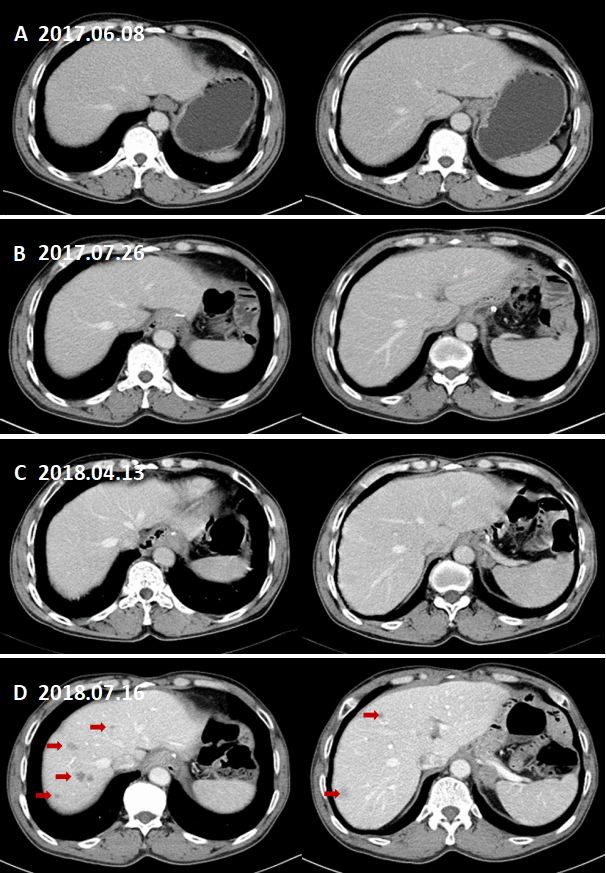 图6. 肝脏多发转移。
图6. 肝脏多发转移。
术前CT增强A(2017.06.08),术后CT增强B(2017.07.26)、C(2018.04.13)未见肝脏转移。D:术后CT增强复查(2018.07.16)示肝脏多发转移灶。
2、MDT讨论
该患者胃腺癌术后复发,CT提示多处淋巴结转移,左肾上腺转移,肝脏多发转移。肿瘤标志物未见特殊异常。考虑为晚期转移性胃癌,不具备手术切除指征。拟采取以全身药物治疗为主的综合治疗。
患者手术标本病理提示C-erbB-2(GC)3+阳性。一线治疗建议曲妥珠单抗联合化疗。
3、化疗
(1)治疗方案
患者因经济原因,拒绝使用曲妥珠单抗靶向治疗。
遂于2018.07.19,2018.08.11,2018.09.10,2018.10.05 行4次PX方案化疗(紫杉醇 210mg 静滴 D1 + 卡培他滨 1.5g 口服 BID D1-D14,3周方案)
(2)治疗后复查
全腹部CT增强扫描(2018.11.03):前片所示肝内多发低密度灶未见明显显示。左侧肾上腺区及腹膜后多发肿大淋巴结,转移考虑,较前片增多增大。
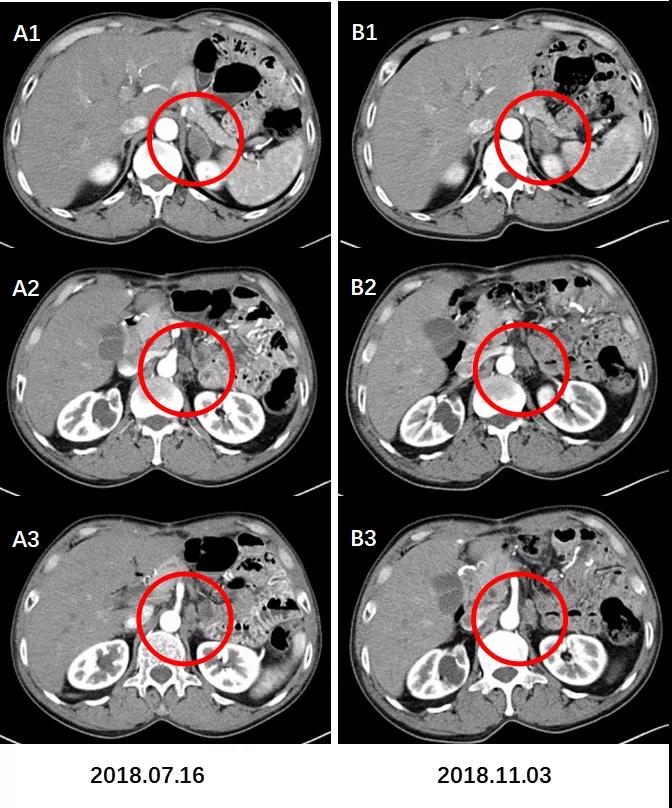
图7. 肝脏转移灶基本消退。
A:术后CT增强(2018.07.16)示肝脏多发转移灶。B:术后CT增强(2018.11.03)示肝脏转移灶基本消退。
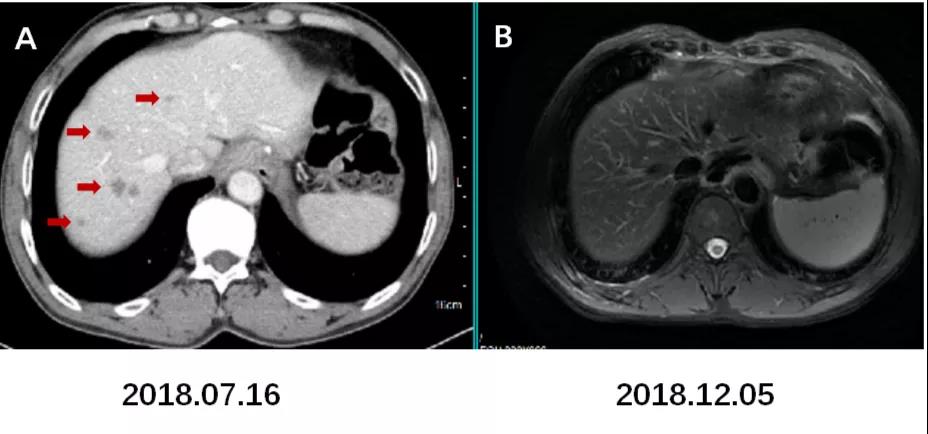
图8. 左肾上腺区,膈下及腹膜后淋巴结较前增大增多。
术后CT增强(2018.11.03)B1示左肾上腺区转移灶较前片(2018.07.16)。A1略增大;B2,B3示膈下及腹膜后淋巴结转移较A2,A3增大增多。
(3)疗效评价:PD。
4、化疗联合曲妥珠单抗靶向治疗
(1)治疗方案
再次与患方交代病情后,患方决定采纳原MDT讨论建议,接受化疗联合曲妥珠单抗靶向治疗。
遂于2018.11.06、2018.12.04 行2次PX方案化疗联合曲妥珠单抗靶向治疗,3周方案。
并于2018.12.28、2019.01.18、2019.02.11、2019.03.09行4次卡培他滨 1.5g 口服 BID D1-D14 + 曲妥珠单抗靶向治疗,3周方案。
(2)治疗后复查
肝脏磁共振增强扫描(2018.12.05):原增强CT提示肝脏转移瘤区域未见明显病灶。
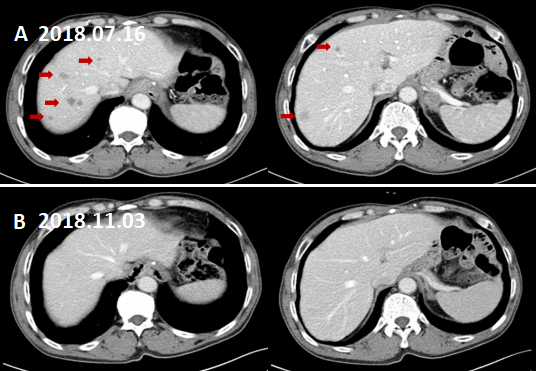 strong>图9. 肝脏转移灶未见复发。
strong>图9. 肝脏转移灶未见复发。
A:术后CT增强(2018.07.16)示肝脏多发转移灶。B:术后MRI增强(2018.12.05)示肝脏转移灶消退后未见明显复发病灶。
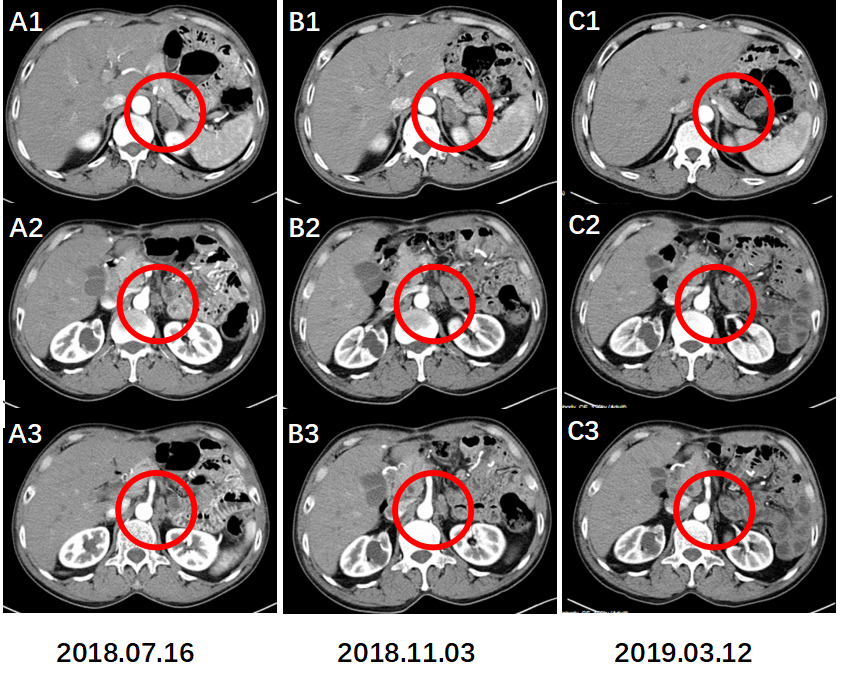 图10. 左肾上腺区、膈下及腹膜后淋巴结较前退缩。
图10. 左肾上腺区、膈下及腹膜后淋巴结较前退缩。
术后CT增强C1(2019.03.12)示左肾上腺区转移灶较前片A1(2018.07.16)以及B1(2018.11.03)明显退缩;C2,C3示膈下及腹膜后淋巴结前片也明显退缩。影像评估CR。
(3)疗效评价:CR。
5、化疗联合曲妥珠单抗维持治疗:
(1)治疗方案
患者于2019.04.08~2020.08.10行20次卡培他滨 1.5g 口服 BID D1-D14+曲妥珠单抗治疗,3周方案。
于2020.09.06行1次曲妥珠单抗单药治疗,3周方案。
治疗后复查:未见复发迹象。
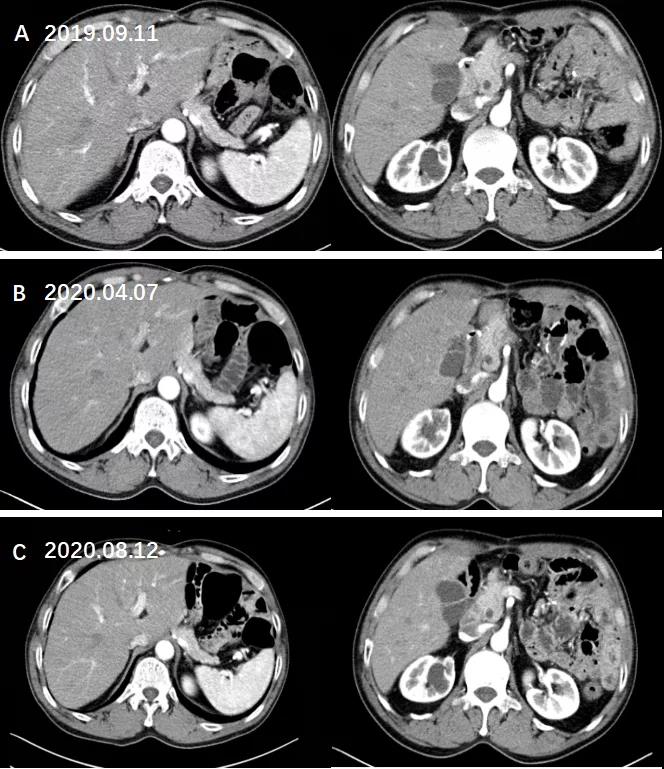
图11. 复查腹部CT增强未见复发迹象。
诊疗概览

专家点评
本例患者术后因自身原因未能进行规范化术后辅助治疗,术后一年复发,给与紫杉醇+希罗达(XP方案)治疗后部分转移灶消退,而部分转移灶进展,进而XP联合曲妥珠单抗治疗后转移灶临床完全缓解,在此基础上口服希罗达联合曲妥珠单抗维持治疗,无疾病进展生存期(PFS)维持23个月,是一个应用靶向药物曲妥珠单抗成功治疗胃癌患者的典型病例。
晚期胃癌的自然生存期是6-8个月,而化疗药物的开始应用将晚期胃癌的生存时间提高到10-12个月,2010年TOGA研究显示,与标准化疗(顺铂+氟尿嘧啶)相比,曲妥珠单抗联合化疗可使总生存期显著延长(11.8个月vs 16个月,P=0.0046),将胃癌常规化疗引导向胃癌靶向治疗时代,也奠定了曲妥珠单抗在HER2阳性晚期胃癌一线治疗中的地位。因此,2012年中国批准曲妥珠单抗用于HER2阳性晚期胃癌。随后一些Ⅱ期研究探讨其他化疗方案与曲妥珠单抗联合的疗效,结果显示其他化疗方案如卡培他滨+奥沙利铂、奥沙利铂+替吉奥(S-1),均可获得与TOGA研究相似或更好的的总生存期。但HER2的表达异质性较强,需要多次,不同部位进行活检检测,减少假阴性的的发生,尽可能给这些晚期病人予以更多的治疗选择。
曲妥珠单抗的维持治疗没有相关报导,但德国一项曲妥珠单抗治疗晚期胃癌的回顾性分析显示真实世界的研究结果和TOGA研究结果相似,再次证实曲妥珠单抗的疗效,但在此回顾性资料中,曲妥珠单抗治疗的平均时间是5.9个月,有23.6%病人维持曲妥珠单抗治疗12个月。从本例病人来看,二线治疗后局部病灶进展,而联合应用曲妥珠单抗后,进展病灶明显消退,随后病人维持曲妥珠单抗治疗近23个月,无疾病生存期达19个月,治疗期间病人没有出现严重不良反应。
总之,曲妥珠单抗联合化疗是HER2阳性晚期胃癌的标准一线治疗推荐方案,病人应常规进行多次多点检测。提高HER2的阳性检测率。曲妥珠单抗的维持治疗是否可以延长生存期,以及曲妥珠单抗是否可以跨线应用,期待后续的研究。