喜大普奔 肺癌罕见突变基因有药可用 国产新靶向药重磅来袭!
2020年10月15日,上海-武田中国宣布,其在研创新药物Mobocertinib(TAK-788)被国家药品监督管理局药品审评中心(CDE)批准纳入“突破性治疗药物品种”,用于治疗既往至少接受过一次全身化疗的携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
非小细胞肺癌(NSCLC)是最常见的肺癌类型之一,据世界卫生组织(WHO)统计,全球每年新增约180万肺癌病例,其中NSCLC约占85%左右。EGFR 20号外显子插入突变是非小细胞肺癌的一种罕见突变,约占所有NSCLC的 2.1%。在中国,EGFR 20号外显子插入突变发生率约占所有NSCLC的2.3%。目前,全球范围内尚未批准任何针对EGFR 20号外显子靶点的治疗药物,同时,现有的EGFR-TKI、化疗和免疫疗法对于携带EGFR 20号外显子插入突变的NSCLC患者临床获益有限,患者饱受疾病困扰,具有迫切的临床治疗需求。
无癌家园的专家分析道,从Mobocertinib目前的研究数据来看,其有望为携带EGFR 20号外显子插入突变NSCLC患者带来明显获益,衷心希望纳入突破性治疗药物品种后能有助Mobocertinib更早地惠及中国患者。
今天小编就给大家介绍下这款我国自主研发的抗肿瘤新药Mobocertinib的相关临床研究。
新药Mobocertinib用于NSCLC EGFR 20ins突变疗效突出
Mobocertinib(TAK-788,曾用代号AP32788)是武田制药研发的一款小分子EGFR/HER2抑制剂,日前美国FDA已授予突破性疗法认定(BTD)药物资格。2020年4月28日,AACR年会报道了1/2期临床试验的结果。
Mobocertinib基于奥希替尼的骨架核心改进,大大提高了对EGFR 20外显子插入突变的活性,28例可供评估的EGFR 20外显子插入突变经治NSCLC患者,客观缓解率(ORR)为43%,中位无进展生存期为7.3个月。
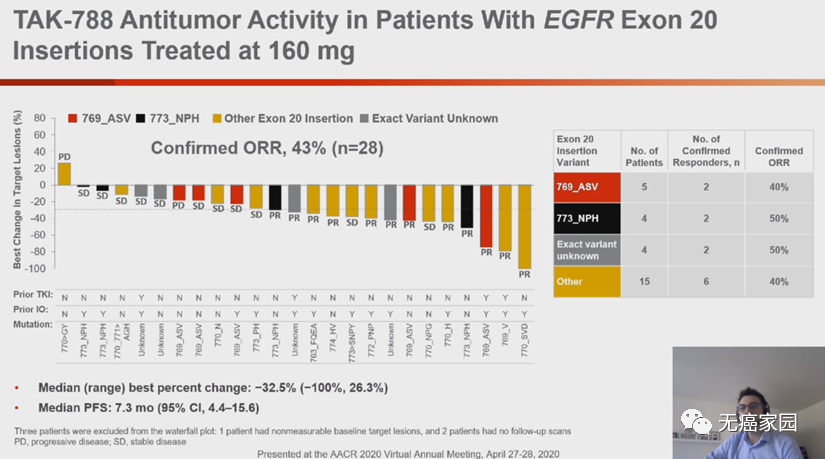
Mobocertinib 160mg每天一次剂量组的多数不良反应为1~2级,常见的不良反应有腹泻、恶心、皮疹、呕吐、食欲下降等。
目前,Mobocertinib对比培美曲塞联合铂类一线治疗EGFR 20外显子插入突变复发性或晚期NSCLC患者的三期临床试验(NCT04129502)已经开展(美国4个临床点,西班牙1个)。
针对EGFR 20ins突变非小细胞肺癌的药物还有JNJ-6372,我们敬请期待这两种药物能够尽快上市,造福更多的癌友!
疾病控制率100%,我国自主研发广谱新药JMT-101重磅登场!临床招募进行中
非常振奋人心的是,2019年,我国自主研发的、专门针对EGFR ex20in患者的新药JMT-101已经获得批准投入临床试验!并且在2020年ASCO线上会议中,首次公布了这款药物治疗晚期结直肠癌患者的试验结果,疾病控制率达到100%,引起轰动。
好消息是,目前JMT-101治疗多种实体瘤的Ⅰ期临床试验已经陆续开始。其中,治疗非小细胞肺癌的Ⅰb期试验正在招募患者,若想参加临床试验请咨询无癌家园医学部(400-626-9916)。
肺癌精准治疗,基因检测先行
小编给大家介绍完我国自主研发的抗癌新药后,大家不禁会想,靶向药既然这么好,那是否能够人人都适用呢?其实并非如此!这是因为不同患者携带的突变基因存在差异,因此用药前应该通过基因检测。基因检测能够帮助肿瘤医生针对不同分子变异类型的患者,选择适合他们的治疗方案,从而实行靶向药物治疗。
肺癌可以分为小细胞肺癌和非小细胞肺癌,非小细胞癌又分为腺癌、鳞癌、腺鳞癌和大细胞癌,其中腺癌占主导地位,其次是鳞癌,而小细胞癌不到15%。
临床对于肺腺癌研究的比较多,发病机制研究比较清楚,导致肺腺癌突变的驱动基因突变70%~80%已被发现。在亚洲人群里面,最常见的是EGRF突变,其次是ALK、ROS1、KRAS等。肺腺癌的国内外治疗指南里面都强调了要做基因检测。此外,“无检测,不治疗”已经成为肺癌专科医师“必需”的诊疗行为,这无疑更强调了做基因检测的重要性!
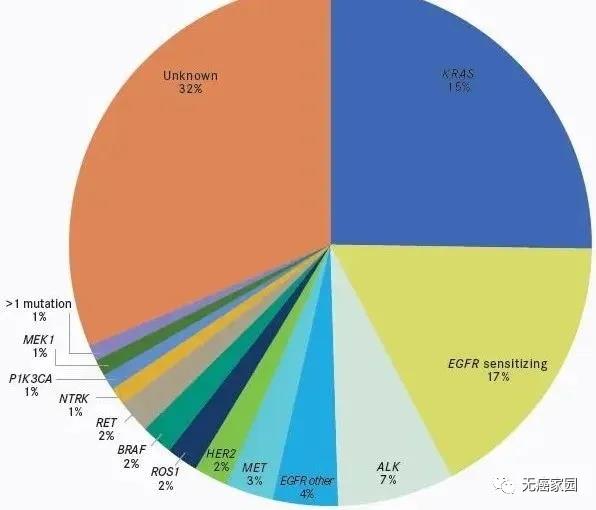
对肺鳞癌来说,如果是活检小标本,不吸烟女性的肺鳞癌主张做基因检测,如果是吸烟的男性鳞癌,则指南不推荐做基因检测。
参考文献
https://www.prnasia.com/story/294947-1.shtml
https://www.takeda.com/newsroom/newsreleases/2020/takeda-announces-u.s.-fda-breakthrough-therapy-designation-for-mobocertinib-tak-788-for-the-treatment-of-nsclc-patients-with-egfr-exon-20-insertion-mutations/
https://www.targetedonc.com/view/fda-grants-breakthrough-designation-to-mobocertinib-for-egfr-exon-20-nsclc