抗癌神药奥希替尼耐药后无药可用? NO!最全最详细应付对策来袭!
肺癌是全球发病率最高及死亡率最高的恶性肿瘤,发病率和死亡率分别占全部肿瘤的11.6%和18.4%。其中非小细胞肺癌(NSCLC)患者约占85%,晚期患者既往5年生存率约为5%。
铂类化学疗法一直是晚期非小细胞肺癌的标准一线治疗方案。但是,化学疗法的毒性和副作用会影响患者的身体健康和生活质量,而且治疗效果有限,在过去十年内没有很大的发展。随着医学技术不断进步,肺癌靶向治疗的出现,突破了肺癌治疗的瓶颈。
奥希替尼一线成王,生存优势显著
EGFR突变型肺癌人群是晚期肺癌中最幸运的一类患者,目前研发的一、二、三代TKI靶向药的口服治疗可让患者获得长期高质量生存,是目前肿瘤精准治疗的典范。特别是伴随2017年奥希替尼在国内上市,更让其生存优势提高到新的高度。
在使用靶向药治疗肺癌患者的过程中,基本上是顺序用药,先使用一代靶向药物(厄洛替尼、吉非替尼、埃克替尼)或者二代靶向药物(阿法替尼、达可替尼),然后再根据基因变异情况决定是使用第三代靶向药物奥希替尼还是化疗方案,这也是大部分医生采用的治疗策略。
作为EGFR第三代靶向药奥希替尼(Osimertinib,AZD9291),初治首选可达到18.9个月,而一代靶向药厄洛替尼或吉非替尼组为10.2个月。

基于此项研究结果,2018年4月,美国FDA批准奥希替尼用于EGFR突变非小细胞肺癌的一线治疗,通俗点讲,若是肺癌患者携带EGFR突变,无论是否存在T790M,都可以根据自身情况选择是否直接使用奥希替尼进行治疗。
而在2019年8月31日,中国国家药品监督管理局正式批准奥希替尼用于EGFR突变的晚期非小细胞肺癌的一线治疗。
目前奥希替尼已被肺癌患者广泛使用,不过随着适用人群的增加,各位癌友不禁担忧,奥希替尼已经是第三代靶向药,而四代靶向药尚未获批上市,那么奥希替尼一线治疗后发生耐药怎么办?
奥希替尼耐药后先做基因检测疗效更佳
奥希替尼耐药的患者到底使用什么治疗方案,其实是因人而异的,与其随便盲目采用一个方案,不如先做基因检测。这是因为奥希替尼的耐药机制个体差异大,而NGS(二代测序)可以检测大量未知基因变异,有助于找到奥希替尼耐药的机制,以便于对症下药。
一项回顾性研究显示,肺癌患者在奥希替尼耐药后进行NGS基因检测的患者中位无进展生存期为5.4个月,显著长于无NGS检测患者的2.9个月。而在NGS检测的患者进行靶向治疗,未NGS检测的患者接受化疗或最佳支持治疗后,前者的客观缓解率明显高于无NGS检测的患者(16.2% vs 11.1%)。这说明进行NGS检测的患者治疗效果更佳。
奥希替尼耐药机制大起底,切记对症下药
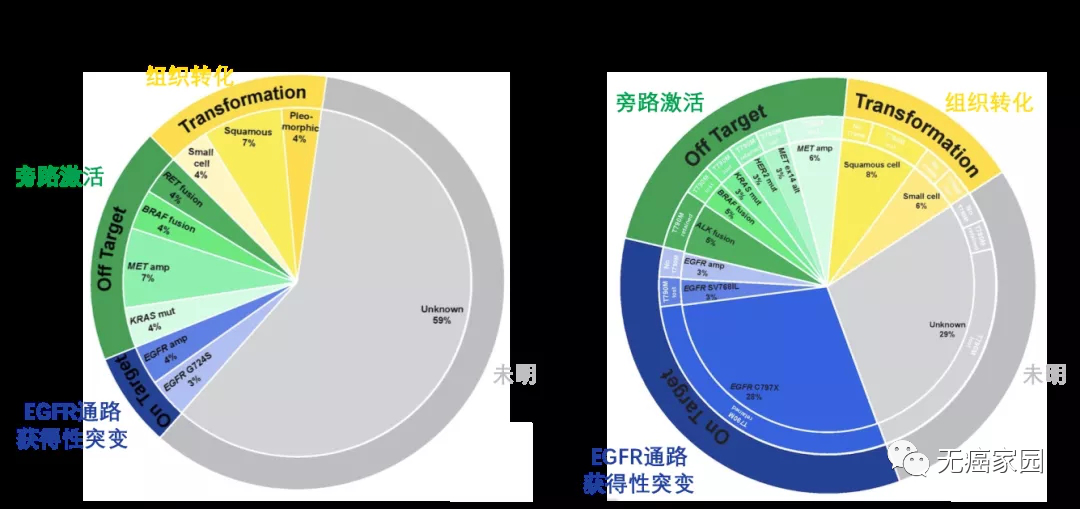
目前对于奥希替尼治疗耐药可大致分为4类,包括EGFR通路突变、旁路激活、组织学转化以及原因未明耐药机制。由于存在组织学转化的患者,因此奥希替尼耐药后如果有条件可做病理检测。
值得注意的是,今年ASCO发表一项研究首次展示了基于组织检测的一线及二线奥希替尼耐药机制对比,一线奥希替尼相比二线奥希替尼存在更多未明耐药机制,而二线耐药后具有更高EGFR通路获得性耐药。
一线和二线奥希替尼耐药机制差异
1 EGFR通路获得性耐药
1·C797位点突变
C797位点突变是最早发现的奥希替尼耐药机制之一,作为不可逆EGFR-TKI共价结合位点,该位点突变会影响不可逆EGFR-TKI与对应蛋白区域结合,因此对于单纯以C797位点突变介导的耐药可尝试应用单药一代可逆EGFR-TKI,目前临床观察到的C797X耐药突变发生率可高达28%。
2 ·C797S介导耐药
针对C797S介导耐药已有部分正在开展的相关临床研究探讨基于联合治疗模式克服奥希替尼耐药,包括Ⅰ期联合特异性双抗JNJ-372,联合Necitumumab单抗研究以及一项联合HER3抗体偶联药物U3-1402研究,除此以外ORCHARD研究也进一步探讨了奥希替尼联合吉非替尼(Gefitinib)治疗C797S获得性耐药可行性。
3
T790M合并C797S耐药突变
对于临床中出现T790M合并C797S耐药突变,临床前研究及相关病例报道显示联合布加替尼(Brigatinib)及EGFR单抗[西妥昔单抗(Cetuximab)或帕尼单抗(Panitumumab)]可有效克服这类耐药机制。
对于EGFR敏感突变合并T790M及C797S,临床前数据显示奥希替尼联合EGFR别构抑制剂具有一定疗效,此外基于四代EGFR-TKI BBT-176的Ⅰ/Ⅱ期临床研究也即将准备开展。目前对于耐药后无法进入临床研究的患者,建议进行标准化疗。
疾病控制率100%,我国自主研发广谱新药JMT-101重磅登场!临床招募进行中
EGFR是肺癌最常见的突变类型,但在这类突变中,有一类比较罕见的突变亚型-EGFR 20号外显子插入突变,对于各类EGFR-TKI药物均不敏感,患者治疗难度很大。
非常振奋人心的是,2019年,我国自主研发的、专门针对EGFR ex20in患者的新药JMT-101已经获得批准投入临床试验!并且在2020年ASCO线上会议中,首次公布了这款药物治疗晚期结直肠癌患者的试验结果,疾病控制率达到100%,引起轰动。。
2
获得性MET扩增
MET扩增耐药在奥希替尼治疗进展后患者中占到10%~24%,目前评估MET扩增主要依靠NGS(二次测序)基因检测或FISH检测。TATTON研究显示奥希替尼联合MET抑制剂在EGFR-TKI治疗进展后患者中的ORR为30%,中位持续缓解时间7.9个月,此外在SAVANNAH和ORCHARD研究中也有相应联合MET抑制剂队列正在开展。
既往一些研究也报道了奥希替尼联合克唑替尼(Crizotinib)在获得性MET扩增及MET 14外显子跳跃突变患者临床可行性及安全性,而国外专家认为,对于无法参与MET抑制剂相关临床试验的患者可考虑超适应证使用克唑替尼联合奥希替尼治疗。
MET/EGFR双特异性抗体JNJ-372同样也显示出对MET扩增患者疗效,但是否能成为MET/EGFR-TKI联合治疗进展后的有效策略还需等待进一步临床研究数据。
疾病控制率94.4%!肺癌新药伯瑞替尼临床试验招募进行中
MET的主要突变类型为MET 14外显子跳跃突变,最早发现于20年前,但直到近几年,针对这一靶点的药物研究才正式开展。
近期,我国药企自主研发的c-MET抑制剂药物伯瑞替尼(Bozitinib)获得了相当理想的疗效数据。
在近期AACR大会上报道的数据显示:在所有36例可评估疗效的患者中,伯瑞替尼的客观缓解率(ORR)为30.6%(11/36) ,疾病控制率(DCR)为94.4%(34/36)。
目前,伯瑞替尼的Ⅱ期临床招募正在进行中,国内患者免费使用c-MET靶向药的机会来了!详情请咨询无癌家园。
3
其它旁路激活:融合变异
目前临床中观察到的介导奥希替尼融合变异耐药包括RET、ALK、BRAF及FGFR3等致癌基因,对于这部分耐药机制,基本的治疗策略是采取联合EGFR抑制剂和融合基因对应抑制剂。
既往回顾性研究报道了包括联合BLU-667(RET抑制剂),阿来替尼(Alectinib)或克唑替尼(ALK抑制剂),曲美替尼(Trametinib,MEK抑制剂)克服融合变异耐药治疗策略,但在奥希替尼联合曲美替尼回顾性研究中观察到非常严重毒副反应,提示对于不同抑制剂联合需谨慎对待。若想参加临床试验请咨询无癌家园医学部(400-626-9916)。
临床中需要注意的是单纯基于NGS检测可能无法完全检测出融合变异,应同时结合基于RNA融合基因panel检测,目前ORCHARD研究正在进行针对融合基因介导耐药机制联合治疗模式的前瞻性探索。
4
组织学转化
一线奥希替尼进展后有多达15%的患者存在组织学转化,提示对于这部分临床患者组织再活检必要性。与原发SCLC类似,发生小细胞转化的EGFR突变NSCLC具有高频RB1失活及TP53变异和EGFR通路信号缺失。TP53和RB1变异不是小细胞转化后特异性分子特征,但基线合并TP53和/或RB1变异会显著增高小细胞转化概率。对于临床中ctDNA检测到RB1和TP53突变患者需进一步行组织检测以评估是否存在小细胞转化。
对于出现小细胞转化的患者,建议行EP方案化疗,在一项回顾性研究中显示小细胞转化后使用EP方案,54%患者对治疗有临床应答,中位生存期在10.9~13.7个月,其中17例后续接受单药免疫治疗的患者无一例有效,但因时效性原因这部分患者未参考IMpower133及CASPIAN研究结果采用免疫联合化疗方案,因此目前对于小细胞转化患者,免疫联合化疗是否可行尚待相关临床研究开展。
另外临床中还观察到部分鳞癌转化介导的EGFR-TKI耐药,但鲜少相关研究报道,目前建议基于组织学选择更为合适的化疗方案。在今年ASCO上报道了一项奥希替尼联合贝伐珠单抗(Bevacizumab)作为一线治疗的Ⅰ/Ⅱ期研究,其中21例进展病灶进行组织NGS及病理评估,EGFR通路获得性耐药突变仅占8%,15%病灶出现鳞癌转化,8%出现小细胞转化,61%患者耐药机制不明,但该研究样本量有限,对于奥希替尼联合抗血管治疗是否会显著影响后续耐药机制仍有待进一步探讨。
肺癌靶向治疗的前提——基因检测
现在,我们有很多的治疗选择。肿瘤学家可以更精准地选择具有更好结果和更好耐受性的疗法,对患者来说更是一件好事。越来越多肺癌患者将在科学指导和精准医疗指导下,合理地轮换药物。延长生存期,长期带瘤生存,将肺癌变成慢性病的梦想已经照进现实。
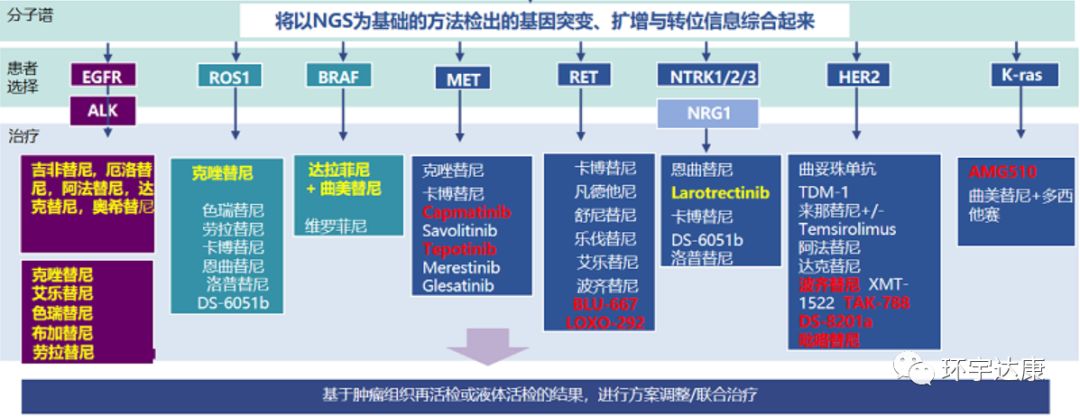
而对于肺癌患者,前期基因检测是绝对必要的。有助于选择化疗方案(这将是大多数患者的选择)及靶向治疗方案。还需要进行免疫组织化学研究来了解PD-L1水平等,当然,还要找到基因靶点,需要对靶标和TMB进行全面的分析。NCCN指南已经明确建议肺癌患者接受全基因组测序,全面检测突变靶点,而不是个别常见的靶点如:EGFR/ALK等。
参考文献
1.https://ascopubs.org/doi/pdf/10.1200/JCO.19.03123