多基因检测到底差别在哪?TransATAC研究从分子特征找答案
Oncotype DX复发评分(RS)、PAM50复发风险(ROR)、EndoPredict(EP)、乳腺癌指数(BCI)等多基因检测分子评分已被临床用于评估HR+/HER2-早期乳腺癌内分泌治疗的远处复发风险。然而,这几种检测方法的评估结果经常并不一致。近日,发表于JCO杂志的TransATAC研究[1]旨在找出导致这些检测方法差异的分子特征。
TransATAC,顾名思义是ATAC(阿那曲唑辅助内分泌治疗的关键3期试验)的转化分析。研究人员对ATAC研究中他莫昔芬组和阿那曲唑组的785例未进行化疗的ER+/HER2-患者,进行上述四种多基因检测,并利用RS评分中的雌激素、增殖、侵袭性和HER2等评分模块来描述分子特征。研究采用Spearman相关分析和方差分析来评价各种检测方法的一致性(ρ值越大,相关性越好)。
RS、ROR、EP、BCI与病理特征的相关性
研究首先分析了RS、ROR、EP、BCI等分子评分与分期、肿瘤大小、淋巴结状态、肿瘤分级等临床病理特征的相关性,结果显示每种分子评分均与肿瘤分级呈显著相关,其中RS相关性相对弱(ρ=0.27),ROR、EP、BCI相似且均为中等相关(ρ=0.45~0.50)。
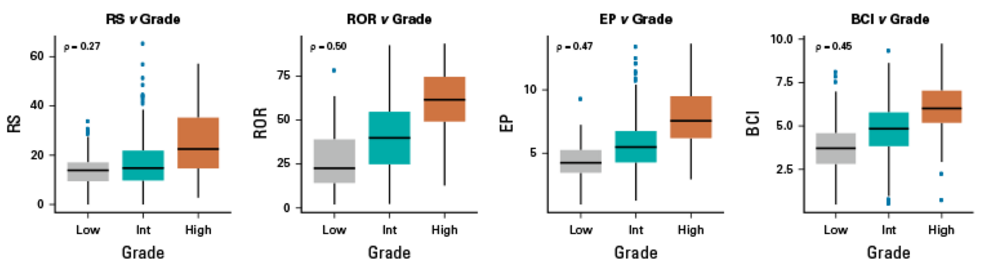
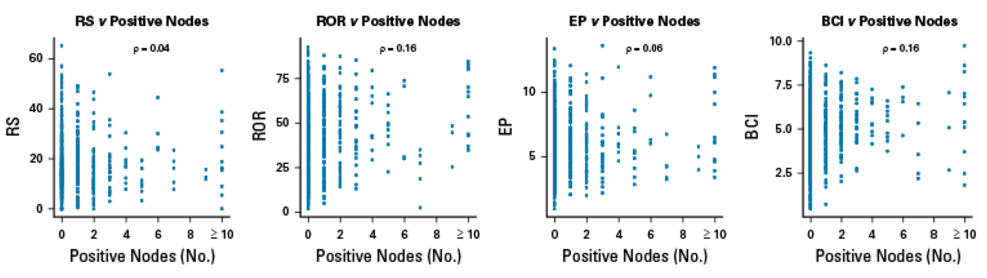
RS、EP与年龄年龄、肿瘤大小或淋巴结状态的相关性均极弱(ρ均<0.20),但ROR与年龄、肿瘤大小呈弱相关和中度相关(ρ分别为0.29和0.32),BCI与肿瘤大小的相关性为0.23。所有分子评分与淋巴结状态的相关性均极弱(ρ均<0.20)。
RS、ROR、EP、BCI的相关性
在整体人群中,RS与EP呈强相关(ρ=0.63),与ROR(ρ=0.32)和BCI(ρ=0.35)呈中等相关。然而,几乎所有RS≥31的患者,其ROR和BCI评分均高于其各自的中位数(ROR为40.2,BCI为4.8)。
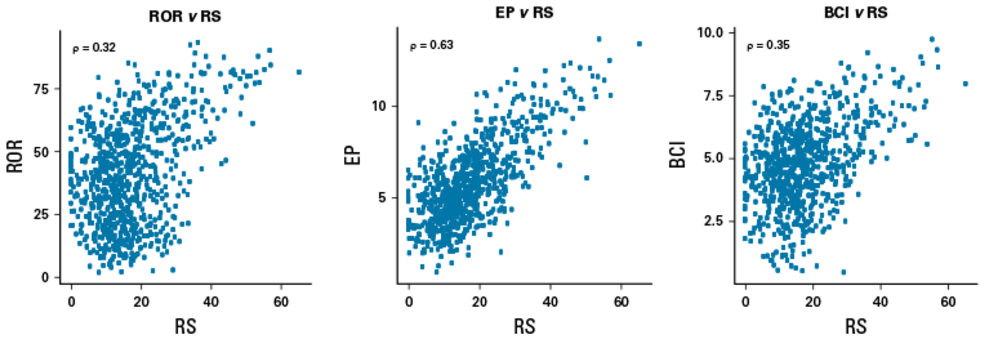
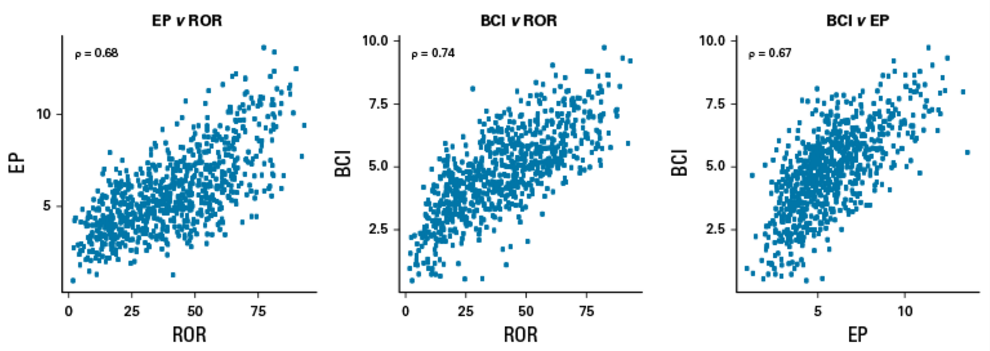
ROR、EP、BCI等其他三种分子评分之间的相关性很强(ROR v EP,ρ=068;ROR v BCl,ρ=0.74;EP v BCl,ρ=0.67)。
RS与其评分模块的相关性
研究还分析了RS与其不同评分模块(雌激素、增殖、侵袭和HER2等)的相关性,结果显示RS与雌激素呈强负相关(ρ= -0.79),与增殖呈中度正相关(ρ=0.36);与侵袭呈弱正相关(ρ=0.26);与HER2没有相关性(ρ= -0.04)。
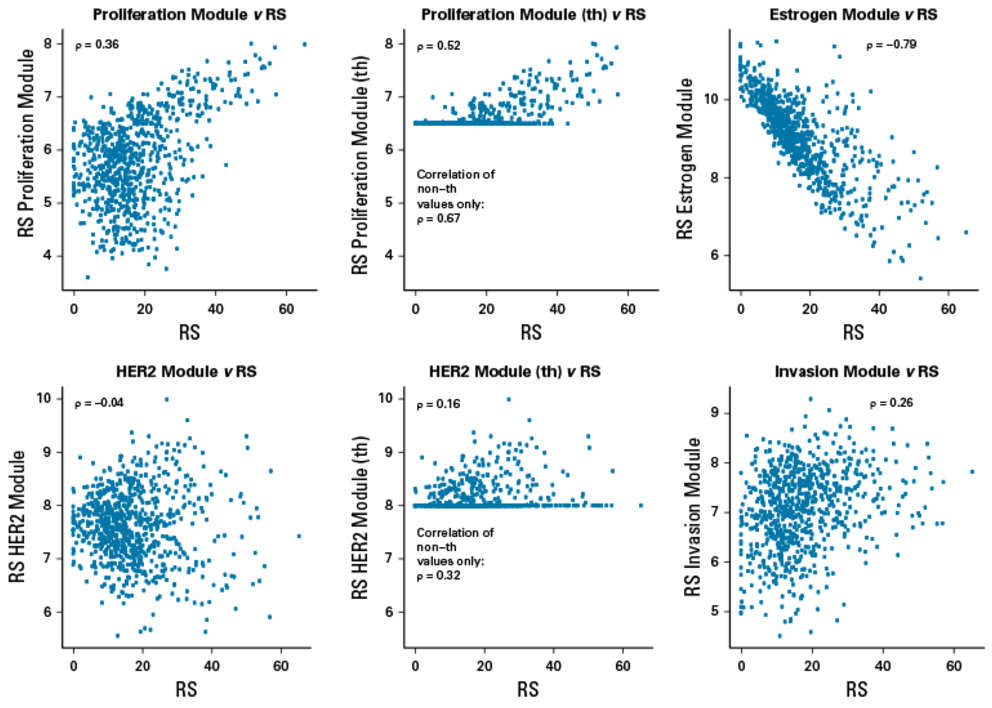
ROR、EP、BCI与RS评分模块的相关性
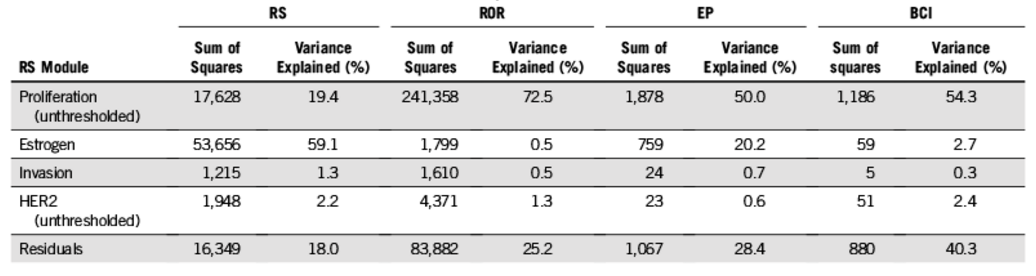
研究进一步分析了RS各评分模块(雌激素、增殖、侵袭和HER2等)与ROR、EP和BCI的相关性。结果显示:RS和ROR之间的差异(variance explained,方差解释率),72.5%来自于增殖评分,而雌激素评分仅为0.6%;RS与EP之间的差异,一半(50%)来自增殖评分,雌激素评分占20.2%;RS与BCI之间的差异,54.3%来自于增殖评分,而雌激素也是几乎没有影响(占2.7%)。ROR、EP和BCI与RS的HER2评分相关性均很小(0.6%~2.4%)。
研究总结
与以往的一般理解(RS评分高的患者建议化疗,似乎意味着与增殖相关)有所不同,这项研究结果表明:RS评分更大程度由雌激素相关特征所决定,而由增殖特征决定的程度较微弱。相反,EP、BCI、尤其是ROR评分在很大程度上取决于增殖特征。这些结果将有助于解释不同多基因检测方法之间预测性能的差异。
小贴士
传统的乳腺癌分型是按照免疫组化(IHC)进行的二元分类(阴性或阳性),包括激素受体阳性(管腔A和管腔B)、激素受体阴性(HER2过表达、基底型/三阴性)。随着基因检测技术的发展,越来越多的基因检测panel用于乳腺癌的分子分型,从而判断其预后或指导治疗。
目前常见的乳腺癌多基因检测方法包括:
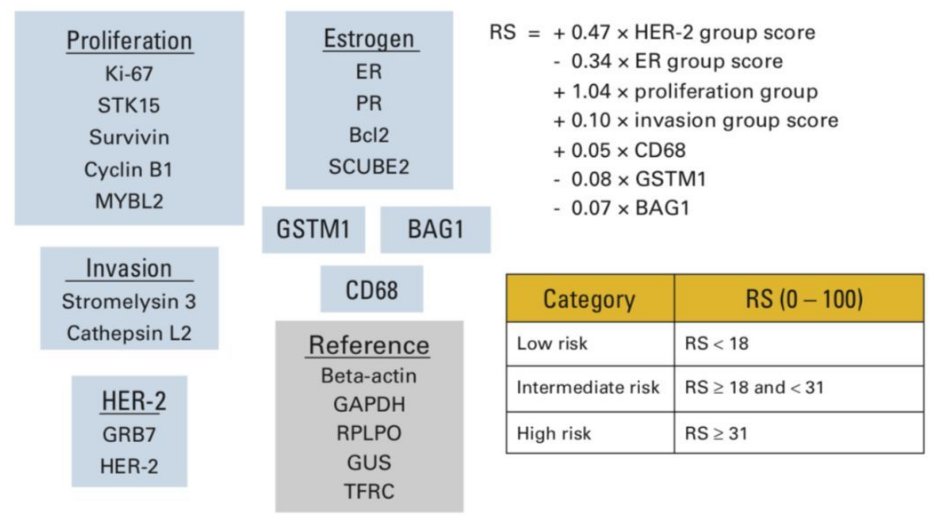
Oncotype DX(21基因)——通过定量检测包括增殖、侵袭、雌激素、HER2等15个肿瘤相关基因和5个参考基因,以复发评分(RS)来评估肿瘤的复发风险(见下图)。RS还可以用于指导术后治疗(TAILORx研究),低风险患者仅需内分泌治疗,高风险患者需给予内分泌+化疗[2]。
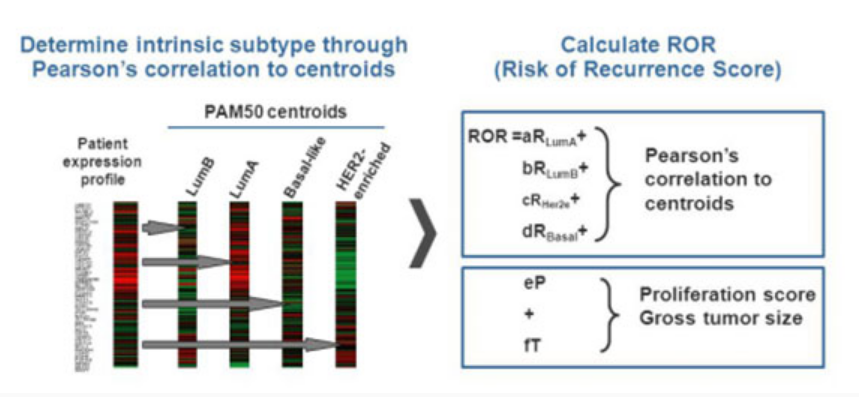
Prosigna(PAM50)——PAM50检测系基于乳腺癌内源性亚型,通过检测50个相关基因,将乳腺癌肿瘤分类为4内源性亚型,即管腔A、管腔B、HER2富集以及类基底型(Basal-like),计算复发风险评分(ROR),可预测乳腺癌术后近期和远期的远处复发转移风险[3]。
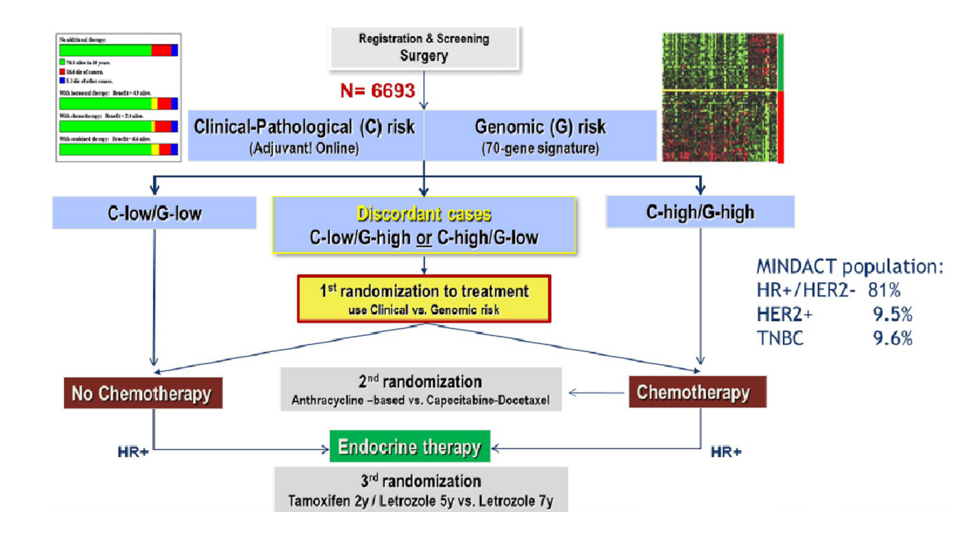
MammaPrint(70基因)——运用ctDNA微阵列技术检测肿瘤冰冻组织、FFPE样本中的基因mRNA表达水平,筛选出包括肿瘤浸润、转移、间质侵犯、血管生成等预后相关的70个基因。MINDACT研究中,临床低危/基因低危(c-L/g-L)的患者可以避免化疗,临床高危/基因高危(c-H/g-H)术后需要化疗[4]。
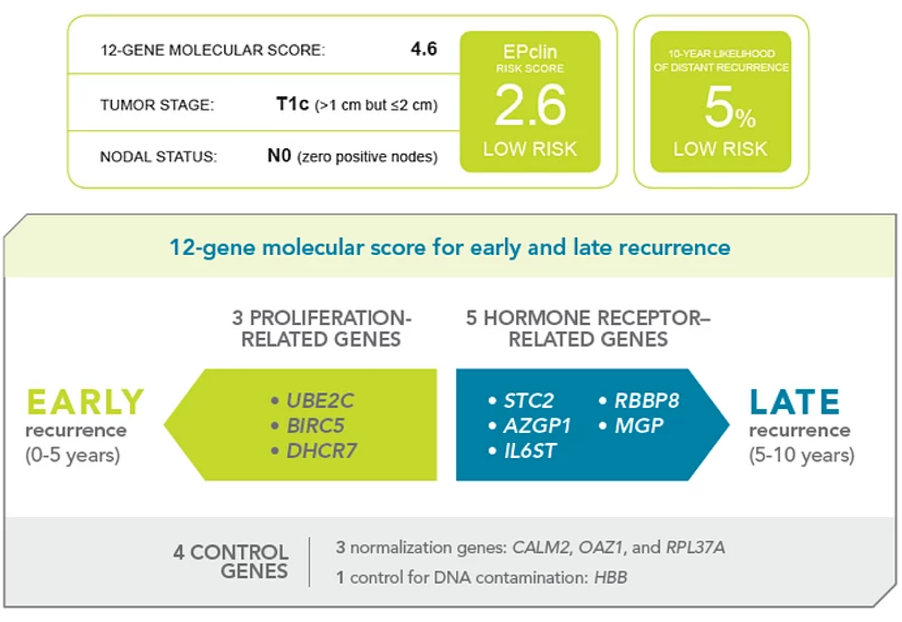
EndoPredict(8/12基因)——主要检测3个增殖基因、5个激素受体基因以及4个控制基因,并结合肿瘤大小以、淋巴结状态获得EPclin,用于评估近期或远期的乳腺癌复发转移风险。EPclin的临床研究中,将患者分为低危组和高危组,其中高危患者接受化疗[5]。
乳腺癌指数(BCI)——用来预测ER阳性、淋巴结阴性乳腺癌的远处复发风险,主要包括2个基因HOXB13/IL17BR的表达比例,以及5个增殖相关基因的评分。BCI可用于预测近期和远期的复发风险,高危患者可从延长内分泌治疗中获益(Trans-aTTom研究)[6]。

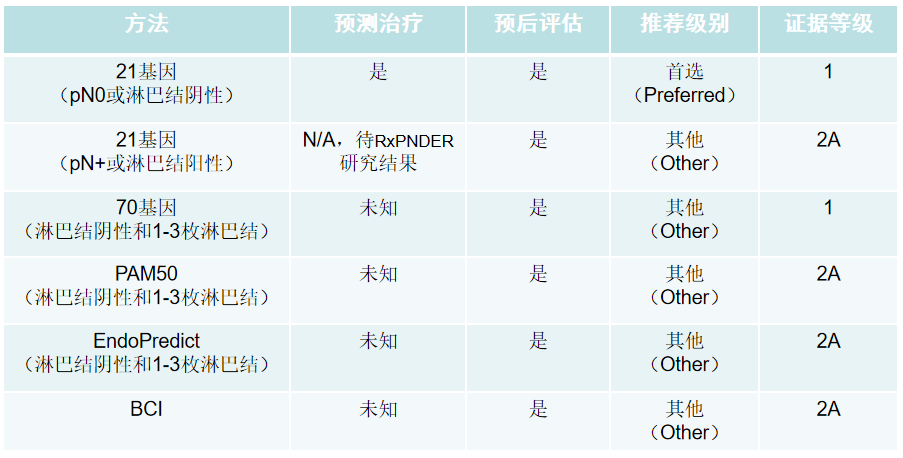
指南推荐及临床应用:
目前,21基因检测(Oncotype DX)已经成为ASCO及NCCN指南唯一推荐使用的多基因检测项目[7];但MammaPrint是美国FDA首个批准用于临床的多基因检测系统。这两种基因检测方法在国外已经得到比较普遍的临床应用。
参考文献
[1]Buus R, Sestak I, Kronenwett R, et al. Molecular Drivers of Oncotype DX, Prosigna, EndoPredict, and the Breast Cancer Index: A TransATAC Study [published online ahead of print, 2020 Oct 27]. J Clin Oncol. 2020;JCO2000853. doi:10.1200/JCO.20.00853
[2]Sparano JA, Gray RJ, Makower DF, et al. Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med. 2018;379(2):111-121. doi:10.1056/NEJMoa1804710
[3]Lænkholm AV, Jensen MB, Eriksen JO, et al. PAM50 Risk of Recurrence Score Predicts 10-Year Distant Recurrence in a Comprehensive Danish Cohort of Postmenopausal Women Allocated to 5 Years of Endocrine Therapy for Hormone Receptor-Positive Early Breast Cancer. J Clin Oncol. 2018;36(8):735-740. doi:10.1200/JCO.2017.74.6586
[4]Cardoso F, van't Veer LJ, Bogaerts J, et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med. 2016;375(8):717-729. doi:10.1056/NEJMoa1602253
[5]Buus R, Sestak I, Kronenwett R, et al. Comparison of EndoPredict and EPclin With Oncotype DX Recurrence Score for Prediction of Risk of Distant Recurrence After Endocrine Therapy. J Natl Cancer Inst. 2016;108(11):djw149. Published 2016 Jul 10. doi:10.1093/jnci/djw149
[6]John Bartlett, Dennis Sgroi, Kai Treuner, et al.Trans-aTTom: Breast Cancer Index for prediction of endocrine benefit and late distant recurrence(DR) in patients with HR+ breast cancer treated in the adjuvant tamoxifen—To offer more?(aTTom) trial.2019 ASCO; Abstract 505.
[7]NCCN clinical practice guidelines in oncology: breast cancer 2020