常规超声联合超声造影术前评估乳腺癌患者腋窝淋巴结的诊断价值
常规超声联合超声造影术前评估乳腺癌患者腋窝淋巴结的诊断价值
杜丽雯,巩海燕,邓 晶,王 慧,易春蓓,栗翠英
南京医科大学第一附属医院超声诊断科,江苏 南京 210029
[摘要] 目的:比较常规超声(灰阶超声、彩色多普勒超声)及超声造影(contrast-enhanced ultrasound,CEUS)在乳腺癌患者腋窝淋巴结诊断中的价值,并将常规超声和CEUS相联合,评估联合诊断的价值。方法:回顾并分析234例乳腺癌患者术前腋窝淋巴结超声声像图,包括常规超声和CEUS特征。测量并记录不同检查方法的超声声像图特征和参数。采用t检验、χ2检验、受试者工作特征(receiver operating characteristic,ROC)曲线和logistic回归分析不同超声检查方法及参数。结果:多因素logistic回归分析结果显示淋巴结皮质厚度是诊断转移性腋窝淋巴结最准确的参数[P<0.001,曲线下面积(area under curve,AUC)=0.808];淋巴结灰阶分型(P<0.001,AUC=0.786)、血流模式分型(P<0.001,AUC=0.773)、增强模式(P<0.001,AUC=0.662)在鉴别良恶性淋巴结中差异有统计学意义。淋巴门结构消失、非淋巴门型血流和阻力指数(resistance index,RI)≥0.7诊断转移性淋巴结具有较高的特异度(97.7%、94.6%、98.4%),但灵敏度低(31.7%、59.6%、26.0%)。常规超声检查诊断转移性淋巴结灵敏度、特异度、AUC分别为93.3%、66.2%、0.797;CEUS诊断转移性淋巴结灵敏度、特异度、AUC分别为46.2%、86.2%、0.662。常规超声联合CEUS显示灵敏度、特异度、AUC分别为96.2%、59.2%、0.777。比较常规超声和常规超声联合CEUS这两种方法差异无统计学意义(P=0.146)。结论:常规超声对乳腺癌患者腋窝淋巴结鉴别诊断有一定的意义。CEUS作为辅助检查方法无法提高常规超声诊断价值。
[关键词] 乳腺癌;腋窝淋巴结;彩色多普勒超声;超声造影
[Abstract]Objective: To evaluate the diagnostic performance of contrast-enhanced ultrasound(CEUS) combined with the conventional ultrasound(US) including color Doppler flow and grey-scale US of breast cancer in predicting metastatic axillary lymph nodes in breast cancer patients. Methods: The conventional US and CEUS features of axillary nodes of 234 patients were retrospectively analysed. Different US patterns and parameters were evaluated. The correlation of US patterns and parameters with prognostic factors was analysed with thet test, chi-squared tests, receiver operating characteristic(ROC) curve and logistic regression analysis. Results: Multivariate logistic regression analysis showed that cortical thickness was the most accurate parameter for diagnosing malignant axillary lymph nodes [P<0.001, area under curve(AUC)=0.808]. Lymph node types of grey-scale US(P<0.001, AUC=0.786), vascular pattern(P<0.001, AUC=0.773), enhancement pattern(P<0.001, AUC=0.662) was statistically significant in identifying benign and malignant lymph nodes. Absence of hilum, non-perihilar vessel and resistance index(RI) ≥0.7 has high specificity in diagnosing metastatic lymph nodes(97.7%, 94.6%, 98.4%), but low sensitivity(31.7%, 59.6%, 26.0%). The sensitivity, specificity and AUC of conventional US in the diagnosis of metastatic lymph nodes were 93.3%, 66.2% and 0.797. The sensitivity, specificity and AUC of CEUS in the diagnosis of metastatic lymph nodes were 46.2%, 86.2% and 0.662, respectively. Conventional US combined with CEUS showed a sensitivity of 96.2%, a specificity of 59.2%, and an AUC of 0.777 in identifying benign and malignant lymph nodes. There was no significant difference between conventional US and conventional US combined with CEUS(P=0.146). Conclusion: Conventional US has a certain significance in the diagnosis of axillary lymph nodes in patients with breast cancer. As an auxiliary method, CEUS cannot improve the accuracy of conventional US.
[Key words] Breast cancer; Axillary lymph node; Color Doppler flow ultrasound; Contrast-enhanced ultrasound
乳腺癌是中国女性最常见的恶性肿瘤[1]。腋窝淋巴结是乳腺癌最先及最常见的转移部位,腋窝淋巴结状态不仅决定了患者的治疗方案而且是重要的预后因素之一[2]。对于乳腺癌腋窝淋巴结临床阴性患者,将行前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)。对乳腺癌腋窝淋巴结临床阳性患者和前哨淋巴结活检阳性患者予以腋窝淋巴结清扫术(axillary lymph node dissection,ALND)[3-4]。然而,乳腺癌患者ALND术后可能会出现感染、感觉异常、上肢及肩关节活动度减低、上肢淋巴水肿等并发症,上肢淋巴水肿是ALND最严重的并发症,发生率为6%~30%[5]。此外,一些研究表明SLNB术后也可出现上肢淋巴水肿,发生率为2%~7%[4-7]。乳腺癌患者腋窝淋巴结体格检查灵敏度低,仅为33%~68%[8-9]。而超声检查具有较高的灵敏度及特异度,其良好的诊断价值已被临床认可,已普遍用于乳腺癌患者术前检查。
国内外已有研究表明常规超声(灰阶超声、彩色多普勒超声)及超声造影(contrast-enhanced ultrasound,CEUS)对乳腺癌患者腋窝淋巴结诊断具有较好的诊断价值[10]。术前超声评估乳腺癌腋窝淋巴结状态得到了广泛的临床认可,但有关其诊断的标准仍有争议。本研究总结了常规超声和CEUS评估中各种测量参数,比较其诊断价值,以寻找腋窝淋巴结术前检查最优方法。
1
资料和方法
1.1 临床资料
回顾并分析2014年11月—2019年5月于南京医科大学第一附属医院就诊的乳腺癌患者的腋窝淋巴结超声声像图。患者均行常规超声及CEUS检查,排除超声声像图信息不完全或无病理学检查结果的患者,最终纳入234例患者。根据术前乳腺钼靶X线检查、乳腺磁共振成像和超声检查,患者计划进行SLNB或ALND。
1.2 方法
采用意大利Esaote公司的MyLab Twice超声诊断仪。彩色多普勒超声和灰阶超声采用频率为4~15 MHz的线性阵列探头L523,机械指数0.7,增益100~120 dB。CEUS采用频率为4~9 MHz的低频超声探头L522。造影剂使用意大利Bracco公司的声诺维(SonoVue),用5 mL 0.9%的NaCl溶液稀释,每次检查经肘静脉推注1.2 mL造影剂。患者均签署知情同意书。
根据胸小肌的相对位置将腋窝淋巴结分为3个水平。Ⅰ区:胸小肌外侧,包括乳腺外侧组、中央组、肩胛下组及腋静脉淋巴结;胸大小肌之间,Rotter淋巴结。Ⅱ区:胸小肌深面的腋静脉淋巴结。Ⅲ区:胸小肌内侧静脉淋巴结,即锁骨下淋巴结。乳腺癌引流淋巴结转移常以顺序形式由较低水平至较高水平有序发生,偶有跳跃式转移[11]。超声检查重点关注腋窝Ⅰ区淋巴结。灰阶超声腋窝淋巴结测量参数包括淋巴结长径(L)、淋巴结短径(S)、最大皮质厚度、开始增强时间和阻力指数(resistance index,RI)。当淋巴门结构消失时,只测量L、S、开始增强时间和RI[12-13]。检查后计算L/S。所有数据均需在淋巴结长轴上测量。根据皮质形态学特征,将淋巴结分为4型:Ⅰ型,薄而均匀的低回声皮质,最大皮质厚度<1.6 mm或皮质几乎不显示。Ⅱ型,均匀的低回声皮质,1.6 mm≤最大皮质厚度<3 mm。Ⅲ型,局灶性皮质增厚或不均匀增厚,最大皮质厚度≥3.0 mm。Ⅳ型,完全低回声结节,无高回声淋巴门结构[14-15]。
彩色多普勒超声检查需在低壁滤波和低速度模式下进行。彩色增益需要动态调整,彩色增益最大化且无红、蓝彩色杂波。根据相关文献血流模式[12,15-16],将腋窝淋巴结分为4类:淋巴门型血流、中央型血流、周围型血流和混合型血流。淋巴门型血流定义为淋巴结髓质中央或偏心血流信号,呈点状、条状或树枝状。中央型血流定义为散在点状或条状血流信号、皮质或髓质中长轴径向的、变形的径向或异常的多焦点聚集血流信号。周围型血流定义为沿淋巴结边缘走行的环形条状血流信号[16-17]。混合型血流定义为具有多种血流模式的淋巴结。无淋巴门型淋巴结中,血流被描述为中央型、周围型或混合型血流。淋巴门型血流多见于非转移性淋巴结。中央型、周围型及混合型血流多出现于转移性淋巴结中。
根据腋窝淋巴结造影临床经验及先前文献研究,造影增强模式分为均匀性增强和非均匀性增强[18-19]。均匀性增强模式定义为淋巴结整体增强强度一致。非均匀性增强模式被定义为淋巴结的不均匀增强,包括部分高增强、低增强和灌注缺损。多指标联合诊断乳腺癌腋窝淋巴结,当淋巴结具有一个可疑参数时,被认为属于可疑淋巴结。
1.3 统计学处理
所有统计学分析均使用SPSS 20.0及MedCalc 15.6。参数分析采用t检验和χ2检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算各检查参数界值。分析并记录每个检查参数的灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)、Youden指数、曲线下面积(area under curve,AUC)及多元回归模型。
2
结 果
234例患者均为原发性乳腺癌,年龄24~84,平均(49.4±11.0)岁。肿瘤大小5~115 mm,平均大小(26.4±15.7)mm。病理学检查证实转移性淋巴结有130例(55.56%)。
在灰阶超声声像图中,转移性及非转移性淋巴结最大皮质厚度、S、L/S的差异有统计学意义(P<0.001,表1)。S≥7.1 mm、L/S≤2.0、最大皮质厚度≥3.0 mm更多地出现在转移性淋巴结中,且最大皮质厚度是转移性淋巴结最准确的诊断标准(P<0.001,AUC=0.808)。在234例腋窝淋巴结灰阶皮质分型中,135例(57.69%)淋巴结被分为Ⅱ~Ⅳ型。转移性淋巴结所占各型比例为24.04%、38.46%、26.92%,显著高于非转移性淋巴结所占比例13.85%、16.15%、2.30%。11例转移性淋巴结被分为Ⅰ型,假阴性率(false negative rate,FNR)为10.58%。42例非转移性淋巴结被分为Ⅱ~Ⅳ型,假阳性率(false positive rate,FPR)为33.31%。灰阶皮质淋巴结分型诊断转移性淋巴结的灵敏度、特异度、PPV、NPV和AUC分别为89.4%、67.7%、68.9%、88.9和0.786(图1,表2)。


图 1 淋巴结灰阶超声Ⅰ~Ⅳ型
A:Ⅰ型,薄而均匀的低回声皮质;B:Ⅱ型,均匀的低回声皮质,最大皮质厚度为2.2 mm;C:Ⅲ型,局灶性皮质增厚,最大皮质厚度>3.0 mm;D:Ⅳ型,淋巴门结构消失。病理学检查证实A为非转移性淋巴结,B~D为转移性淋巴结。
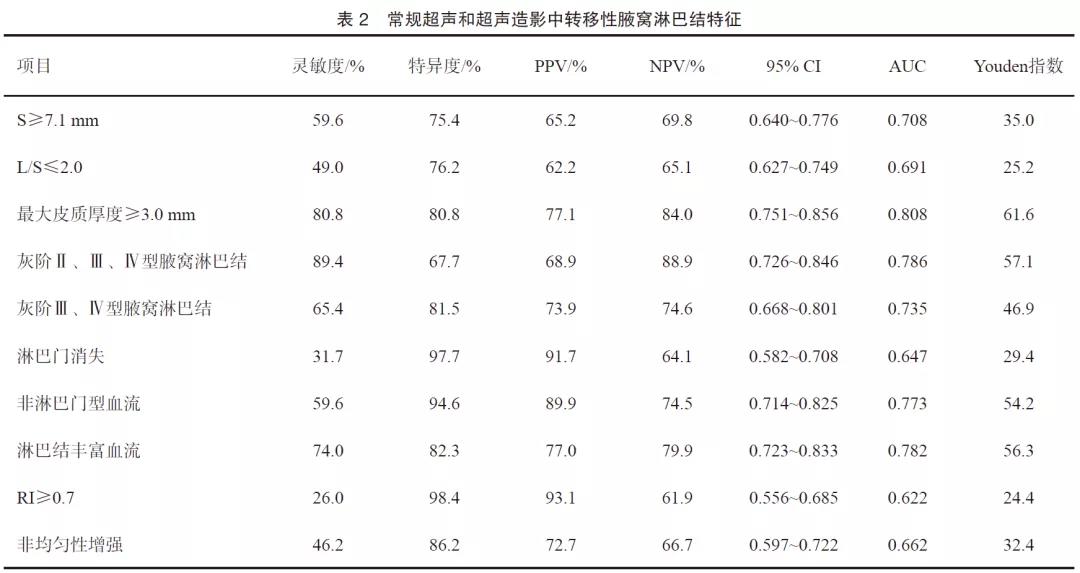
彩色多普勒超声检查发现,非转移性淋巴结多表现为淋巴门型血流(94.62%)。中央型、周围型和混合型血流在转移性淋巴结组百分比为7.69%、2.88%、49.04%,明显高于非转移性淋巴结组0.77%、0.77%及3.85%(P<0.01)。74.04%转移性淋巴结血流丰富,而非转移性淋巴结仅17.69%血流丰富,两组之间差异有统计学意义(P<0.001)。使用血流丰富程度诊断腋窝淋巴结灵敏度、特异度、AUC分别为74.0%、82.3%、0.782。RI≥0.7时特异度最高(98.4%),但灵敏度低(26.0%),AUC为0.622。开始增强时间诊断转移性淋巴结差异无统计学意义(P>0.05)。CEUS检查中,转移性淋巴结多表现为非均匀性增强(P<0.001,图2~3)。

图 2 彩色多普勒血流分型
A:淋巴门型血流;B:中央型血流;C:周围型血流;D:混合型血流。病理学检查证实A为非转移性淋巴结,B~D为转移性淋巴结。

图 3 腋窝淋巴结超声增强模式
A:均匀性增强;B:非均匀性增强,部分性高增强;C:非均匀性增强,部分充盈缺损;D:非均匀性增强,部分性低增强。病理学检查证实A为非转移性淋巴结,B~D为转移性淋巴结。
多因素logistic回归分析结果显示最大皮质厚度≥3 mm,淋巴结灰阶分型,血流分型和CEUS增强模式诊断转移性淋巴结差异有统计学意义(P<0.05,表3)。常规超声联合CEUS并不能提高常规超声检查的诊断价值,两种方法比较差异无统计学意义(P>0.05,表4,图4)。



3
讨 论
术前超声检查评估乳腺癌患者腋窝淋巴结状态,其较好的灵敏度及特异度经国内外学者研究证实,并作为乳腺癌患者术前常规检查方法[9]。当超声检查无可疑淋巴结时,患者可行SLNB,减少不必要的腋窝淋巴结清扫,减少并发症发生。此外,当患者有可疑腋窝淋巴结时可以行超声引导下腋窝淋巴结细针穿刺或空心针活检,避免不必要的SLNB并减少前哨FNR[20]。研究发现CEUS对于鉴别乳腺肿块良恶性有重要的诊断价值,其对乳腺癌患者腋窝淋巴结的诊断效能也有相关报道[21-22]。但对乳腺癌患者腋窝淋巴结行超声多种方法联合诊断的研究较少[23]。
灰阶超声声像图中低回声皮质代表边缘窦,淋巴滤泡和副皮质。由于血管、脂肪及中央窦的多重反射界面,淋巴门表现为高回声。输入淋巴管和输出淋巴管在灰阶超声声像图中不能被显示[14]。非转移性腋窝淋巴结常规超声声像图表现为薄且均匀的低回声皮质、最大皮质厚度<3 mm、淋巴门结构存在、淋巴门型血流,CEUS表现为均匀性增强[24]。超声诊断腋窝淋巴结良恶性时,关注淋巴结的形态及整体回声(有无淋巴结门结构)。由于癌细胞转移至淋巴结首先通过输入淋巴管到达边缘窦,沉积在淋巴结的外围,所以淋巴结皮质形态变化最为重要。随后癌细胞侵犯小梁窦和髓窦,导致皮质弥漫性或偏心增厚,并逐渐侵犯整个淋巴结至淋巴门消失[25]。转移性淋巴结常规超声表现为淋巴结皮质弥漫性或局限性增厚、L/S减小、淋巴门结构偏心或消失、非淋巴门型血流,而CEUS表现为非均匀性增强[15,20]。
根据淋巴结皮质形态变化,目前有多种分型方法。Bedi等[14]将淋巴结分为Ⅰ~Ⅵ型。Ⅰ型:几乎无淋巴结皮质;Ⅱ型:皮质薄而均匀的低回声区;Ⅲ型:均匀低回声皮质厚度>3 mm和轻微分叶状;Ⅳ型:增厚的皮质分叶为淋巴门回声的延续。Ⅰ~Ⅳ型为非转移性淋巴结。Ⅴ型(局灶性增厚低回声皮质)和Ⅵ型(淋巴门结构消失)淋巴结为转移性淋巴结,其诊断的灵敏度、特异度和准确率分别为77.0%、80.0%和80.0%。反应性淋巴结与转移性淋巴结在超声声像图中相似,通常当机体有炎性反应时,淋巴结反应性增大,皮质均匀性增厚,血流增多,但以往文献中没有关于均匀性增厚淋巴结皮质厚度界值。本研究中,我们将1.6 mm定义为Ⅰ型与Ⅱ型最大皮质厚度临界值,区分部分反应性淋巴结和转移性淋巴结,其结果,灵敏度为89.9%、特异度为37.5%。Abe等[26]报道,淋巴门结构消失诊断转移性淋巴结具有较好PPV(93.0%),但灵敏度较低(33.0%)。Vijayaraghavan等[4]研究发现,以最大皮质厚度和淋巴门消失诊断转移性淋巴结,AUC、准确率和95.0% CI分别为0.830、81.7%和76.2%~89.7%。所以当高回声淋巴门消失时,应该高度怀疑转移性淋巴结。本研究中淋巴门消失仍有3例为非转移性淋巴结,FNR为3.65%,回顾并分析图像,可能原因为超声检查受操作者主观因素影响较大,淋巴结较小(<10 mm)或增益较低时,高回声淋巴门显示不清。
淋巴结的最大皮质厚度是转移性淋巴结的孤立预测因素。在Abe等[26]的研究中,最大皮质厚度界值为3 mm,该界值用于诊断转移性淋巴结的灵敏度和特异度分别为95.0%和6.0%。当以4 mm为界值时,灵敏度为88.0%,特异度为42.0%。随着最大皮质厚度界值增加,灵敏度逐渐下降,而PPV和特异度逐渐增加。因此,我们采用S≥7.1 mm、L/S≤2.0等其他参数,虽然之前研究显示L/S和S是较好诊断指标,但其可能受到皮质厚度因素的影响。在多元logistics回归分析中,这些参数不是孤立的预测因素,差异无统计学意义。
彩色多普勒超声诊断乳腺癌患者的淋巴结状态具有重要价值。Na等[16]将淋巴门血流分为淋巴门型、中央型和周围型,并将这3种血流模式进一步细分。Yang等[12]的研究中将淋巴结血流分为周围型血流、中央型血流、中央门型血流、混合型血流。本研究中,因部分中央型血流患者被计入混合型血流,所以转移组中央型血流患者例数较少。转移性癌细胞导致正常淋巴门血流中断,周围肿瘤滋养血供增多导致血流增多。RI和搏动指数增高与血管狭窄有关。由于血管生成素促进转移性淋巴结新生血管形成,新生血管结构缺乏肌层,易出现血管狭窄、血管闭塞,不规则血管分支和动静脉瘘[27]。这些血流特征导致不同类型的血流动力学变化。不同研究选择不同RI界值,范围为0.6~0.9。本研究中,我们选用界值RI≥0.7,灵敏度为26.0%,特异度为98.4%、AUC为0.622,诊断效能较低。反应性淋巴结也可表现为周围型血流、丰富血流信号、RI增高。如双侧腋窝淋巴结皮质均匀性增厚,应考虑反应性淋巴结可能。
随着仪器性能的改进和新型声学造影剂的出现,CEUS已成为超声诊断的主要进展之一。CEUS可以显示直径为0.1~0.3 mm的血管,以弥补彩色多普勒超声检查的局限性[28]。CEUS在乳腺疾病诊断中的主要应用包括良恶性肿块鉴别诊断、腋窝转移性淋巴结诊断、经皮CEUS前哨淋巴结定位等[29-31]。在本研究中,开始增强时间诊断转移性淋巴结差异无统计学意义。非均匀性增强模式包括整体或部分淋巴结皮质早期增强、早退、高增强、低增强和灌注缺损[30-31]。CEUS诊断转移性淋巴结时,应观察淋巴结皮质区域,当淋巴门脂肪含量较高时,脂肪组织区域会显示出低增强,不应诊断为非均匀性增强。病理学检查显示转移性淋巴结被肿瘤细胞浸润,造影剂不能进入淋巴结或在其他区域积聚,导致不均匀性增强[32]。2004年,Rubaltelli等[33]研究首次提出了灌注缺损,定义为与正常淋巴组织增强相比病灶血流减少,增强强度减低或未增强。Dellaportas等[18]研究发现,非转移性淋巴结表现为均匀高增强,慢进和慢退。而转移性淋巴结表现为不均匀性增强,早进和早退。
多因素logistic回归分析显示淋巴结灰阶分型、最大皮质厚度、血流模式和增强模式是诊断转移性淋巴结的孤立预测因素(P<0.05)。非均匀性增强AUC、灵敏度、特异度分别为0.662、46.2%、86.2%。CEUS作为辅助检查方法需要在常规超声的基础上,当常规超声发现可疑恶性淋巴结时,宜通过CEUS对可疑恶性淋巴结进行进一步成像。CEUS联合常规超声检查并不会提高诊断效能,AUC 0.777(95% CI:0.718~0.829),但其具有较高的灵敏度(96.2%),尽管两种检查方法之间差异无统计学意义(P>0.05)。
相关研究结果显示,超声检查的众多诊断参数具有低灵敏度和高特异度的特征[33-35]。超声诊断转移性腋窝淋巴结FNR为16.7%~22.9%[28,33]。超声检查灵敏度和FNR均低的原因可能与转移性淋巴结的大小、位置和数量有关。一方面,较少的肿瘤细胞进入淋巴结,如微转移,不会引起形态学改变。另一方面,超声检查依赖于操作者,主观因素较强,腋窝超声检查范围较小时,转移性淋巴结可能被漏诊。高频超声可评估直径>5.0 mm淋巴结[35-36]。超声检查分辨率直接影响腋窝淋巴结评估的准确性。
本研究存在一些局限性。首先,术前腋窝淋巴结超声检查和术后病理学检查结果均代表整个腋窝淋巴结状态,超声评估的腋窝淋巴结与术后病理学检查结果未完全匹配。其次,超声检查具有一定的主观性。CEUS检查中,本研究仅使用了经肘静脉推注造影剂,而没有进行多种方法的对比,今后需要进一步研究。
最大皮质厚度是恶性腋窝淋巴结最准确的指标。常规超声对乳腺癌患者腋窝淋巴结的诊断具有一定的意义。CEUS的增强模式可用于诊断腋窝淋巴结转移。CEUS作为辅助手段不能提高超声的准确率。
[参考文献]
BOYLE P, LEON M E, Maisonneuve P, et al. Cancer control in women. Update 2003[J]. Int J Gynaecol Obstet, 2003, 83(Suppl 1): 179-202.
NOWIKIEWICZ T, NOWAK A, WIŚNIEWSKA M, et al. Diagnostic value of preoperative axillary lymph node ultrasound assessment in patients with breast cancer qualified for sentinel lymph node biopsy[J]. Wideochir Inne Tech Maloinwazyjne, 2015, 10(2): 170-177.
CLARKE M, COLLINS R, DARBY S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106.
VIJAYARAGHAVAN G R, VEDANTHAM S, KATAOKA M, et al. The relevance of ultrasound imaging of suspicious axillary lymph nodes and fine-needle aspiration biopsy in the post-ACOSOG Z11 era in early breast cancer[J]. Acad Radiol, 2017, 24(3): 308-315.
LYMAN G H, TEMIN S, EDGE S B, et al. Sentinel lymph node biopsy for patients with early-stage breast cancer: American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol, 2014, 32(13): 1365-1383.
HAN J W, SEO Y J, CHOI J E, et al. The efficacy of arm node preserving surgery using axillary reverse mapping for preventing lymphedema in patients with breast cancer[J]. J Breast Cancer, 2012, 15(1): 91-97.
PETREK J A, SENIE R T, PETERS M, et al. Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis[J]. Cancer, 2001, 92(6): 1368-1377.
DE FREITAS R JR, COSTA M V, SCHNEIDER S V, et al. Accuracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases in breast cancer[J]. Eur J Surg Oncol, 1991, 17(3): 240-244.
VALENTE S A, LEVINE G M, SILVERSTEIN M J, et al. Accuracy of predicting axillary lymph node positivity by physical examination, mammography, ultrasonography, and magnetic resonance imaging[J]. Ann Surg Oncol, 2012, 19(6): 1825-1830.
XIE F, ZHANG D, CHENG L, et al. Intradermal microbubbles and contrast-enhanced ultrasound(CEUS) is a feasible approach for sentinel lymph node identification in early-stage breast cancer[J]. World J Surg Oncol, 2015, 13(1): 319.
蒋蓓琦, 章 华, 庄志刚. 腋窝超声在乳腺癌前哨淋巴结活检中应用价值[J]. 中华临床医师杂志(电子版), 2013, 7(5): 1975-1979.
YANG W T, CHANG J, METREWELI C. Patients with breast cancer: differences in color Doppler flow and gray-scale US features of benign and malignant axillary lymph nodes[J]. Radiology, 2000, 215(2): 568-573.
CHIKUI T, YONETSU K, NAKAMURA T. Multivariate feature analysis of sonographic findings of metastatic cervical lymph node: contribution of blood flow features revealed by power Doppler sonography for predicting metastasis[J]. AJNR Am J Neuroradiol, 2000, 21(3): 561-567.
BEDI D G, KRISHNAMURTHY R, KRISHNAMURTHY S, et al. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study[J]. AJR Am J Roentgenol, 2008, 191(3): 646-652.
CHOI Y J, KO E Y, HAN B K, et al. High-resolution ultrasonographic features of axillary lymph node metastasis in patients with breast cancer[J]. Breast, 2009, 18(2): 119-122.
NA D G, LIM H K, BYUN H S, et al. Differential diagnosis of cervical lymphadenopathy: usefulness of color Doppler sonography[J]. AJR Am J Roentgenol, 1997, 168(5): 1311-1316.
YANG W T, METREWELI C, LAM P K, et al. Benign and malignant breast masses and axillary nodes: evaluation with echo-enhanced color power Doppler US[J]. Radiology, 2001, 220(3): 795-802.
DELLAPORTAS D, KOUREAS A, CONTIS J, et al. Contrast-enhanced color Doppler ultrasonography for preoperative evaluation of sentinel lymph node in breast cancer patients[J]. Breast Care(Basel), 2015, 10(5): 331-335.
WAN C F, DU J, FANG H, et al. Enhancement patterns and parameters of breast cancers at contrast-enhanced US: correlation with prognostic factors[J]. Radiology, 2012, 262(2): 450-459.
NORI J, VANZI E, BAZZOCCHI M, et al. Role of axillary ultrasound examination in the selection of breast cancer patients for sentinel node biopsy[J]. Am J Surg, 2007, 193(1): 16-20.
STEPPAN I, REIMER D, MÜLLER-HOLZNER E, et al. Breast cancer in women: evaluation of benign and malignant axillary lymph nodes with contrast-enhanced ultrasound[J]. Ultraschall Med, 2010, 31(1): 63-67.
OUYANG Q, CHEN L, ZHAO H, et al. Detecting metastasis of lymph nodes and predicting aggressiveness in patients with breast carcinomas[J]. J Ultrasound Med, 29(3): 343-352.
AGLIATA G, VALERI G, ARGALIA G, et al. Role of contrast-enhanced sonography in the evaluation of axillary lymph nodes in breast carcinoma: a monocentric study[J]. J Ultrasound Med, 2017, 36(3): 505-511.
BOUGHEY J C, BALLMAN K V, HUNT K K, et al. Axillary ultrasound after neoadjuvant chemotherapy and its impact on sentinel lymph node surgery: results from the American College of Surgeons Oncology Group Z1071 trial(Alliance)[J]. J Clin Oncol, 2015, 33(30): 3386-3393.
MOEHRLE M, BREUNINGER H, TAÏEB A, et al. 3D histology: a micrographic surgical technique suitable for French dermatologists and pathologists in private and hospital practice[J]. Ann Dermatol Venereol, 2007, 134(1): 87-93.
ABE H, SCHMIDT R A, KULKARNI K, et al. Axillary lymph nodes suspicious for breast cancer metastasis: sampling with US-guided 14-gauge core-needle biopsy-clinical experience in 100 patients[J]. Radiology, 2009, 250(1): 41-49.
FRIDMAN V, HUMBLET C, BONJEAN K, et al. Assessment of tumor angiogenesis in invasive breast carcinomas: absence of correlation with prognosis and pathological factors[J]. Virchows Arch, 2000, 437(6): 611-617.
MATSUZAWA F, EINAMA T, ABE H, et al. Accurate diagnosis of axillary lymph node metastasis using contrast-enhanced ultrasonography with Sonazoid[J]. Mol Clin Oncol, 2015, 3(2): 299-302.
ZHAO J, ZHANG J, ZHU Q L. The value of contrast-enhanced ultrasound for sentinel lymph node identification and characterisation in pre-operative breast cancer patients: a prospective study[J]. Eur Radiol, 2018, 28(4): 1654-1661.
MORI N, MUGIKURA S, MIYASHITA M, et al. Perfusion contrast-enhanced ultrasound to predict early lymph-node metastasis in breast cancer[J]. Jpn J Radiol, 2019, 37(2): 145-153.
ZHONG J, SUN D S, WEI W, et al. Contrast-enhanced ultrasound-guided fine-needle aspiration for sentinel lymph node biopsy in early-stage breast cancer[J]. Ultrasound Med Biol, 2018, 44(7): 1371-1378.
LI J, LU M, CHENG X, et al. How pre-operative sentinel lymph node contrast-enhanced ultrasound helps intra-operative sentinel lymph node biopsy in breast cancer: initial experience[J]. Ultrasound Med Biol, 2019, 45(8): 1865-1873.
RUBALTELLI L, KHADIVI Y, TREGNAGHI A, et al. Evaluation of lymph node perfusion using continuous mode harmonic ultrasonography with a second-generation contrast agent[J]. J Ultrasound Med, 2004, 23(6): 829-836.
LUPARIA A, CAMPANINO P, COTTI R, et al. Role of axillary ultrasound in the preoperative diagnosis of lymph node metastases in patients affected by breast carcinoma[J]. Radiol Med, 115(2): 225-237.
LUMACHI F, TREGNAGHI A, FERRETTI G, et al. Accuracy of ultrasonography and 99mTc-sestamibi scintimammography for assessing axillary lymph node status in breast cancer patients. A prospective study[J]. Eur J Surg Oncol, 2006, 32(9): 933-936.
FEU J, TRESSERRA F, FÁBREGAS R, et al. Metastatic breast carcinoma in axillary lymph nodes: invitro US detection[J]. Radiology, 1997, 205(3): 831-835.