最新抗肿瘤新药及新适应证 你需要了解!
国内上市新药或新适应证
10月9日,国家药品监督管理局(NMPA)批准又一款利妥昔单抗生物类似药用于治疗弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤及慢性淋巴细胞性白血病。
10月17日,NMPA批准托珠单抗注射液用于成年和2岁及以上儿童患者由CAR-T细胞引起的重度或危及生命的细胞因子释放综合征(CRS)。
10月28日,NMPA批准阿替利珠单抗联合贝伐珠单抗用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者。
美国获批新药或新适应证
10月2日,美国食品药品监督管理局(FDA)批准纳武利尤单抗联合伊匹木单抗用于既往未经治疗的、不可切除的恶性胸膜间皮瘤(MPM)患者。
10月14日,美国FDA批准帕博利珠单抗用于:①单药治疗复发性或难治性经典型霍奇金淋巴瘤(cHL)成人患者;②难治性cHL,或经二线及二线以上治疗后复发的cHL儿童患者。
国内获批新药或新适应证
1
利妥昔单抗生物类似药在中国获批上市
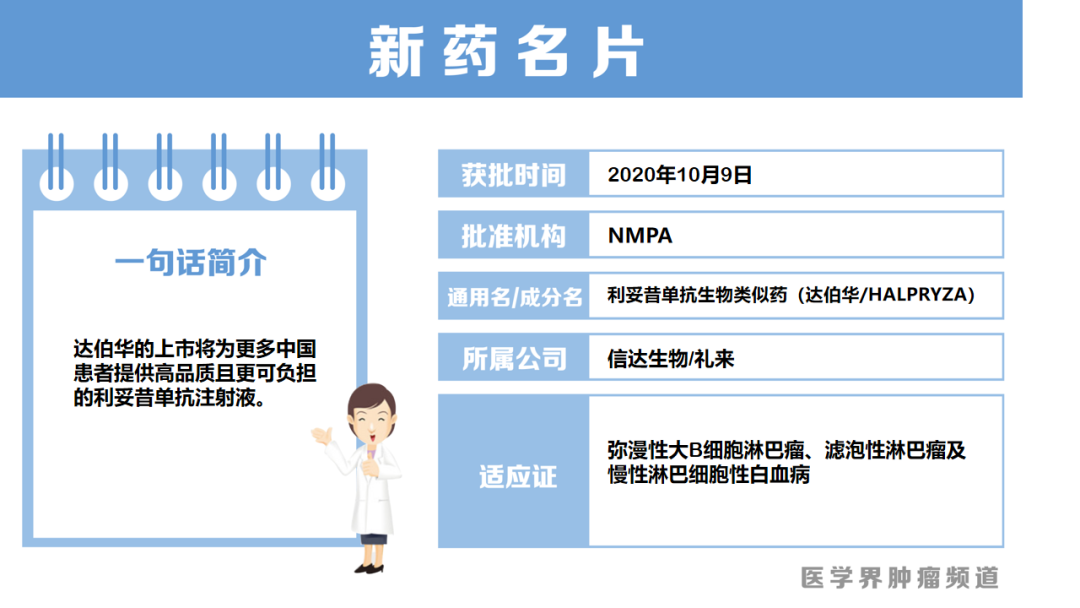
10月9日,信达生物和礼来共同宣布,重组人-鼠嵌合抗CD20单克隆抗体注射液(利妥昔单抗注射液)正式获得NMPA的上市批准,用于治疗弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤及慢性淋巴细胞性白血病。
利妥昔单抗的多个大型确证性临床试验数据充分地证实了其在CD20阳性的非霍奇金淋巴瘤的临床疗效和安全性,已成为CD20阳性的非霍奇金淋巴瘤的标准治疗。
原研药利妥昔单抗注射液自上市以来,全球已批准其用于治疗包括非霍奇金淋巴瘤(NHL)、慢性淋巴细胞性白血病(CLL)、类风湿性关节炎(RA)、血管炎肉芽肿(GPA)、显微镜下多血管炎(MPA)、中重度成人天疱疮(PV)等多个适应证,其显著的疗效和良好的安全性已得到普遍认可,期待其生物类似药的上市能给中国患者带来更多的新治疗选择。
2
托珠单抗获批用于CAR-T引发的细胞因子释放综合征
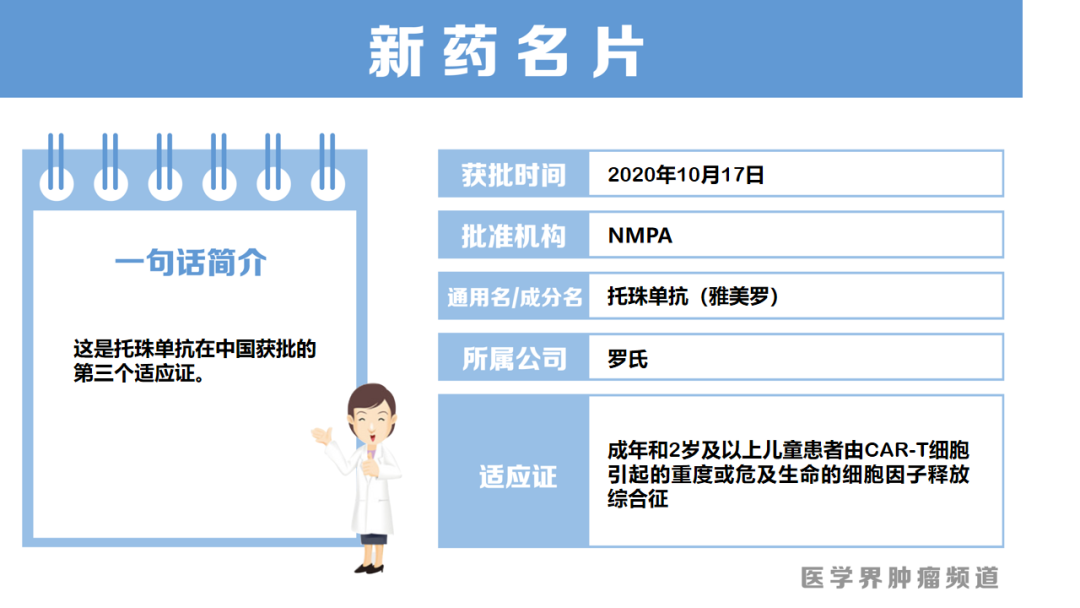
10月17日,罗氏制药中国宣布,NMPA批准其托珠单抗注射液新适应证——用于成年和2岁及以上儿童患者由CAR-T细胞引起的重度或危及生命的CRS。
CRS是CAR-T或其他免疫疗法治疗过程中,细胞因子过度释放引起的机体炎症风暴,也是CAR-T最常见的严重不良反应之一。托珠单抗新适应证此次免临床试验极速获批,是基于全球两家CAR-T公司提供的CAR-T细胞疗法治疗血液系统疾病的临床试验数据,其有效评估了该药治疗CRS的疗效。
3
阿替利珠单抗联合贝伐珠单抗在中国获批用于治疗肝细胞癌

10月28日,罗氏宣布中国NMPA批准其肿瘤免疫创新药物阿替利珠单抗联合贝伐珠单抗(以下简称“T+A”联合疗法)用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者。此次获批的主要依据是III期临床试验IMbrave150的研究结果,其中包括对194名中国亚群患者的分析。
研究结果表明,与标准治疗相比,“T+A”联合疗法显著降低死亡风险以及疾病进展和死亡风险,且患者报告的生活质量和功能发生恶化的时间均优于标准治疗。入组IMbrave150研究的中国亚群的患者数据与全球结果一致。“T+A”的安全性与此前单独用药已知安全性特征一致,未发现任何新的安全信号。上述结果已于2020年5月14日发表于《新英格兰医学杂志》。
美国上市新药或新适应证
4
“O+Y”组合获批用于恶性胸膜间皮瘤一线治疗
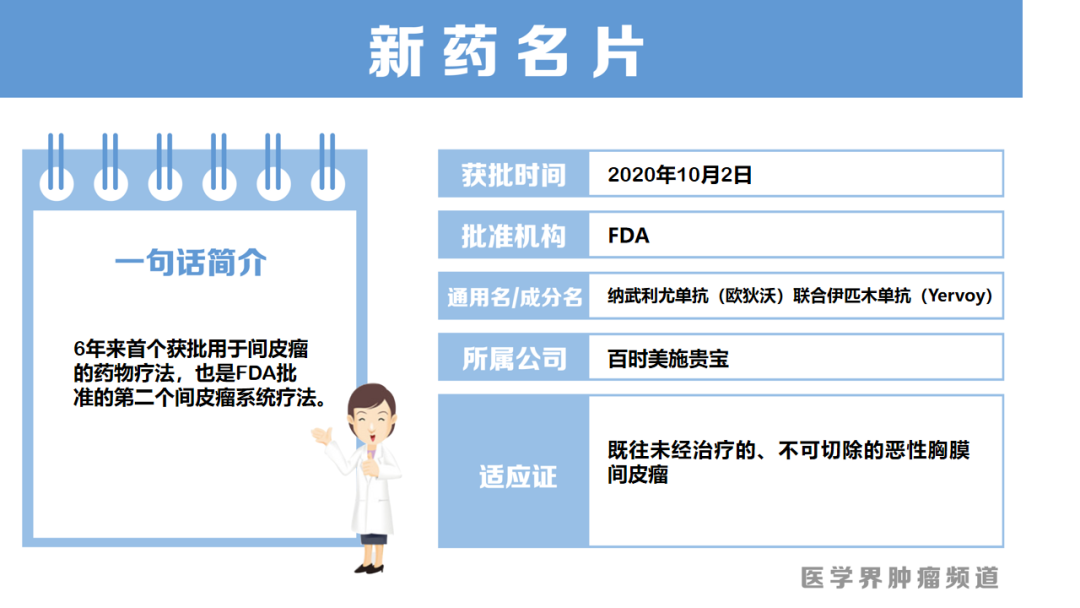
10月2日,美国FDA批准纳武利尤单抗(O药)联合伊匹木单抗(Y药)用于既往未经治疗的、不可切除的恶性胸膜间皮瘤(MPM)患者,这是16年来首个获批用于间皮瘤的药物疗法,也是FDA批准的第二个间皮瘤系统疗法。
该批准是基于CheckMate-743研究的预设期中分析的结果。CheckMate-743是一项开放标签、多中心、随机、III期临床研究,共605名先前未经治疗、肿瘤不可切除的MPM患者,目的是确定与化疗相比,该组合能否改善总生存期(OS)。
结果显示,在随访至少22.1个月后,双免疫治疗组(n=303)患者的OS优于含铂标准化疗组(n=302)(HR=0.74,95%CI:0.61-0.89;p=0.002),双免疫治疗组的中位OS为18.1个月(95%CI:16.8-21.5),化疗组为14.1个月(95%CI:12.5-16.2)。双免疫治疗组患者2年生存率为41%,而化疗组仅为27%。
5
K药获批单药治疗复发/难治性经典型霍奇金淋巴瘤
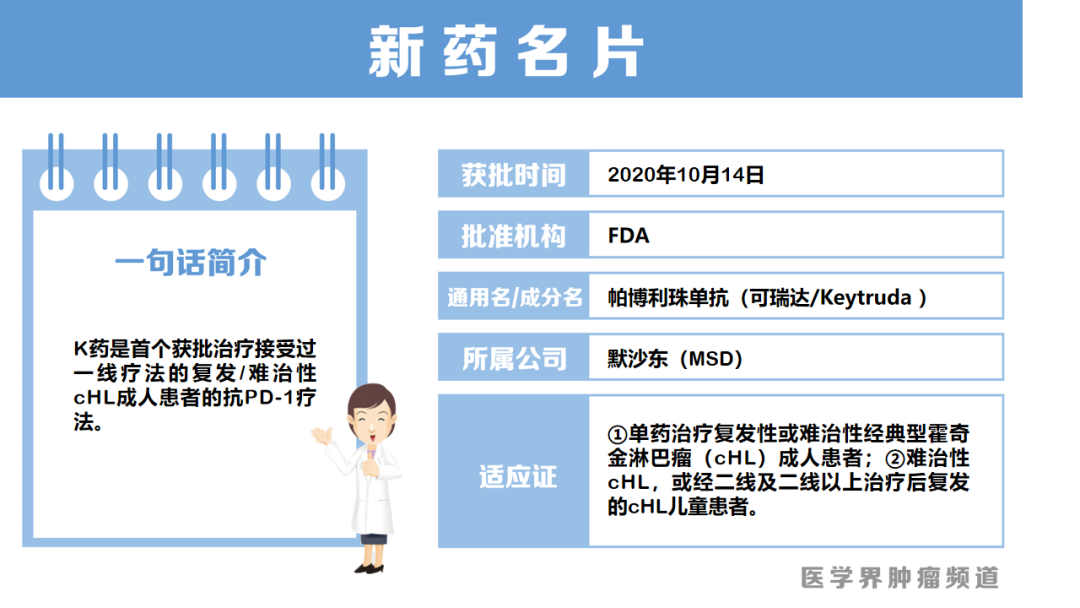
10月14日,默沙东(MSD)宣布其PD-1单抗帕博利珠单抗(K药)获得美国FDA批准扩大新适应证,单药治疗复发性或难治性经典型霍奇金淋巴瘤(cHL)成人患者。FDA同时还批准了帕博利珠单抗用于难治性cHL,或经二线及二线以上治疗后复发的cHL儿童患者。
此次获批使得K药成为首个获批治疗接受过一线疗法的复发/难治性cHL成人患者的抗PD-1疗法。
此次批准,是基于III期临床试验KEYNOTE-204的结果,与目前标准疗法相比,K药使患者疾病进展或死亡风险显著降低了35%(HR=0.65,95%CI:0.48-0.88;p<0.0027)。接受帕博利珠单抗治疗的患者的中位无进展生存期为13.2个月(95%CI:10.9-19.4),而接受标准疗法治疗的患者的无进展生存期为8.3个月(95%CI:5.7-8.8)。
参考资料
[1]https://mp.weixin.qq.com/s/EreuyQDGJhdjvV3qMTTncw
[2]https://mp.weixin.qq.com/s/mrDYgcfazLLd6NZ3YLUrIw
[3]https://mp.weixin.qq.com/s/rvNlVf6t4H6WrhGUuCGOrg
[4]https://mp.weixin.qq.com/s/hPySrBIQsPCWj9kWSNsk9w
[5]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-nivolumab-and-ipilimumab-unresectable-malignant-pleural-mesothelioma
[6]https://mp.weixin.qq.com/s/e-Z1-ciblZnFmpmvcTijvA
[7]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-extends-approval-pembrolizumab-classical-hodgkin-lymphoma