中国首个地贫基因编辑临床试验申请获受理!PD-1抗体一线治疗HL再证疗效!
要点一览
1. The Lancet Haematology:靶向CD19 CAR-T细胞治疗R/R ALL患者均有较高应答,但不同细胞构建体疗效仍待进一步评估
2. Clinical Cancer Research:基于前瞻性随机II期NIVAHL临床研究中PET数据的疗效评估,PD-1抗体作为HL一线治疗具有显著疗效
3. Clinical Cancer Research: Onvansertib联合地西他滨治疗R/R AML 疗效良好
4. ACS JOURNALS: Crenigacestat用于T-ALL患者的I期临床研究结果显示疗效有限
5. 新药:Olutasidenib单药治疗携带IDH1突变的R/R AML患者具有良好的耐受性
6. 新药:中国首个治疗地贫基因编辑新药临床试验申请获受理
>>>> 1. The Lancet Haematology:靶向CD19 CAR-T细胞治疗R/R ALL患者均有较高应答,但不同细胞构建体疗效仍待进一步评估
近日,一篇针对靶向CD19 嵌合抗原受体T细胞(CAR-T)免疫治疗对急性淋巴细胞白血病(ALL)患者疗效的系统分析发表在 The Lancet Haematology 杂志,该文章进一步对影响患者预后差异的相关因素进行了总结。

本文作者对2012年1月1日至2020年4月14日期间开展的针对成人或儿童的复发难治性ALL(R/R ALL)患者应用的靶向CD19 CAR-T细胞治疗临床试验数据进行了系统回顾和荟萃分析。该研究未在PROSPERO中注册,在排除了病例数≤2例患者的研究后,研究人员从1160项研究中最终确定了40项可能合适的研究,其中35项(88%)符合资格标准并纳入了最终分析(共953例患者)。研究的主要结局是输注靶向CD19 CAR-T细胞后任何时间完全缓解(CR)的患者数。
该研究结果显示:合并的CR率为80%(95%CI 75.5-84.8),研究之间的异质性中等(I2 = 56.96%)。在预先指定的亚组分析中,195/263例成人患者(占75%)和242/346例儿童患者(占81%)达到了CR(P=0.24)。合并CR率与靶向CD19 CAR-T细胞构建体类型或单链可变片段克隆无显著差异,但自体较异基因T细胞起源的产品具有更高的CR率(83% vs 55%,P=0.018)。其中≥3级的细胞因子释放综合征发生率为26%,≥3级神经毒性发生率为12%。在不同的靶向CD19 CAR-T细胞构建体之间,达到CR或患有细胞因子释放综合征或神经毒性的患者比例没有差异。
该研究结果提示靶向CD19 CAR-T细胞疗效在R/R ALL成人及儿童中均具有较高应答率,但仍需继续深入研究以确定不同的靶向CD19 CAR-T细胞构建体在R/R ALL患者中的疗效差异。
>>>> 2. Clinical Cancer Research:基于前瞻性随机II期NIVAHL临床研究中PET数据的疗效评估,PD-1抗体作为HL一线治疗具有显著疗效。
前瞻性随机II期临床研究(NIVAHL试验)初步分析显示,在早期不良预后的霍奇金淋巴瘤(HL)中,予以PD-1抗体(nivolumab,N)为基础的一线治疗后患者的中期CR率高。
但是否能用PET测量的生物标志物如代谢肿瘤体积(MTV)或总病变糖酵解(TLG)及其治疗中的变化(∆MTV和∆TLG)提供的相关信息进行疗效评估?对此,研究者们对常规标准以外的免疫检查点抑制剂治疗HL的早期反应进行了分析,相关研究结果近日发表在Clinical Cancer Research杂志上。

该研究纳入了NIVAHL试验中59例具有PET图像数据的患者进行分析,研究结果显示:在中期再分期中,研究者们确定了2×Nivolumab-AVD后A组的平均∆MTV和∆TLG分别为-99.8%,而接受4×Nivolumab的治疗组B平均∆MTV和∆TLG分别为-91.4%和-91.9%,即无论患者最初的淋巴瘤负荷如何,都观察到MTV和TLG的大幅下降。
该研究结果提示:基于Nivolumab的一线治疗可使得早期不良预后的HL患者的肿瘤代谢迅速接近完全缩小,PET衍生的生物标志物用于免疫检查点抑制剂治疗的疗效评估手段可能会有助于减少甚至省略化疗和放疗在HL中的应用。
>>>> 3. Clinical Cancer Research:Onvansertib联合地西他滨治疗R/R AML 疗效良好
Polo样激酶1(PLK1)是有丝分裂的主要调节剂,在急性髓系白血病(AML)中过表达。研究者在R/R AML患者中使用PLK1抑制剂Onvansertib联合低剂量阿糖胞苷(LDAC)或地西他滨进行了Ib期研究,该项研究结果发表在近期的Clinical Cancer Research杂志上。

该研究中共40例R/R AML患者接受了Onvansertib联合LDAC(N=17)或地西他滨(N=23)的治疗,患者耐受性良好,提示Onvansertib联合地西他滨具有良好的耐受性,并具有抗白血病活性。
>>>> 4. ACS JOURNALS:Crenigacestat用于T-ALL患者的I期临床研究结果显示疗效有限。
Notch信号失调与T细胞免疫表型急性淋巴细胞白血病(T‐ALL)/ T细胞淋巴母细胞性淋巴瘤(T‐LBL)相关。Crenigacestat(LY3039478)可以抑制Notch蛋白的裂解,可能会使复发/难治的T/ALL/T-LBL的患者获益。
JJCB是一项针对成人R/R T-ALL/T-LBL患者的多中心、非随机、开放标签、剂量递增的I期临床研究。该研究中共有36例T-ALL(N=31)或T-LBL(N=5)患者接受了Crenigacestat联合地塞米松的方案治疗。
研究结果显示:6例患者(16.7%)经历了剂量限制性毒性(DLT), 28例患者(77.8%)经历了1次或更多次与研究治疗相关的不良事件(AE),其中1例患者(2.8%)的反应持续时间为10.51个月, 6例(16.7%)患者病情稳定,12例患者(33.3%)病情进展,其余17例患者(47.2%)无法评估。所有患者的中位无事件生存期为(EFS)为1.18个月。
该研究结果提示Crenigacestat在R/R T-ALL/T-LBL的成人患者中疗效有限。

>>>> 5. 新药:Olutasidenib单药治疗携带IDH1突变的R/R AML患者具有良好的耐受性
异柠檬酸脱氢酶1(IDH1)选择性抑制剂Olutasidenib是一种口服、强效、小分子在研药物,可选择性结合并抑制突变的IDH1酶。Forma Therapeutics公司日前宣布了Olutasidenib治疗R/R AML的一项注册性II期临床研究的中期分析中的数据。
数据分析显示:在这项纳入123例R/R AML患者的临床研究中,中期数据分析前患者至少接受了6个月Olutasidenib的治疗;其中Olutasidenib单药治疗携带IDH1突变的R/R AML患者具有良好的耐受性,主要疗效终点复合CR率为33.3%,其中CR率为30%。
另外,一项敏感性分析结果显示,Olutasidenib单药治疗携带IDH1突变的R/R AML患者达到CR/CRh后,该疗效的中位持续时间为13.8个月。
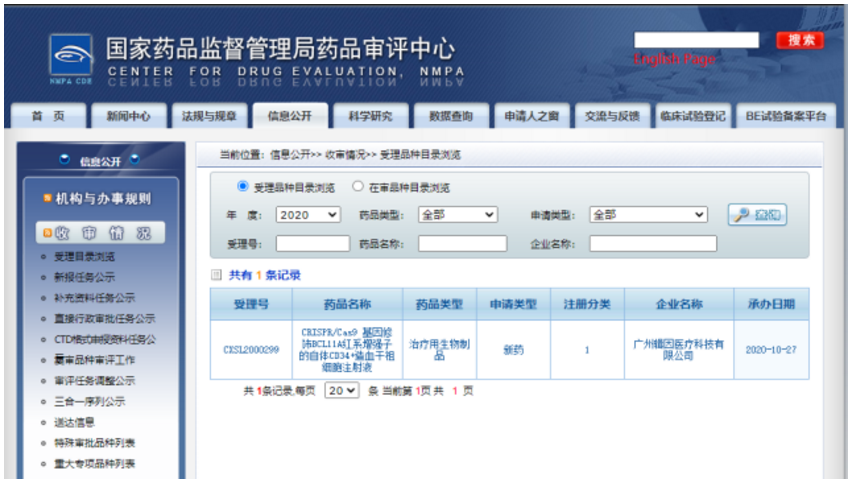
>>>> 6. 中国首个治疗地贫基因编辑新药临床试验申请获受理
10月27日国家药品监督管理局药品审评中心已经受理了针对输血依赖型&β;地中海贫血的基因编辑疗法产品ET-01的临床试验申请,此项临床试验计划在输血依赖型&β;地中海贫血患者中评价ET-01单次移植的安全性和有效性,这是国内首个获得受理的基因编辑疗法临床试验申请。
本周专家视角
靶向CD19 CAR-T细胞疗法在成人和儿童的R/R ALL患者中均具有较高的应答率,证明了该疗法是适合于R/R ALL有效治疗手段。
PET衍生的生物标志物(MTV和TLG)作为疗效评估显示出了Nivolumab作为早期不良预后HL患者的一线治疗的具有令人鼓舞的疗效。
Onvansertib联合地西他滨在R/R AML患者中具有良好的耐受性,IDH抑制剂Olutasidenib伴IDH突变的R/R AML患者具有良好的耐受性,上述两种药有望为这类患者提供新的治疗选择。
Crenigacestat在R/R T-ALL/T-LBL的成人患者中疗效有限。
中国首个治疗地贫基因编辑新药临床试验申请获受理或能为输血依赖型&β;地中海贫血患者带来新希望。