土木香内酯抑制食管癌EC9706细胞的增殖、迁移和侵袭并促进其凋亡
土木香内酯抑制食管癌EC9706细胞的增殖、迁移和侵袭并促进其凋亡
王紫洁,胡 庆,陈 欢,李 婷,李 强,邓明明
Alantolactone inhibits proliferation, migration and invasion of esophageal cancer EC9706 cells and promotes its apoptosis
WANG Zijie, HU Qing, CHEN Huan, LI Ting, LI Qiang, DENG Mingming
作者单位
西南医科大学附属医院消化内科,四川 泸州 646000
基金项目
1. 四川省科技基金项目(编号:2016JY0101)
2. 四川省泸州市科技基金项目(编号:2019-RCM-97)
AUTHORS FROM
Department of Gastroenterology, Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan Province, China
GRANT
1. Science and Technology Fund Project of Sichuan Province(No. 2016JY0101)
2. Science and Technology Fund Project of Sichuan Luzhou(No. 2019-RCM-97)
[摘要]
目的:研究土木香内酯(alantolactone)对食管癌EC9706细胞增殖、迁移、侵袭及凋亡的影响,并探讨可能的作用机制。
方法:用不同浓度的土木香内酯处理食管癌EC9706细胞,以DMSO处理的EC9706细胞作为对照组。分别用结晶紫染色法、MTT法和克隆形成实验检测土木香内酯对EC9706增殖能力的影响;划痕愈合实验和Transwell小室法检测对EC9706细胞迁移和侵袭能力的影响;Hoechst 33258染色法检测对EC9706细胞凋亡的影响。蛋白印迹法检测侵袭转移相关蛋白基质金属蛋白酶7(matrix metalloproteinase-7,MMP-7)、MMP-9、波形蛋白(Vimentin)和Snail,以及凋亡相关蛋白Bax、Bcl-2、剪切型-半胱天冬酶 3(cleaved-半胱天冬酶 3)、半胱天冬酶 3蛋白的表达水平。分别采用荧光素酶报告法和蛋白印迹法检测Wnt/&β;-catenin信号通路的活性及相关蛋白&β;-连环蛋白(&β;-catenin)、细胞周期相关蛋白D1(cyclin D1)和c-Myc的表达水平。
结果:与对照组相比,土木香内酯可以明显抑制EC9706细胞的增殖、迁移和侵袭能力,并促进细胞凋亡(P 值均<0.01),呈剂量和时间效应关系。不同浓度的土木香内酯均能上调凋亡相关蛋白Bax、cleaved-半胱天冬酶 3和半胱天冬酶 3的表达水平(P 值均<0.01),下调抗凋亡蛋白Bcl-2、侵袭转移相关蛋白MMP-7、MMP-9、Vimentin和Snail的表达水平(P 值均<0.01)。荧光素酶报告系统显示,土木香内酯能使T细胞因子/淋巴增强因子(T-cell factor/lymphoid enhancer factor,TCF/LEF)的转录活性明显下降(P<0.01);蛋白质印迹法检测结果显示土,木香内酯能明显抑制&β;-catenin、cyclin D1和c-Myc蛋白的表达水平(P值均<0.01)。
结论:土木香内酯可能通过抑制Wnt/&β;-catenin信号通路的活性,抑制EC9706细胞的增殖、迁移和侵袭,并促进其凋亡。
[关键词]食管肿瘤;土木香内酯;细胞增殖;细胞凋亡;细胞运动
[ABSTRACT]
Objective: To investigate the effects of alantolactone on proliferation, migration, invasion and apoptosis of esophageal cancer EC9706 cells, to explore the possible mechanisms.
Methods: EC9706 cells were treated with different concentrations alantolactone, the proliferation was detected by crystal violet staining, MTT assay and colony forming assay, the migration and invasion abilities were detected by wound healing and Transwell assay, the apoptosis was detected by Hoechst 33258 staining assay. The expression levels of migration and invasion related proteins matrix metalloproteinase-7(MMP-7), MMP-9, Vimentin and Snail, apoptosis related proteins Bcl-2, Bax, 半胱天冬酶 3 and cleaved-半胱天冬酶 3 were detected by Western blotting. The transcriptional activity of T-cell factor/lymphoid enhancer factor(TCF/LEF) was detected by Luciferase Reporter Gene system, then the expression levels of Wnt/&β;-catenin signaling pathway-related proteins c-Myc, cyclin D1 and &β;-catenin were detected by Western blotting.
Results: Compared with the control group, alantolactone could significantly inhibit the proliferation, migration and invasion of EC9706 cells, and could promote the apoptosis of EC9706 cells in a dose-time dependent manner(all P < 0.01). Western blotting results showed that alantolactone could up-regulate the expression levels of Bax, cleaved-半胱天冬酶 3 and 半胱天冬酶 3(all P < 0.01), and down-regulate the expression levels of MMP-7, MMP-9, Bcl-2, Vimentin and Snail(all P < 0.01). The transcription activity of TCF/LEF was significantly decreased(P < 0.01), and it could inhibit the expression level of &β;-catenin, cyclin D1 and c-Myc(all P < 0.01).
Conclusion: The activity of Wnt/&β;-catenin signaling pathway may be inhibited by alantolactone, It can inhibit the proliferation, migration and invasion of EC9706 cells and promote its apoptosis.
[Key words]Esophageal neoplasms; Alantolactone; Cell proliferation; Apoptosis; Cell movement
全球食管癌发病率呈上升趋势,是世界上普遍性恶性肿瘤的第8位,也是全球第6大死亡原因[1]。全世界约有80%的病例出现在发展中国家,其中男性发病率是女性的3倍[2]。食管腺癌和食管鳞状细胞癌是世界上最常见的食管癌[3]。目前,治疗晚期食管癌的方法大多是手术和放化疗相结合,但食管癌的存活率仍<30%[4]。另一方面,化疗也带来了一系列严重的不良反应,包括胃肠毒性、白细胞减少、吞咽困难和肾损害等,通常需要中断治疗,限制了其应用。因此,需要进一步找到更有效的药物,以减少不良反应并提高患者的生存率和生存质量。
当前,有关新型天然抗肿瘤药物的开发已引起关注[5]。土木香内酯(alantolactone)是从菊粉根中提取的中药[6]。越来越多的证据证实,土木香内酯具有抗肿瘤 [7]、抗神经尿炎性反应[8]和抗菌性[9]等多种药理活性。有研究提示,土木香内酯可以以诱导活性氧(reactive oxygen species,ROS)产生和DNA损伤的方式产生抗肿瘤作用[9]。土木香内酯还可以选择性地抑制信号转导及转录激活因子3(signal transducer and activator of transcription3,STAT3)的活性并显示出有效的抗肿瘤活性[10]。尽管有数项研究报道了土木香内酯介导的抗肿瘤机制,但目前尚不清楚其在食管癌中的直接作用机制。因此,本研究旨在探讨土木香内酯对人食管癌细胞的抗肿瘤效应以及可能的分子作用机制。本研究结果表明,土木香内酯可能在体外发挥抑制食管癌细胞的作用。此外,土木香内酯对食管癌细胞的抑制作用可能与其抑制Wnt/&β;-Catenin信号通路的活性有关。
1 材料与方法
1.1
细胞及试剂
人食管癌EC9706细胞由西南医科大学医学实验中心保存,培养于含10%胎牛血清及双抗(青霉素和链霉素)的RPMI 1640培养液中。
RPMI 1640培养液购自美国HyClone公司,胎牛血清购自以色列Biological Industries公司,青霉素和链霉素购自美国Gibco公司。土木香内酯购自成都瑞芬思生物科技有限公司,用DMSO(购自上海碧云天生物技术有限公司)溶解分装后-80 ℃保存。MTT试剂购自美国σ公司,结晶紫染色液购自北京索莱宝科技有限公司。兔抗人半胱天冬酶 3、剪切型-半胱天冬酶 3(cleaved-半胱天冬酶 3)、基质金属蛋白酶7(matrix metalloproteinase-7,MMP-7)、MMP-9、&β;-连环蛋白(&β;-catenin)、细胞周期蛋白D1(cyclin D1)和c-Myc单克隆抗体以及鼠抗人波形蛋白(Vimentin)、Snail、Bcl-2和Bax单克隆抗体均购自美国Abcam公司,辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG(二抗)、鼠抗人&β;-actin单克隆抗体、Hoechst 33258染色液、0.25%胰蛋白酶细胞消化液、BCA蛋白浓度测定试剂框购自上海碧云天生物技术有限公司,Transwell小室和Matrigel购自美国Corning公司。LipofectAMINE 3000购自美国Invitrogen公司,荧光素酶报告基因检测系统中使用的质粒p-BGlucTCF/LEF购自上海翊圣生物技术有限公司,荧光素酶检测试剂框购自美国New England Biolabs公司。
倒置荧光显微镜(TE2000)为日本Nikon公司产品,流式细胞仪为美国Beckman Coulter公司产品,酶联免疫检测仪为西班牙VIRCELL公司产品。
1.2
土木香内酯对EC9706细胞增殖的影响
1.2.1
结晶紫染色法
将生长良好的EC9706细胞接种于24孔板中(3×104个/孔),待细胞贴壁生长后,用不同浓度的土木香内酯(5、8、11和14 μmol/L)处理EC9706细胞24、48和72 h;以未用任何药物处理的EC9706细胞作为空白对照组[土木香内酯(0 μmol/L)],以体积分数为0.6‰的DMSO处理EC9706细胞作为对照组,每组均设置3个复孔。用结晶紫染色后观察细胞生长情况,并行定量分析;实验结束时加入20%乙酸溶液将培养孔中的结晶紫充分溶解,随后在酶联免疫检测仪波长595 nm处检测各孔的D值,并计算细胞的细胞生长率。细胞生长率(%)=实验组D值/对照组D值×100%。
1.2.2
MTT法
取长势良好的食管癌EC9706细胞用胰蛋白酶消化后接种于96孔板中(3×103个/孔),置于37 ℃、CO2体积分数为5%的培养箱中培养12 h后,加入土木香内酯处理细胞,实验分组及细胞处理同1.2.1节,每组设置3个复孔。在培养24和48 h后,加入10 μL/孔的MTT(5 mg/mL)再置于培养箱中处理4 h;除去96孔板中的所有培养液,加入DMSO(100 μL/孔),摇床上避光振摇10 min后,在酶联免疫检测仪波长492 nm处检测各孔的D值,并计算半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.2.3
平板克隆形成实验
用胰蛋白酶消化生长良好的EC9706细胞并接种于6孔板中(500个/孔),加入不同浓度的土木香内酯(0、1、2、3和4 μmol/L)处理细胞,以未用任何药物处理的EC9706细胞作为空白对照组,以用体积分数为0.6‰ DMSO处理的EC9706细胞作为对照组,每组设3个复孔。将细胞置于37 ℃、CO2体积分数为5%的培养箱中进行培养,7 d后除去培养液,用4%多聚甲醛溶液固定细胞20 min,然后用结晶紫染色液染色10 min;光学显微镜下计数细胞个数>50个的克隆形成数(以细胞数>50个计为一个克隆)。克隆形成率(%)=克隆形成个数/接种细胞数×100%。
1.3
土木香内酯对EC9706细胞迁移、侵袭及相关蛋白表达的影响
1.3.1
划痕愈合实验
将长势良好的EC9706细胞接种于6孔板中,培养至每个孔的细胞融合度为100%后,用10
μL的枪头垂直于孔板呈“一”字形划痕,尽量保证6个孔的划痕宽度一致,除去培养液;用PBS冲洗划痕过程中划落的细胞,在倒置光学显微镜下观察划痕情况并拍照记录。细胞分组及药物处理的方法同1.2.1节,每组设置3个复孔;分别于0、12和24 h时记录相同划痕位置下划痕宽度的变化,并计算划痕愈合率。划痕愈合率(%)=(0 h时划痕宽度-24 h时划痕宽度)/0 h划痕宽度×100%。
1.3.2
Transwell小室实验
用不含血清和抗生素的RPMI 1640培养液稀释基质胶(体积稀释比例为1∶5),取30 μL稀释后的基质胶铺设于Transwell的上室膜上,待其凝固。在24孔板中加入无血清的RPMI 1640培养液,并将小室置于24孔培养板中。将EC9706细胞接种于基质胶已经凝固的上室中,细胞分组及药物处理的方法同1.2.1节,每组设置3个复孔。细胞培养24 h后,取出Transwell小室,擦去未穿过小室膜的细胞;加入4%多聚甲醛溶液固定细胞20 min,然后行结晶紫染色;用PBS冲洗细胞2次,将小室置于光学显微镜下(放大倍数为100倍)任意选择3个视野计算穿过小室膜的细胞数目。
1.3.3
蛋白质印迹法检测侵袭转移相关蛋白的表达水平
将EC9706细胞-接种于培养皿中,用不同浓度的土木香内酯(5、8和14μmol/L)处理EC9706细胞24 h,以未用任何药物处理的EC9706细胞作为空白对照组[土木香内酯(0 μmol/l)],以体积分数为0.6‰的DMSO处理EC9706细胞作为对照组。将培养皿中的细胞刮下后收集至EP管中,加入蛋白质裂解缓冲液混匀,提取蛋白;100 ℃水浴处理后保存于 -80 ℃冰箱中备用。用BCA试剂框测量蛋白质浓度,取适量蛋白行8%~12% SDS-PAGE分离蛋白,并将分离后的蛋白转移至PVDF膜上。膜用含5%脱脂牛奶的封闭液封闭处理2 h,加入一抗[兔抗人MMP-7和MMP-9单克隆抗体以及鼠抗人Vimentin、Snail和&β;-actin单克隆抗体(体积稀释比例均为 1∶1 000)] 4 ℃孵育过夜;用PBST洗膜3次,然后加入二抗[辣根过氧化物酶标记的山羊抗兔IgG 或山羊抗鼠 IgG(体积稀释比例为1∶5 000)]孵育2 h。最后使用电化学发光成像分析系统显影,用ImageLab 6.0.0 软件分析各目的蛋白条带的灰度值。以目蛋白条带与内参照&β;-actin蛋白条带灰度值之比表示目的蛋白的相对表达水平。
1.4
土木香内酯对EC9706细胞凋亡及相关蛋白表达的影响
采用Hoechst 33258染色检测土木香内酯对EC9706细胞凋亡的影响。将EC9706细胞接种于24孔板(3×104细胞/孔)中,细胞分组及药物处理的方法同1.3.3节,每组设置3个复孔;待土木香内酯处理细胞24 h后,除去培养液,加入4%多聚甲醛溶液固定细胞20 min;再除去多聚甲醛溶液,加入用PBS稀释后的Hoechst 33258染色液(体积稀释比例为1∶1 000)200 μL/孔。最后在荧光显微镜下观察细胞的状态(凋亡细胞的形态为呈致密浓染或呈碎块状致密浓染),并计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
随后,进一步采用蛋白质印迹法检测土木香内酯对凋亡相关蛋白cleaved-半胱天冬酶3、半胱天冬酶 3、Bcl-2和Bax表达水平的影响。蛋白质印迹法检测流程同1.3.3节,一抗为兔抗人cleaved-半胱天冬酶 3、半胱天冬酶 3单克隆抗体以及鼠抗人Bcl-2、Bax和&β;-actin单克隆抗体(体积稀释比例均为 1∶1 000)。
1.5
土木香内酯对EC9706细胞中TCF/LEF活性及相关蛋白的表达水平的影响
采用荧光素酶报告基因法检测Wnt/&β;-catenin信号通路中T细胞因子/淋巴增强因子(T-cell factor/lymphoid enhancer factor,TCF/LEF)的活性。将EC9706细胞培养在D60培养皿中,待细胞生长至融合度为80%时,根据LipofectAMINE 3000说明书提供的操作步骤将质粒p-BGlucTCF/LEF转入细胞;4 h后更换培养液,继续培养24 h;收集并消化细胞,以5×104个/孔的密度将细胞接种到24孔板中,并用不同浓度的土木香内酯或DMSO处理细胞24 h,细胞分组及药物处理的方法同1.3.3节。然后,通过使用荧光素酶报告基因检测系统试剂框来测定荧光素酶活性,以此反映TCF/LEF转录活性。
随后,进一步采用蛋白质印迹法检测土木香内脂对Wnt/&β;-catenin通路相关蛋白&β;-catenin、cyclin D1和c-Myc表达水平的影响。蛋白质印迹法检测流程同1.3.3节,一抗为兔抗人&β;-catenin、cyclin D1和c-Myc单克隆抗体以及鼠抗人&β;-actin单克隆抗体(体积稀释比例均为1∶1 000)。
1.6
统计学方法
应用SPSS 21.0软件和Graph Pad Prism 5软件对所有的实验结果进行统计学分析。所有的实验均孤立重复3次,计量资料以 ¡À s表示。各组间比较采用单因素方差分析,组内两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
2 结 果
2.1
土木香内酯抑制食管癌EC9706细胞的增殖
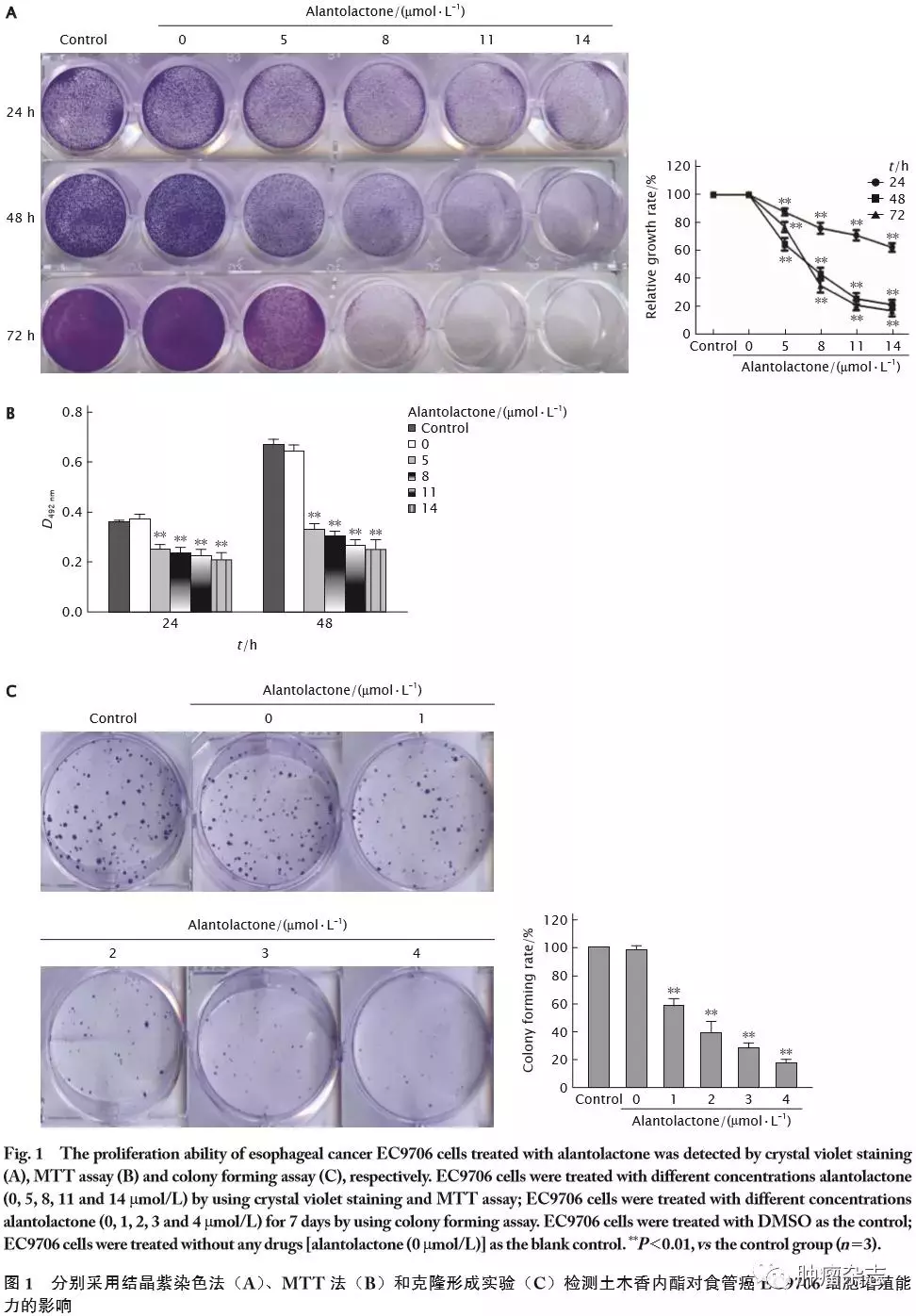
用不同浓度的土木香内酯(5、8、11和14 μmol/L)处理EC9706细胞24、48和72 h后,采用结晶紫染色法检测对EC9706细胞生长的影响。结果(图1A),土木香内酯处理组EC9706细胞的数量较空白对照组和对照组均明显减少,差异具有统计学意义(P 值均<0.01)。
用不同浓度的土木香内酯(5、8、11和14 μmol/L)处理EC9706细胞24和48 h后,采用MTT法检测对EC9706细胞生长的影响。结果(图1B)显示,随着时间的延长、浓度的提高,EC9706细胞的生长率较空白对照组和对照组逐渐减低,差异具有统计学意义(P 值均<0.01);这一结果与结晶紫染色法的检测结果一致。同时,计算结果提示48 h时土木香内酯对EC9706细胞的IC50值为8.104 μmol/L。
随后用克隆形成实验检测低浓度土木香内酯(1、2、3和4 μmol/L)处理7 d后EC9706细胞的集落形成能力。结果(图1C)显示,土木香内酯处理组克隆形成个数随着浓度的增加较空白对照组和对照组而减少,差异具有统计学意义(P 值均<0.01)。
以上结果提示,土木香内酯对EC9706细胞增殖能力具有抑制作用同时抑制克隆形成。
2.2
土木香内酯抑制食管癌EC9706细胞的迁移和侵袭
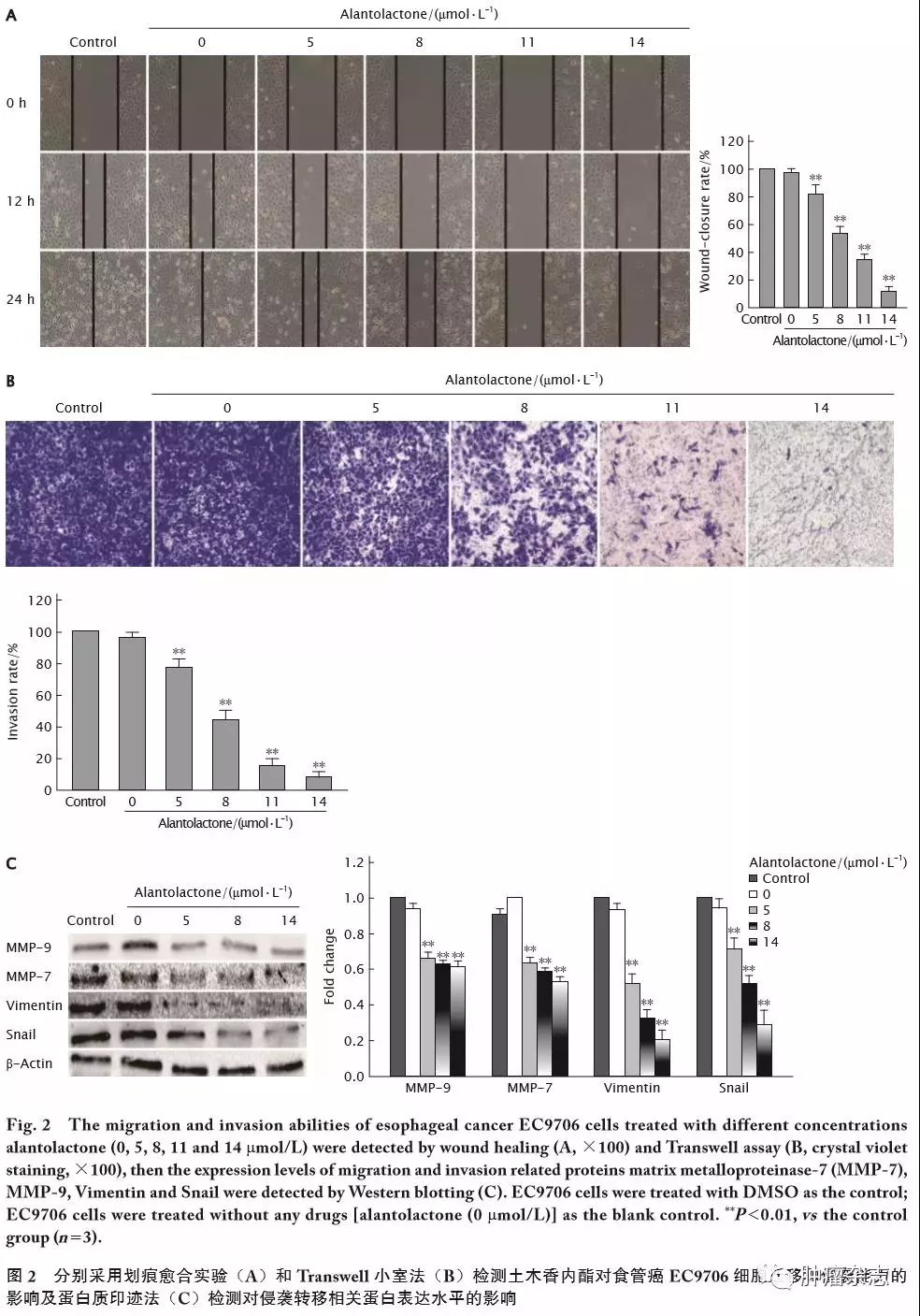
用划痕愈合实验检测土木香内酯(5、8、11和14 μmol/L)对EC9706细胞迁移的影响。结果(图2A)显示,24 h后对照组的划痕愈合率为(97.00±2.25)%,而土木香内酯处理组(5、8、11和14 μmol/L)的划痕愈合率均明显低于对照组,差异具有统计学意义(P 值均<0.01)。
采用Transwell小室法检测土木香内酯对EC9706细胞侵袭能力的影响。结果(图2B)显示,与空白对照组和对照组相比,不同浓度土木香内酯(5、8和14 μmol/L)处理组EC9706细胞的侵袭能力均明显降低,差异具有统计学意义(P 值均<0.01)。
不同浓度的土木香内酯(5、8和14 μmol/L)处理EC9706细胞24 h后,采用蛋白印迹法检测侵袭转移相关蛋白MMP-9、MMP-7、Vimentin和Snail的表达情况。结果(图2C)显示,与空白对照组和对照组相比,不同浓度土木香内酯(5、8、11和14 μmol/L)处理组EC9706细胞中MMP-9、MMP-7、Vimentin和Snail蛋白的表达水平均明显降低,差异具有统计学意义(P 值均<0.01)。
上述结果表明,土木香内酯对EC9706细胞的迁移和侵袭能力具有抑制作用。
2.3
土木香内酯对食管癌EC9706细胞凋亡具有促进作用
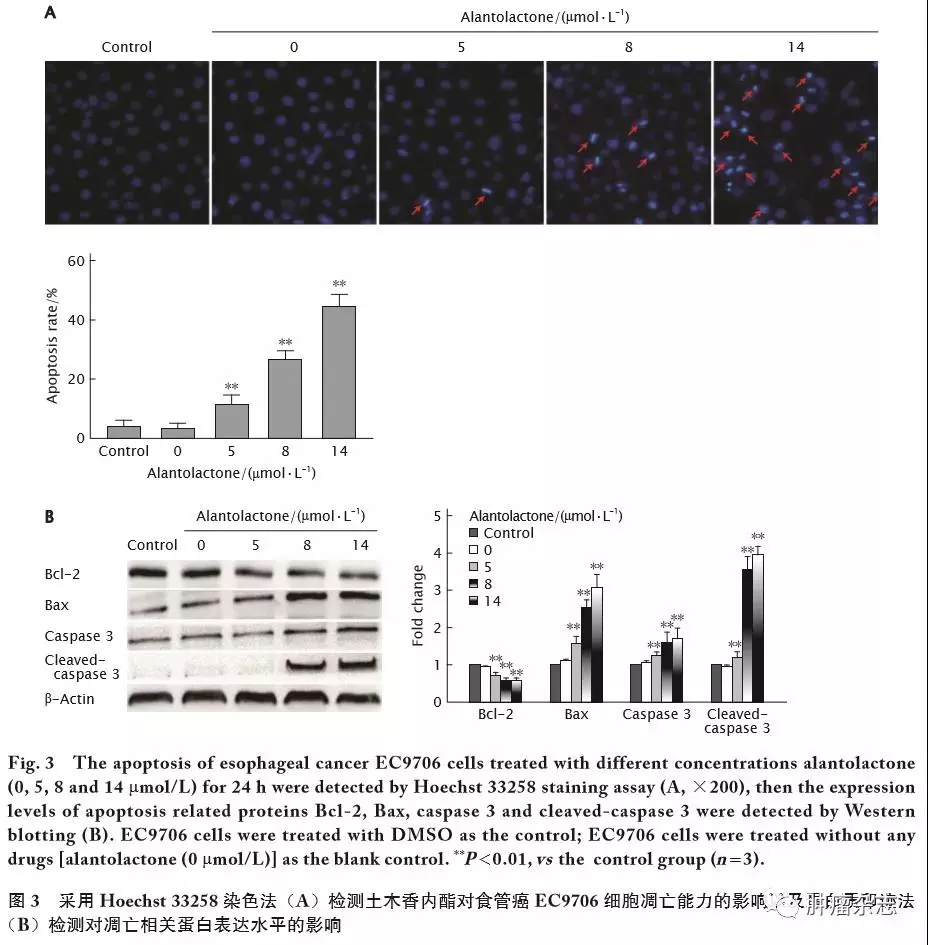
为了评价土木香内酯对EC9706细胞凋亡的影响,采用Hoechst 33258染色法检测EC9706细胞凋亡情况。结果(图3A)显示,土木香内酯处理组EC9706细胞中的细胞核均呈致密浓染或呈碎块状致密浓染;与空白对照组和对照组相比,随着土木香内酯(5、8和14 μmol/L)浓度的提高,发生凋亡的细胞数明显增多,差异具有统计学意义(P 值均<0.01)。
蛋白印迹法检测结果(图3B)显示,随着土木香内酯(5、8和14 μmol/L)处理组浓度的提高抗凋亡相关蛋白Bcl-2表达水平较空白对照组和对照组明显降低(P 值均<0.01),而促凋亡相关蛋白Bax、cleaved-半胱天冬酶 3和半胱天冬酶 3蛋白表达水平均较空白对照组和对照组明显高提高,差异具有统计学意义(P 值均<0.01)。
上述结果表明,土木香内酯对食管癌EC9706细胞的凋亡具有促进作用。
2.4
土木香内酯通过Wnt/&β;-catenin信号通路调节EC9706细胞的生长
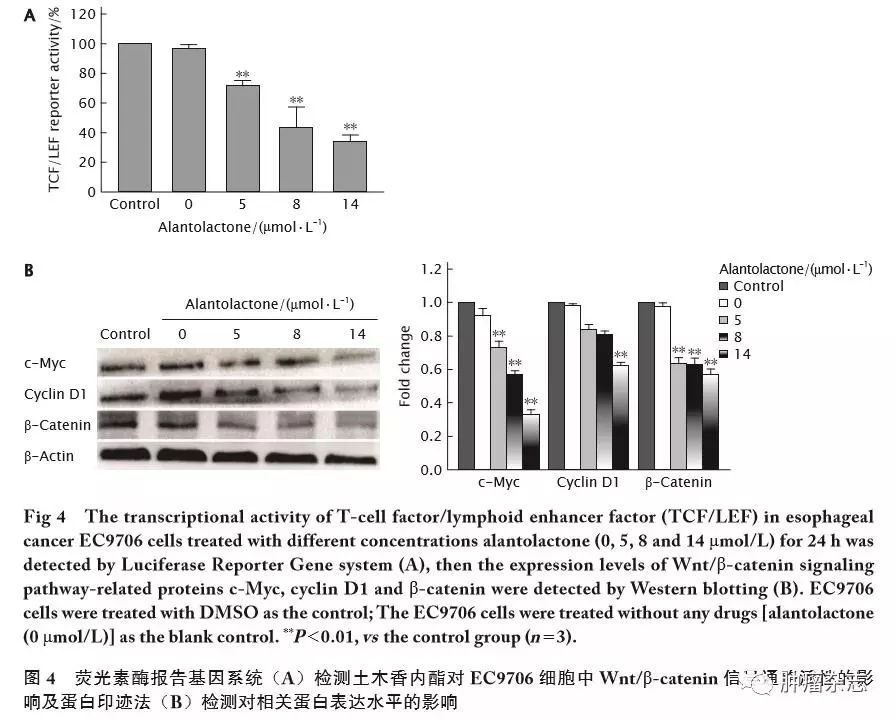
大量研究表明,Wnt/&β;-catenin信号通路在生物的生长发育中有着重要的作用,其异常激活是导致肿瘤发生的因素之一。因此本研究中采用了荧光素酶报告基因系统检测用不同浓度的土木香内酯处理后,各组细胞中&β;-catenin介导的TCL/LEF转录活性。结果(图4A)显示,与空白对照组和对照组相比,随着土木香内酯(5、8和14 μmol/L)浓度的提高,EC9706细胞中的TCL/LEF活性呈浓度梯度的方式明显降低(P 值均<0.01)。
随后采用蛋白印迹法检测土木香内酯对EC9706细胞中Wnt/&β;-catenin信号通路相关蛋白的表达的水平的影响。结果(图4B)显示,与空白对照组和对照组相比,随着土木香内酯(5、8和14 μmol/L)浓度的提高,Wnt信号通路关键分子&β;-catenin及其下游靶蛋白cyclin D1和c-Myc的表达水平均明显下调,差异具有统计学意义(P 值均<0.01)。
上述结果提示,土木香内酯对EC9706细胞的生长调节可能是通Wnt/&β;-catenin通路发挥作用的。
3 讨 论
食管癌是消化系统中最常见的恶性肿瘤之一,它的高侵袭性是患者预后不良的重要原因之一[11]。尽管目前食管癌的治疗手段有所进步,但全世界仍有数以万计的人死于食管癌,而食管癌在中国的发病率居高不下[12]。虽然外科手术结合放化疗是目前治疗食管癌的主要治疗手段,但是通常大量患者在确诊时即为晚期,加上手术治疗的局限性和放化疗的诸多不良反应,将进一步增加患者的身心负担,是造成食管癌患者生存率不高的因素之一[13]。因此有必要寻找一种新的、有效且毒性小的抗癌药物。传统中药有着悠久的历史,丰富的底蕴。大量的研究表明,传统中药能够有效的抑制肿瘤细胞的生长,减轻肿瘤的并发症,不良反应相对较少。土木香内酯是一种从中草药中分离得到的倍半萜内酯化合物,是藏木香的主要活性成分之一。研究证明,其具有多种生物学特性[7-9]。然而,其在食管癌中的作用还有待深入探讨。本研究对土木香内酯对食管癌细胞的影响及其可能的产生调节作用的机制进行了探讨。
肿瘤细胞不受控制的无限增殖能力是对患者造成不良预后的重要因素。抗肿瘤药物发挥作用的重要机制之一是抑制肿瘤细胞的增殖[14]。本研究中,通过结晶紫染色法、MTT法和克隆形成实验均证明了土木香内酯能有效地抑制食管癌细胞的增殖,并且随着药物浓度的增加和作用时间的延长,细胞生长率不断降低。本研究的MTT法检测结果显示,土木香内酯对EC9706细胞的IC50值为8.104 μmol/L。先前已有研究[15-17]报道了土木香内酯在癌症治疗中的应用,包括恶性神经胶质瘤(IC50值为33 µmol/L)、宫颈癌(IC50值为15µmol/L)和乳腺癌(IC50值为24.29 µmol/L),上述土木香内酯对肿瘤的IC50值都高于本研究中土木香内酯对食管癌EC9706细胞的IC50值。因此,土木香内酯在食管癌的治疗中可能具有更大的应用前景。
细胞凋亡是抗癌药物诱导的增殖抑制的一种重要的稳态机制,细胞凋亡的失控被认为是癌症的标志之一[18-19]。本研究中通过Hoechst 33258染色法证明,土木香内酯能诱导食管癌EC9706细胞的核形态向凋亡形态转变,加速食管癌细胞的凋亡进程,并且呈浓度依赖性。细胞凋亡的途径包括外源性和内源性2种途径,其中在由线粒体介导的细胞内源性凋亡途径中,抗凋亡蛋白Bcl-2可作为细胞凋亡程序启动的关键[20]。另外,促进凋亡的家族成员Bax可诱导外线粒体膜通透性增高,释放凋亡的相关分子细胞色素C,随后导致半胱天冬酶 3激活,使细胞凋亡[21]。本研究同时通过蛋白印迹法证明了,土木香内酯可以上调了Bax、cleaved-半胱天冬酶 3和半胱天冬酶 3的表达,同时下调Bcl-2的表达。上述2个实验结果表明,土木香内酯可以有效地促进食管癌细胞的凋亡。
转移是恶性肿瘤患者死亡的主要原因,其中迁移和侵袭是远处转移的2个重要前提。上皮-间质转化是指上皮细胞间质转化的生物学过程,与肿瘤的转移有着密切关系[22]。细胞外基质是肿瘤转移的首要障碍,其降解是一个关键步骤[23]。MMP-7和MMP-9是基质金属蛋白酶家族的重要成员,也是EMT过程的重要相关分子,在突破细胞外基质中起着重要作用,能破坏肿瘤细胞侵袭的组织学屏障。本研究中,采用划痕愈合实验和Transwell小室法证明了土木香内酯对食管癌细胞的迁移和侵袭有抑制作用,同时蛋白印迹实验结果证明土木香内酯可以降低迁移、侵袭相关蛋白MMP-7、MMP-9、Vimentin、Snail的表达水平,进一步验证了之前的实验结果。
有研究表明Wnt/&β;-catenin信号通路是一种重要的级联结构,与肿瘤的增殖转移紧密相关[22]。&β;-catenin在Wnt/&β;-catenin信号通路中对靶基因的激活起着至关重要的作用,它既是Wnt途径的组成部分,又可以在细胞质中的积累和稳定,然后最终易位至细胞核中,作为属于TCF/LEF转录因子的转录共激活因子[23]。本研究中采用荧光素酶报告基因系统检测发现,土木香内酯明显降低了EC9706细胞中TCF/LEF的转录活性。同时Wnt/&β;-catenin信号通路激活可通过调控下游靶分子c-Myc和cyclin D1等的表达,影响肿瘤的发生和发展[24]。通过蛋白质印迹法检测发现土木香内酯可以明显下调&β;-catenin的表达,同时下游靶分子c-Myc和cyclin D1的表达水平随着&β;-catenin下调而降低。
综上所述,土木香内酯可能通过阻断Wnt/&β;-catenin信号通路对食管癌细胞的增殖、迁移和侵袭产生抑制作用的同时促进其凋亡,为以后作为抗食管癌的一种相对有效和安全的方案提供了一定的理论基础。后续本课题组将对土木香内酯在小鼠体内对食管癌的作用进一步研究。本研究结果表明,土木香内酯有很大潜力成为一种有效的抗食管癌药物。
更多《肿瘤》杂志文章,请访问以下网址:
https://navi.cnki.net/knavi/JournalDetail?pcode=CJFD&pykm=ZZLL
参考文献
[1]KASHYAP MK, ABDEL-RAHMAN O. Expression, regulation and targeting of receptor tyrosine kinases in esophageal squamous cell carcinoma[J]. Mol Cancer, 2018, 17(1):54.
[2]FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-386.
[3]KASHYAP MK, MARIMUTHU A, KISHORE CJ, et al. Genomewide mRNA profiling of esophageal squamous cell carcinoma for identification of cancer biomarkers[J]. Cancer Biol Ther, 2009, 8(1):36-46.
[4]MCCANN J. Esophageal cancers: changing character, increasing incidence[J]. J Natl Cancer Inst, 1999, 91(6):497-498.
[5]KANG X, WANG H, LI Y, et al. Alantolactone induces apoptosis through ROS-mediated AKT pathway and inhibition of PINK1-mediated mitophagy in human HepG2 cells[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1):1961-1970.
[6]TRENDAFILOVA A, CHANEV C, TODOROVA M. Ultrasound-assisted extraction of alantolactone and isoalantolactone from Inula helenium roots[J]. Pharmacognosy magazine, 2010, 6(23):234-237.
[7]ZHANG Y, WENG Q, HAN J, et al. Alantolactone suppresses human osteosarcoma through the PI3K/AKT signaling pathway[J]. Mol Med Rep, 2020, 21(2):675-684.
[8]TAN L, LI J, WANG Y, et al. Anti-Neuroinflammatory Effect of Alantolactone through the Suppression of the NF-κB and MAPK Signaling Pathways[J]. Cells, 2019, 8(7):739.
[9]HUO Y, SHI HM, WANG MY, et al. Chemical constituents and pharmacological properties of Radix Inulae[J]. Die Pharmazie, 2008, 63(10):699-703.
[10]CHUN J, LI R J, CHENG MS, et al. Alantolactone selectively suppresses STAT3 activation and exhibits potent anticancer activity in MDA-MB-231 cells[J]. Cancer Lett, 2015, 357(1):393-403.
[11]GROBLEWSKA M, SIEWKO M, MROCZKO B, et al. The role of matrix metalloproteinases(MMPs) and their inhibitors(TIMPs) in the development of esophageal cancer[J]. Folia Histochem Cytobiol, 2012, 50(1):12-19.
[12]WANG A H, LIU Y, WANG B, et al. Epidemiological studies of esophageal cancer in the era of genome-wide association studies[J]. World J Gastrointest Pathophysiol, 2014, 5(3):335-343.
[13]STAHL M. Is there any role for surgery in the multidisciplinary treatment of esophageal cancer?[J]. Ann Oncol, 2010, 21 Suppl 7:vii283-285.
[14]KING K L, CIDLOWSKI JA. Cell cycle regulation and apoptosis[J]. Annu Rev Physiol, 1998, 60:601-617.
[15]ZHANG Y, ZHAO Y, RAN Y, et al. Alantolactone exhibits selective antitumor effects in HELA human cervical cancer cells by inhibiting cell migration and invasion, G2/M cell cycle arrest, mitochondrial mediated apoptosis and targeting NF-κB signalling pathway[J]. J BUON, 2019, 24(6):2310-2315.
[16]KHAN M, YI F, RASUL A, et al. Alantolactone induces apoptosis in glioblastoma cells via GSH depletion, ROS generation, and mitochondrial dysfunction[J]. IUBMB life, 2012, 64(9):783-794.
[17]LIU J, LIU M, WANG S, et al. Alantolactone induces apoptosis and suppresses migration in MCF‑7 human breast cancer cells via the p38 MAPK, NF‑κB and Nrf2 signaling pathways[J]. Int J Mol Med, 2018, 42(4):1847-1856.
[18]SITHARA T, DHANYA BP, ARUN K B, et al. Zerumbone, a cyclic sesquiterpene from zingiber zerumbet induces apoptosis, cell cycle arrest, and antimigratory effects in SW480 colorectal cancer cells[J]. J Agric Food Chem, 2018, 66(3):602-612.
[19]HANAHAN D, WEINBERG RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5):646-674.
[20]YOULE RJ, STRASSER A. The BCL-2 protein family: Opposing activities that mediate cell death[J]. Nat Rev Mol Cell Biol, 2008, 9(1):47-59.
[21]THIERY JP, ACLOQUE H, HUANG RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5):871-890.
[22]WANG X, YU Z, WANG C, et al. Alantolactone, a natural sesquiterpene lactone, has potent antitumor activity against glioblastoma by targeting IKK&β; kinase activity and interrupting NF-κB/COX-2-mediated signaling cascades[J]. J Exp Clin Cancer Res, 2017, 36(1):93.
[23]HAN P, LI JW, ZHANG BM, et al. The lncRNA CRNDE promotes colorectal cancer cell proliferation and chemoresistance via miR-181a-5p-mediated regulation of Wnt/&β;-catenin signaling[J]. Mol Cancer, 2017, 16(1):9.
[24]ZWAMBORN RAJ, SNIJDERS C, AN N, et al. Wnt Signaling in the Hippocampus in Relation to Neurogenesis, Neuroplasticity, Stress and Epigenetics[J]. Prog Mol Biol Transl Sci, 2018, 158:129-157.