欧狄沃联合化疗为非小细胞肺癌新辅助治疗提供新选择
相对于“辅助治疗”, “新辅助治疗”对很多朋友来说比较陌生。其实,二者同属围术期治疗,不同的是,一个用在术前,一个用在术后。
一、深入认识非小细胞肺癌(NSCLC)的新辅助治疗
新辅助是进行手术等局部治疗前应用的全身治疗,以化疗最为传统,意在消除潜在的微小转移灶,并降低肿瘤负荷,有利于手术对肿瘤的完全切除(图1)[1]。
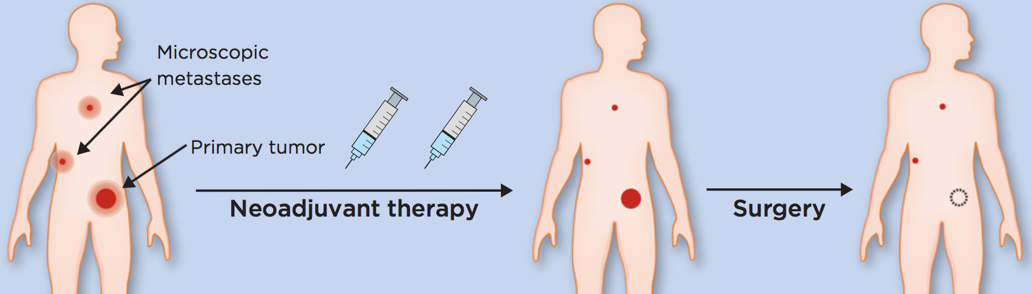
图1. 肿瘤的新辅助治疗示意图[1]
说到这,有朋友会问:我家人是II期NSCLC,为什么没有在术前用化疗呢?也打听过周围病友,他们即使接受了根治性手术,在术前多数也没用新辅助治疗?
很长一段时间内,新辅助治疗的研究进展较慢。这种在术前进行的全身治疗,与术后进行辅助治疗相比,并没有显示出更好的效果。相反,初诊时病灶就较大的患者,可能因为新辅助化疗效果不佳,病灶进一步增大,反而失去手术机会;也有患者对化疗药反应大,使其不得不延长手术日期。因此,辅助治疗似乎更加实际。
目前临床实践中,新辅助化疗仅用于病灶过大、希望通过缩小肿瘤达到“降期”效果,将原本不可手术的肿瘤转变为可手术状态。
二、免疫治疗是肿瘤新辅助治疗的新手段
新辅助治疗的尴尬地位,随着免疫检查点抑制剂的研发,逐渐有了改观。针对程序性死亡受体(PD-1)及其配体PD-L1的单克隆抗体,以迅雷不及掩耳之势,改变了NSCLC治疗的格局。
人们逐渐发现,将免疫治疗用于术前新辅助或许会有意想不到的效果,这要从抗肿瘤免疫机制上说起(图2)[2]。
A.原发肺部肿瘤
PD-1/PD-L1的抑制,使肿瘤微环境T细胞激活、开始杀伤肿瘤细胞。被杀死的肿瘤释放出自己的抗原,被另一种免疫细胞——树突状细胞识别,而这种细胞可加强T细胞活性。如此,一个不断加强的良性循环便形成了。
B. 引流淋巴结
PD-1/PD-L1的抑制产生类似的效果。神奇的是,原发部位的树突状细胞随淋巴液达到局部淋巴结,进一步加强淋巴结中T细胞的功能,使其针对淋巴结中的转移癌进行更强的杀伤。
C. 全身血流
活化T细胞随淋巴入血流,消灭我们看不到的潜在微小血道转移灶。
如此看来,免疫治疗针对原发肿瘤、淋巴结以及血道转移灶等各个环节,而原发肿瘤是关键,未切除时,肿瘤负荷大,能引发非常强大的免疫激活,促进了T细胞对肿瘤的全面清除。一段时间后再行手术,根治效果必然大大增加。
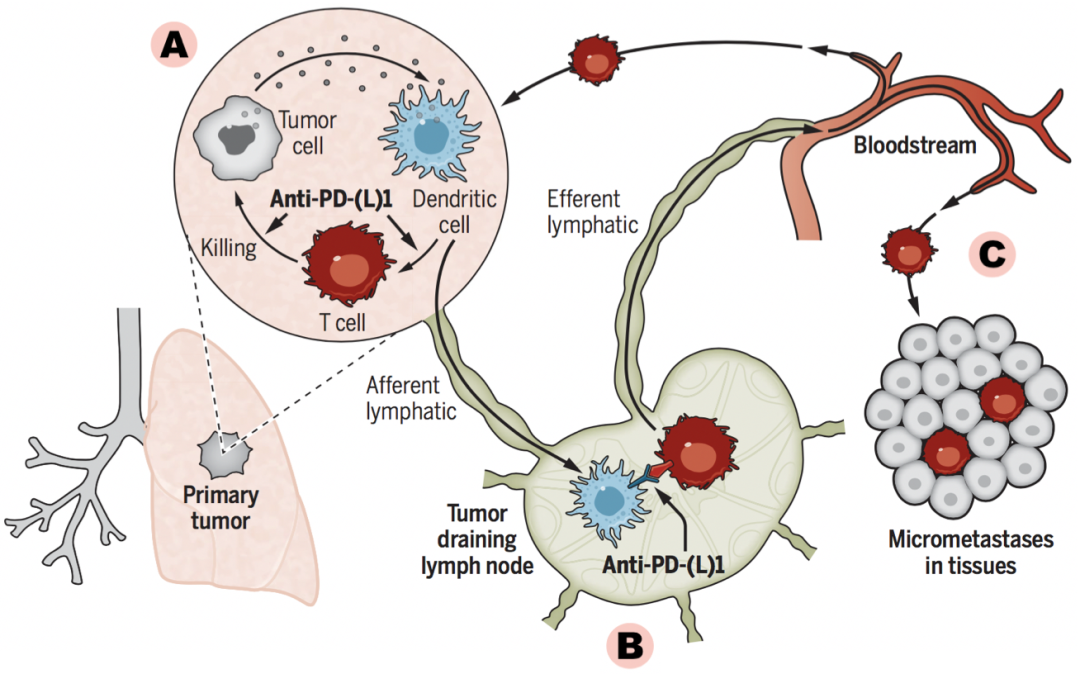
图2. 抗PD-1/PD-L1用于新辅助治疗的潜在机制[2]
三、O药用于NSCLC新辅助治疗,研究进展迅速
基于这样完美的抗肿瘤免疫机制,O药、K药、T药等纷纷打入新辅助治疗。
研究者开始探索,能否在更早期,即I~IIIA期病例中即应用免疫治疗,使免疫疗效持久的优势持续发挥,不断清除潜在微小转移灶,最终改善患者预后。
小编今天着重和大家探讨O药(欧狄沃,Nivolumab,纳武利尤单抗)。
目前,O药单药、O药联合化疗、O药联合CTLA-4免疫治疗,这些不同方案,均被探讨用于可切除NSCLC新辅助治疗阶段的可行性(表1)[3~6]。
接受治疗后切除标本中肿瘤病灶的缓解情况,即主要病理缓解(MPR)是新辅助治疗常用的疗效评价指标。
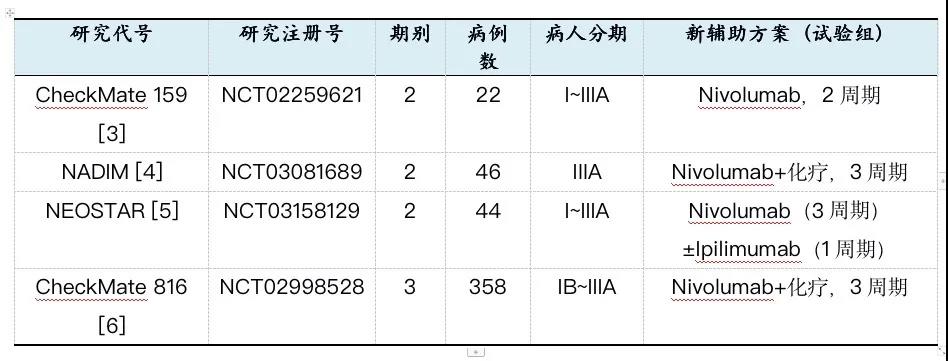
表1. 纳武利尤单抗用于非小细胞肺癌新辅助治疗的临床试验
CheckMate 159研究中,20例患者接受了根治性手术,MPR为45%,其中病理完全缓解(pCR)为5%,表明O药单药效果良好[3]。
NEOSTAR研究表明,37例可手术患者中,O药联合化疗组的MPR为44%。意向性治疗(ITT)人群中的ORR 20%,O药联合化疗组的MPR率为19%,获得CR/PR患者的MPR率高达78%。提示双免疫辅助治疗疗效优于单免疫治疗[5]。
CheckMate 816作为3期临床试验,进一步夯实了O药联合化疗用于新辅助治疗的疗效[6]。
NADIM研究结果则刚刚发表[4],下面小编带大家一起学习。
(四)NADIM研究:O药联合化疗用于NSCLC新辅助的新证据
NADIM是一项单臂、多中心、开放标签2期临床试验,旨在评估O药联合化疗新辅助/辅助治疗用于可切除IIIA期NSCLC患者的疗效(图3)。受试者接受O药新辅助治疗后进行手术,术后进行为期1年的O药辅助治疗。
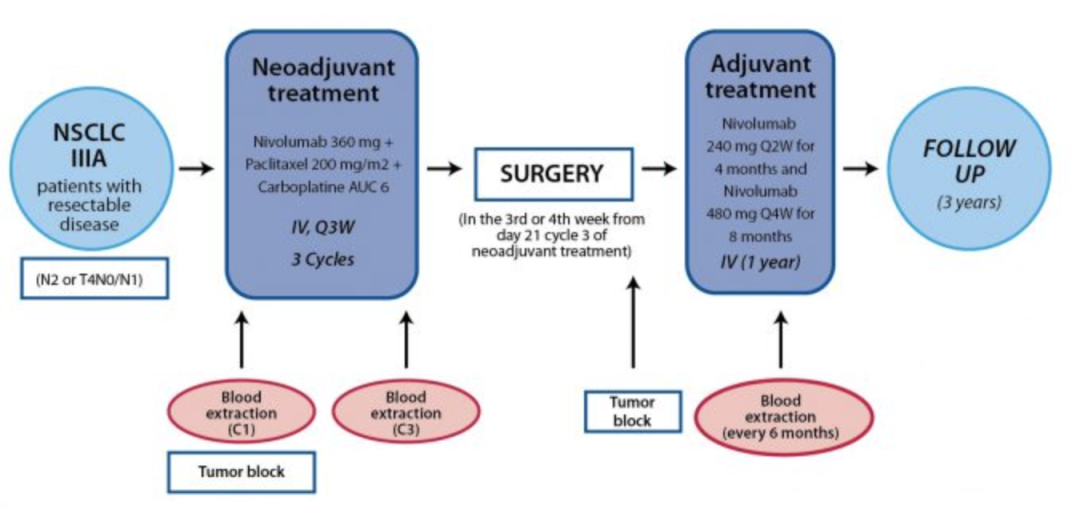
图3. NADIM研究设计
研究共纳入46例患者。1年和2年无进展生存(PFS)率分别为95.7%和77.1%(图4A)。即2年时,仍有接近8成患者处于非疾病进展状态。而1年和2年总生存(OS)率分别为97.8%和89.9%(图4B)。我们知道,IIIA期NSCLC的总体2年生存率仅为~55%。由此可见,O药联合化疗用于新辅助/辅助治疗能明显改善IIIA期NSCLC的预后。
此外,队列的客观缓解率(ORR)为76%,表明3/4以上患者接受治疗后,可达影像学上的缓解状态。
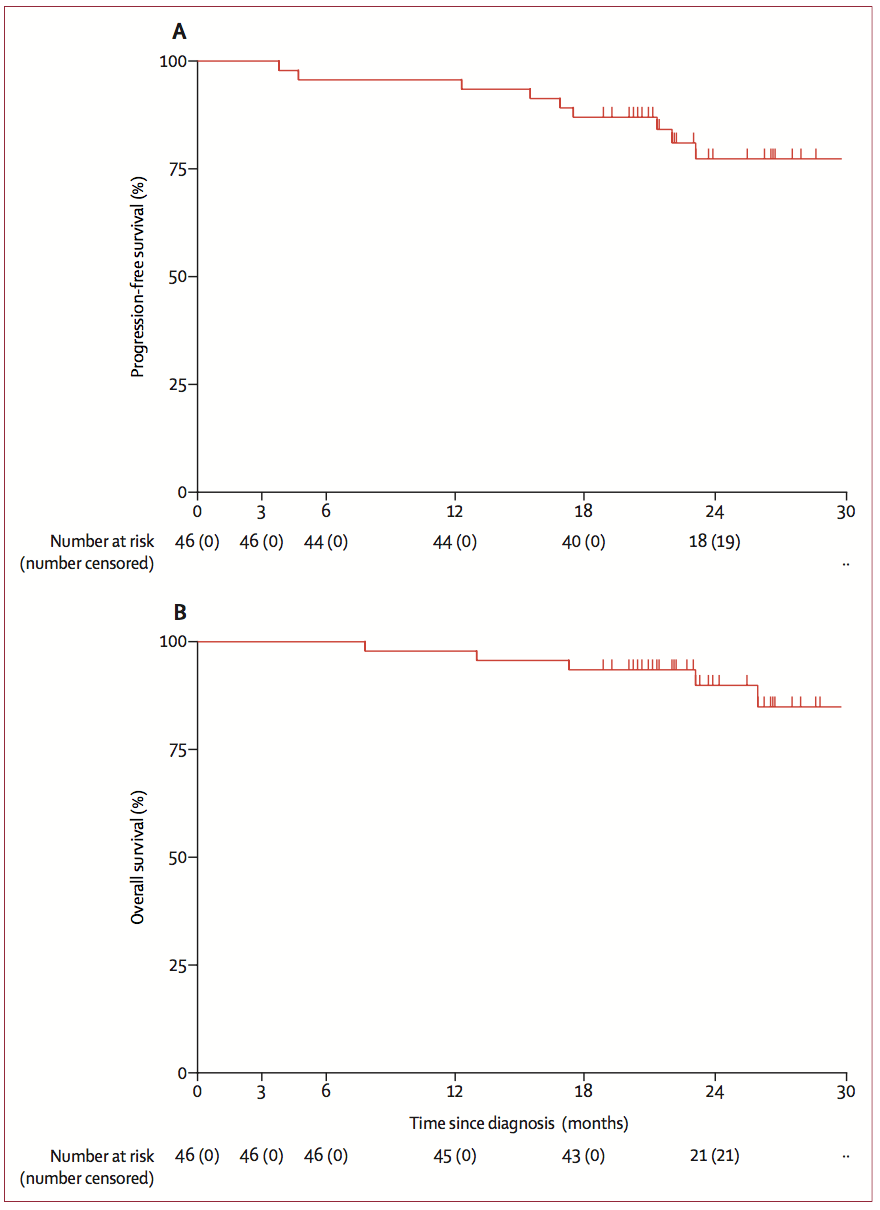
图4. 研究队列的无进展生存时间(PFS)(A)
和总生存时间(OS)(B)的生存曲线
新辅助治疗对手术有无影响?近9成(41例,89%)患者接受了根治性手术。中位随访时间为2年时,这些患者中35例(85%)还未出现疾病进展(图5),提示免疫治疗疗效的持久性。对41例手术切除标本进行分析,34例(89%)达到MPR,其中26例(65%)为pCR;37例(90%)实现了病理降期。这些指趾充分提示O药联合化疗用于IIIA期NSCLC新辅助治疗阶段具有可行性。
O药联合化疗的安全性如何?在NADIM研究中,多数患者出现了不良事件,但并未导致手术延期或死亡。
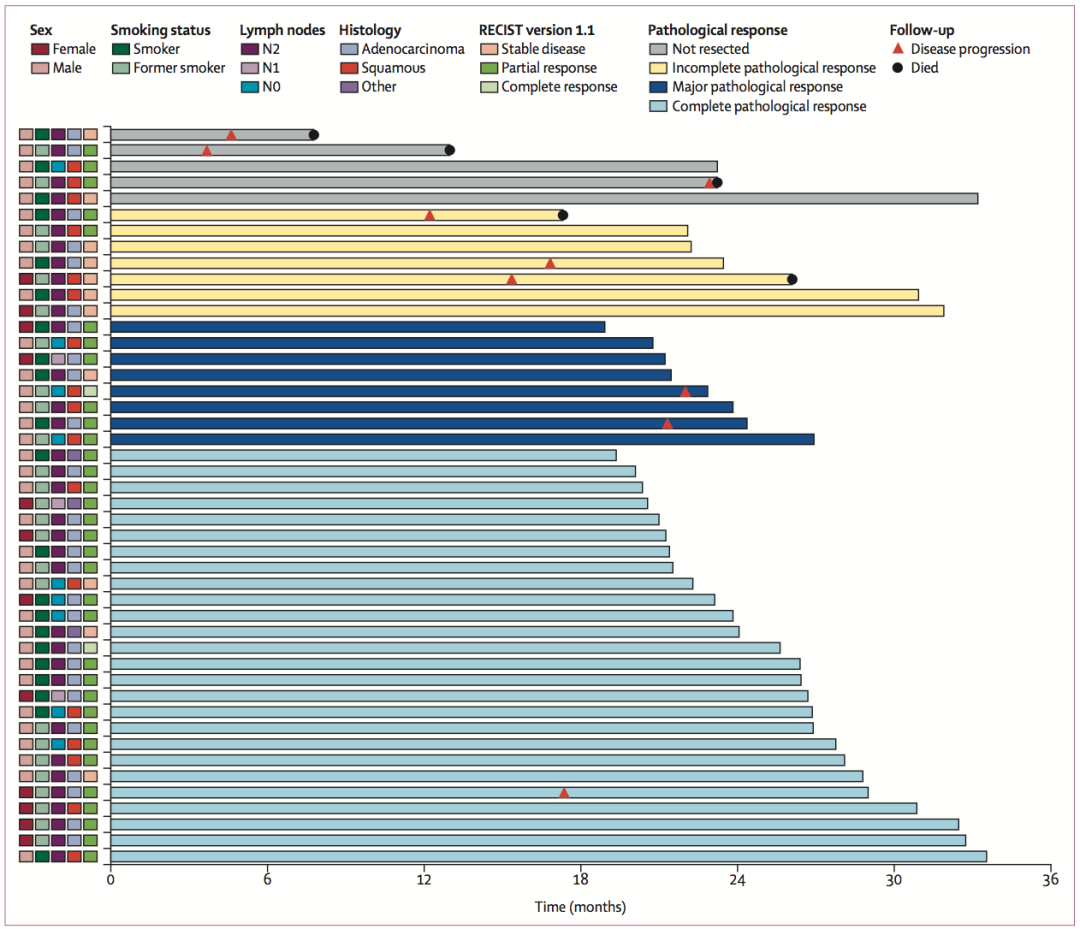
图5. 研究队列无进展生存时间(PFS)的游泳图
(五)后记
NADIM研究为O药联合化疗用于IIIA期NSCLC新辅助治疗提供了新证据。当然,该研究样本量相对较小,还有待进一步研究证实,如目前正在开展的NADIM II(NCT03838159)和 CheckMate 77T(NCT04025879)。
新辅助免疫治疗开启了I~IIIA期可切除NSCLC治疗的新模式。其独特的作用机制和初显的临床试验数据,都支持在临床实践中推广应用。当然,目前多数临床研究还在持续进行中,相信免疫新辅助疗法能成为这一NSCLC群体治疗的新选择。
参考资料
1. O'Donnell JS, Hoefsmit EP, Smyth MJ, et al. The Promise of Neoadjuvant Immunotherapy and Surgery for Cancer Treatment. Clin Cancer Res. 2019; 25(19): 5743-5751.
2. Topalian SL, Taube JM, Pardoll DM. Neoadjuvant checkpoint blockade for cancer immunotherapy. Science. 2020; 367(6477): eaax0182.
3. Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 Blockade in Resectable Lung Cancer. N Engl J Med. 2018; 378(21): 1976-1986.
4. Provencio M, Nadal E, Insa A, et al. Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer(NADIM): an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol. 2020; published online. doi: 10.1016/S1470-2045(20)30453-8.
5. Cascone T, William WN, Weissferdt A, et al. Neoadjuvant nivolumab(N) or nivolumab plus ipilimumab(NI) for resectable non-small cell lung cancer(NSCLC): Clinical and correlative results from the NEOSTAR study. J Clin Oncol. 2019; 37(suppl; abstr 8504).
6. Opdivo(nivolumab) Plus Chemotherapy Shows Statistically Significant Improvement in Pathologic Complete Response as Neoadjuvant Treatment of Resectable Non-Small Cell Lung Cancer in Phase 3 CheckMate-816 Trial. [https://pipelinereview.com/index.php/2020100776115/Antibodies/Opdivo-nivolumab-Plus-Chemotherapy-Shows-Statistically-Significant-Improvement-in-Pathologic-Complete-Response-as-Neoadjuvant-Treatment-of-Resectable-Non-Small-Cell-Lung-Cance.html]