肉瘤样肝细胞癌中MET基因扩增与预后的相关性分析
张 欣,周 成,周恺乾,等. 肉瘤样肝细胞癌中MET基因扩增与预后的相关性分析[J]. 中国癌症杂志, 2020, 30(9): 641-649.
基金项目:国家自然科学基金(81400645);上海市临床重点专科项目(shslczdzk01302)。
通信作者:纪 元 E-mail: ji.yuan@zs-hospital.sh.cn
第一作者简介

张 欣,复旦大学附属中山医院病理科,主治医师。2012年博士毕业于复旦大学基础医学院病理学系。2014年及2017年分别获得国家自然科学基金青年项目及复旦大学附属中山医院优秀青年计划资助,近年来以第一作者发表SCI论文五篇。
通信作者简介

纪 元,病理学博士,主任医师,硕士研究生导师。复旦大学附属中山医院病理科副主任、肝胆胰专科主任、上海市肝病中心病理平台主任。现任中国医师协会胰腺病专业委员会委员神经内分泌肿瘤学组副组长,抗癌协会肝癌专业委员会病理学组副组长,抗癌协会肿瘤病理专业委员会肝癌学组副组长,抗癌协会胰腺癌专业委员会神经内分泌肿瘤学组委员,全国卫生产业企业管理协会实验医学专家委员会病理学会常委,抗癌协会肿瘤病理专业委员会肺癌学组副组长,美国Rodger C. Haggitt消化病理协会委员,美国Hans Popper 肝脏病理协会委员。
作者解读
肉瘤样肝细胞癌中MET基因扩增与预后的相关性分析
张 欣1,周 成2,周恺乾2,柏乾明3,蒋冬先1,宿杰阿克苏1,侯英勇1,王 征2,纪 元1
1.复旦大学附属中山医院病理科,上海 200032;
2.复旦大学附属中山医院肝外科,上海 200032;
3.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
[摘要] 背景与目的:肉瘤样肝细胞癌(sarcomatoid hepatocellular carcinoma,SHC)是一种罕见且高度恶性的肝脏肿瘤。MET基因异常具有肿瘤预后预测价值,以MET为靶点的抑制剂已成为晚期肿瘤治疗的重要方向,然而SHC组织中MET基因扩增状态尚不明确。探讨SHC中MET基因扩增与临床病理学因素的相关性及其预后预测价值。方法:收集2008年1月—2016年12月于复旦大学附属中山医院经病理学检查确诊的22例SHC患者资料。采用荧光原位杂交(fluorescence in situ hybridization,FISH)法检测上述患者的MET基因扩增情况,并结合临床病理学资料进行统计学分析。采用Kaplan-Meier模型分析总生存期(overall survival,OS)及无病生存期(disease-free survival,DFS),采用log-rank检验比较生存曲线,采用多因素COX回归模型分析SHC中孤立的预后因素。结果:22例SHC患者中,MET基因扩增5例(22.7%)。MET基因扩增存在异质性,主要位于分化差的梭形细胞区域(4例)。MET基因扩增的SHC患者中位OS明显短于MET阴性患者(6.8个月 vs 24.0个月,P=0.001)。SHC中具有完整肿瘤包膜的患者中位OS明显长于包膜不完整的患者(41.3个月 vs 8.5个月,P=0.001)。单灶肿瘤及中国肝癌分期(China Liver Cancer Staging,CNLC)Ⅰ期患者的中位DFS较多灶肿瘤及Ⅱ+Ⅲ+Ⅳ期患者明显延长(10.4个月 vs 3.8个月,12.4个月 vs 3.8个月,P=0.027和0.017)。MET基因扩增是SHC孤立的预后因子。结论:22.7%(5/22)的SHC中存在MET基因扩增。MET基因扩增的SHC患者预后更差,是其预后的孤立危险因素。该研究结果为该罕见肿瘤的治疗提供了新策略和临床依据。
[关键词] 肉瘤样肝细胞癌;MET;基因扩增;预后;靶向治疗
[Abstract] Background and purpose: Sarcomatoid hepatocellular carcinoma(SHC) is a rare and aggressive neoplasm of the liver. METgene aberrations have emerged as important prognostic biomarkers for tumors, and MET-targeted inhibitor has become an important direction in the treatment of advanced tumors. The status of MET gene amplification in the SHC tissues remains unclear. The aim of this study was to investigate the correlations between MET gene amplification and the clinicopathological factors in patients with SHC and its prognostic values. Methods: Twenty-two patients with SHC were identified from the liver resection pathology files in the database of Zhongshan Hospital, Fudan University from Jan. 2008 to Dec. 2016.MET gene amplification was analyzed by fluorescence in situhybridization(FISH), followed by subsequent clinicopathological correlative studies. The Kaplan-Meier method was used to estimate overall survival(OS) and disease-free survival(DFS). The log-rank test was applied to compare survival curves. Multivariate COX regression models were used for prognostic analysis. Results: MET gene amplification was observed in 5 patients(22.7%), and MET FISH positive cells mainly located in the sarcomatoid area of the tumor(4 cases). Patients with MET gene amplification and incomplete tumor capsule had significantly shorter median OS(6.8 months vs 24.0 months, 8.5 months vs 41.3 months, P=0.001 and 0.001) compared with those who did not. Patients with a solitary tumor and China Liver Cancer Staging(CNLC) stage Ⅰ disease had significantly favorable DFS(10.4 months vs 3.8 months, 10.4 months vs 3.8 months, P=0.027 and 0.017) than the patients with multiple tumors and CNLC stage Ⅱ+Ⅲ+Ⅳ diseases. The results of the multivariate COX proportional hazards model revealed MET gene amplification as an independent prognostic factor for mortality. Conclusion: SHC tissue has a high rate of METgene amplification, which is an independent predictor of poor prognosis in patients with SHC. This study may provide a new strategy and clinical basis for the treatment of this rare tumor.
[Key words] Sarcomatoid hepatocellular carcinoma; MET; Gene amplification; Prognosis; Targeted therapy
肉瘤样肝细胞癌(sarcomatoid hepatocellular carcinoma,SHC)是一种罕见的、伴有肉瘤样(梭形细胞或巨细胞)分化的肝细胞癌(hepatocellular carcinoma,HCC)[1],常见于化疗后的患者[2]。SHC恶性程度高,预后差,传统外科手术治疗效果不佳[3]。
MET是原癌基因MET编码的蛋白,为肝细胞生长因子(hepatocyte growth factor,HGF)受体,具有酪氨酸激酶活性,在正常细胞和肿瘤细胞中均有表达。MET持续激活是细胞癌变及癌细胞增殖亢进的重要原因。多项研究[4-8]表明,MET蛋白过表达和基因扩增存在于非小细胞肺癌、乳腺癌、胃癌、结直肠癌及HCC等多种肿瘤的发生和转移过程中,并与这些肿瘤的预后密切相关。以MET为靶点的酪氨酸激酶抑制剂已成为晚期肿瘤靶向治疗的重要方向[9-10]。然而,SHC中MET基因扩增状态尚不明确。
本研究回顾性分析SHC患者的临床病理学资料,采用荧光原位杂交(fluorescence in situ hybridization,FISH)法检测SHC中MET基因扩增状态,并探讨MET基因扩增与SHC患者临床病理学特征及预后的关系,旨在为判断SHC患者的预后引进新的指标,也为SHC的靶向药物治疗提供新的思路。
1
资料和方法
1.1 临床资料
从2008年1月—2016年12月就诊于复旦大学附属中山医院并行肝癌手术切除的15 000例患者中,筛选出原发性SHC 22例,所有切片均由2名高年资消化病理科医师复核。诊断标准参照2010、2019年修订的世界卫生组织(World Health Organization,WHO)消化系统肿瘤[1,11]分类:SHC是一种伴有明显肉瘤样结构的HCC,多数含有典型的HCC区域,或免疫组织化学染色和临床病史提示为肝细胞来源。收集患者临床信息,包括性别、年龄、既往史等,采用电话随访结合患者来院复查进行病例随访,随访截至2019年4月。
1.2 免疫组织化学检测
所有手术切除标本均经37%的甲醛溶液固定24 h以上,常规脱水,石蜡包埋,4 μm切片,H-E染色及免疫组织化学染色。所用一抗细胞角蛋白(CKpan)、结蛋白(desmin)、精氨酸酶-1(arginase-1,ARG1)均购自丹麦Dako公司。
1.3 FISH检测
应用MET基因扩增检测试剂框(探针D7S522,美国Abbott Vysis公司)。具体步骤如下:经常规烤片、脱蜡后,88~92 ℃下应用纯水预处理组织切片30 min,37 ℃下应用胃蛋白酶消化15~20 min,漂洗、固定、脱水。待组织切片自然干燥后,将探针工作液10 μL滴加于组织标本上,用橡胶水泥封边。将组织切片置于杂交仪中,78 ℃变性5 min后,42 ℃杂交12~18 h。经杂交后洗涤、干燥,加入10 μL 4’,6-二脒基-2-苯基吲哚,室温下放置15 min,于荧光显微镜下观察结果,最后将FISH荧光切片放在﹣20 ℃下避光长期保存。采用FISH法检测MET基因扩增的判读标准参照参考文献[12]。计算至少40个肿瘤细胞,若肿瘤细胞中MET基因平均拷贝数≥5.0个和(或)MET/CEP7比值≥2.0时,诊断为MET基因扩增;否则视为阴性。
1.4 统计学处理
应用SPSS 20.0软件进行数据处理及统计学分析,MET基因扩增与临床病理学因素的相关性采用χ2检验;生存分析采用Kaplan-Meier模型、log-rank检验和单因素分析。多因素预后分析采用COX回归模型。P<0.05为差异有统计学意义。
2
结 果
2.1 临床资料
22例SHC患者中,男性18例,女性4例。年龄35~75,中位年龄57.5岁。自觉右上腹胀痛者9例,以低热为主要症状者1例,症状持续时间2~6周不等,体检发现肝占位而无临床症状者12例。4例非首次就诊患者,其中术前接受过经导管动脉化疗栓塞术3例,射频消融术1例。肿瘤绝大多数位于肝右叶(17例),少部分位于肝左叶(4例)与肝中叶(1例)。22例患者中11例行肿块所在肝叶切除术,另11例行特殊肝段切除术;13例术后辅以放疗和化疗。实验室检查:22例SHC患者中,乙肝病毒表面抗原阳性者16例,血清甲胎蛋白(α-fetoprotein,AFP)升高者13例,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶或&γ;-谷氨酰转移酶等肝功能指标异常者17例。根据巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer,BCLC)系统分类:10例患者为A期,7例患者为B期,5例患者为C期。根据2019版中国肝癌分期(China Liver Cancer Staging,CNLC)方案,Ⅰ期患者11例,Ⅱ期5例,Ⅲ期5例,Ⅳ期1例。
2.2 病理学特征
肿块直径为2.2~15.0 cm,平均7.2 cm,其中8例最大径在10.0 cm以上。肿瘤切面灰白灰黄,常伴出血(5例)及坏死(12例)。6例患者存在2个及以上多发病灶。22例SHC均存在恶性梭形细胞成分,其中梭形细胞成分中具有上皮细胞标志物表达者16例,无上皮细胞标志物表达者6例(图1A)。部分梭形细胞显著异型,可见瘤巨细胞,类似多形性未分化肉瘤样形态(图1B);部分梭形细胞较一致,核分裂象易见,类似纤维肉瘤样形态(图1C);部分肉瘤区域内可见成熟骨小梁结构,呈现骨样分化(图1D);部分肉瘤样细胞核略偏位(图1E),免疫组织化学检查示desmin阳性(图1F),提示横纹肌分化。所有病例中具有经典HCC组织学形态者15例(图1G),肿瘤细胞排列呈细梁状、假腺样或粗梁状;呈低分化癌形态者2例(图1H),免疫组织化学检查显示ARG1阳性(图1I),提示肝细胞来源。全部由肉瘤样梭形细胞组成者5例,该5例患者均具有慢性乙型肝炎病史及结节性肝硬化,同时伴有血清AFP升高,其中1例术前接受过射频消融治疗。

图 1 SHC病理学形态
Fig. 1 Pathological features of SHC
A: Positive staining of CKpan in the sarcomatoid area as demonstrated by immunohistochemistry; B: The significant heteromorphic sarcomatoid area containing giant cells; C: Uniform spindle cells arranged in bundles; D: Sarcomatoid area with osteodifferentiation; E: Spindle cells with deviated nuclei; F: Diffuse positive staining of desmin by immunohistochemistry in E; G: Classic hepatocellular carcinoma area; H:Epithelioid poorly differentiated carcinoma area with polygonal cells and obvious nucleoli;I: Positive immunohistochemical staining of ARG1 in H
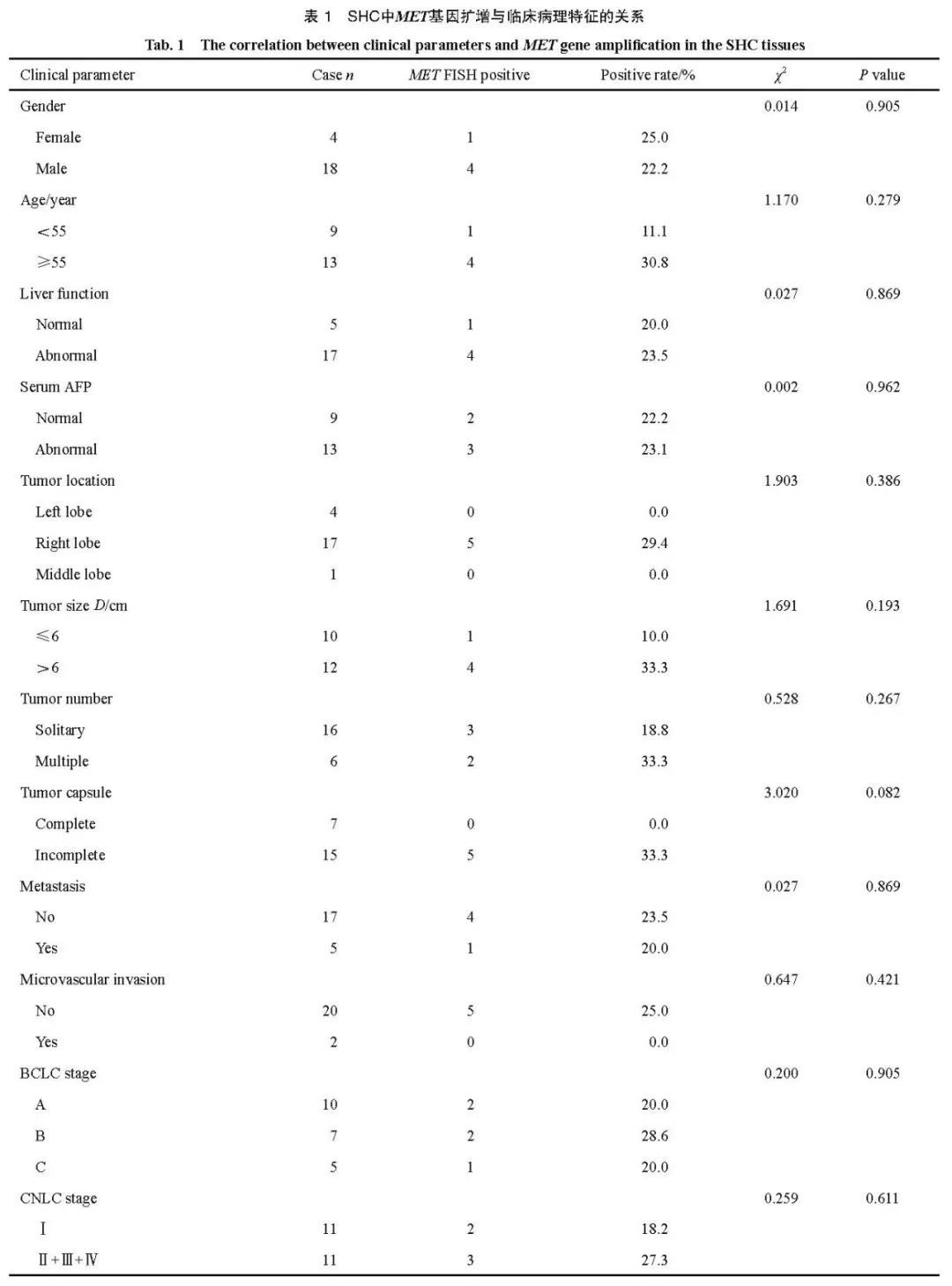
2.3 MET基因扩增与临床病理学特征的关系
用FISH法对22例SHC患者标本进行了MET基因扩增检测,5例检测出MET基因扩增,阳性率为22.7%。其中,2例肿瘤细胞内MET基因平均拷贝数≥5.0个,且MET/CEP7比值≥2.0;另外3例肿瘤细胞内MET基因平均拷贝数≥5.0个,而MET/CEP7比值<2.0。4例MET基因扩增信号存在异质性,分化差的肉瘤样区域(图1A)呈MET基因扩增阳性(图2A),而同一病例中经典HCC区域(图1G)呈MET基因扩增阴性(图2B)。MET基因扩增与患者的性别、年龄、肝功能、血清AFP水平、肿块部位、肿瘤大小、肿瘤数目、肿瘤包膜、肝外转移、微脉管癌栓及肿瘤分期(包括BCLC和CNLC)均无相关性(P>0.05,表1)。

图 2 FISH法检测SHC组织中MET基因扩增状态
Fig. 2 MET gene amplification in SHC tissues detected by FISH
A: In the MET FISH-positive area, the ratio of MET/CEP7(red/green) was ≥2.0 and the mean copies of MET/cells were ≥5.0; B: The MET detected by FISH showed negative area
2.4 MET基因扩增与预后的关系
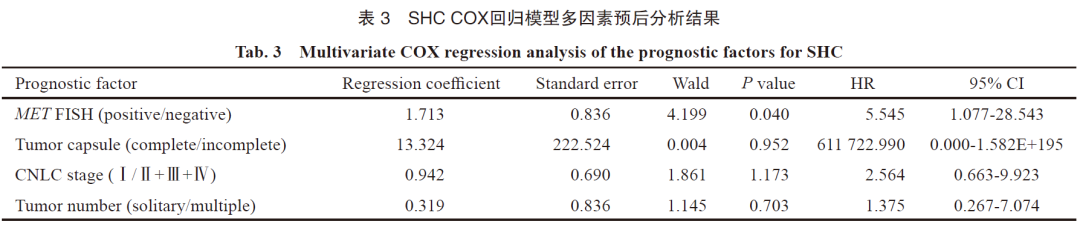
对本组所有患者均进行随访,中位随访时间为20.7个月(1.4~55.3个月),中位总生存期(overall survival,OS)和中位无病生存期(disease-free survival,DFS)分别为23.4和7.2个月。15例出现疾病进展,12例死亡。患者OS和DFS与患者性别、年龄、肝功能、血清AFP、肿块部位、肿瘤大小、肝外转移、微脉管癌栓及BCLC等单因素分析无相关性(P>0.05,表2)。经Kaplan-Meier生存分析显示,MET基因扩增阳性的患者中位OS为6.8个月,明显低于MET基因扩增阴性患者的24个月,log-rank时序检验显示差异有统计学意义(P=0.001,图3,表2)。具有完整肿瘤包膜患者的中位OS明显高于包膜不完整患者(41.3个月 vs 8.5个月,P=0.001,图3,表2)。单灶肿瘤及CNLC Ⅰ期患者的中位DFS较多灶肿瘤及Ⅱ+Ⅲ+Ⅳ期患者明显延长(10.4个月vs 3.8个月,12.4个月 vs 3.8个月,P=0.027和0.017,图3,表2)。COX回归模型多因素分析显示,MET基因扩增是影响生存的孤立预后因素,FISH检测MET基因表达结果呈阳性的患者预后差(表3)。

图 3 Kaplan-Meier模型构建生存曲线
Fig. 3 Kaplan-Meier estimated OS and DFS curves
A, B: Patients with MET gene amplification and incomplete tumor capsule had significantly shorter OS(log-rank P=0.001 and 0.001) compared with those who did not; C, D: Patients with a solitary tumor and CNLC stage Ⅰ disease had significantly favorable DFS(log-rankP=0.027 and 0.017) compared with the patients with multiple tumors and stage Ⅱ+Ⅲ+Ⅳ disease

3
讨 论
SHC是一种罕见的HCC组织学亚型,发病率仅占HCC手术切除病例的1.8%[13]。SHC侵袭性强,预后差,其相关分子病理学研究鲜有报道。本研究回顾性分析了22例SHC患者的临床病理学特征,并对所有患者进行了MET基因扩增FISH检测及预后相关分析,结果显示:① SHC中存在较高比例(22.7%)的MET基因扩增;② MET基因扩增患者的生存期明显低于MET阴性患者(中位OS:6.8个月 vs 24个月),MET基因扩增是影响SHC预后的孤立危险因素;③ 具有完整的肿瘤包膜、单灶肿瘤及CNLCⅠ期的患者预后较好。本研究为判断SHC患者的预后引进了新的指标,也为SHC的靶向药物治疗提供了新的思路。
MET通路异常在非小细胞肺癌、乳腺癌、结直肠癌、胃癌和HCC等肿瘤中均已被证实是明确的预后标志物[4-8],而且在预测肿瘤靶向治疗反应及肿瘤诊断方面也发挥着越来越重要的作用。通过对MET异常进行检测,能够筛选出可能从靶向治疗中获益的患者。其中,对存在MET异常的乳头状肾癌和非小细胞肺癌患者选用针对HGF/MET的靶向治疗能够获得最为肯定的治疗效果[9-10]。在其他肿瘤中,MET作为预测因子的价值不甚一致,其差异的根源可能在于对肿瘤组织内MET异常的检测方法与诊断标准不同。此外,血浆或血清MET水平升高不仅同样提示肿瘤预后不良,还可作为前列腺癌、黑色素瘤等肿瘤的诊断标志物[4,14-15]。
MET蛋白过表达、MET基因扩增或拷贝数增多以及MET基因突变(主要包括第14外显子跳跃突变)均可导致肿瘤细胞中MET通路异常激活。3种异常改变最常用的检测方法分别是免疫组织化学法、FISH法及基因测序法。有研究[16]显示,虽然MET基因扩增见于MET蛋白阳性者,但MET基因扩增率远低于免疫组织化学法检测到的MET蛋白阳性率。因此,MET的免疫组织化学检测结果不能替代MET基因扩增检查,对于考虑选用肿瘤靶向药物治疗的患者,建议采用FISH法检测MET基因扩增,免疫组织化学法可以作为筛查MET基因扩增患者的补充手段。本研究中5例FISH检测MET基因表达结果呈阳性的患者中,2例肿瘤细胞内MET基因平均拷贝数≥5.0个且MET/CEP7比值≥2.0,另外3例肿瘤细胞内MET基因平均拷贝数≥5.0个而MET/CEP7比值<2.0。由于FISH检测MET基因表达结果呈阳性的病例数较少,因此在本文中将两者一起分析讨论。
SHC是典型的上皮-间质转化性肿瘤。本研究发现MET扩增存在一定异质性,多见于肉瘤样区域。一方面,这可能与肉瘤样区域恶性程度较高有关,并与MET扩增提示预后差的结论相一致。另一方面,根据以往文献报道,MET或许能够通过促进间叶衍生祖细胞的增生,诱导肉瘤形成[17]。因此,MET多见于肉瘤样区域提示其在HCC的肉瘤样转变中可能起到了一定的作用。
肝脏癌肉瘤也是肝脏罕见并且预后差的恶性肿瘤类型,肝脏癌肉瘤与肉瘤样癌的鉴别诊断困难,常常是病理学医师需要面对的难题。根据2000年版WHO消化系统肿瘤组织学分类[18],肝脏癌肉瘤定义为由上皮样成分(既可以是肝细胞源性也可以是胆管细胞源性)和肉瘤样成分紧密混杂在一起的恶性肿瘤,其肿瘤中既有癌成分,又有肉瘤成分。如果构成肉瘤样成分的梭形细胞仍然为上皮源性(表达上皮细胞标志物),则诊断为肉瘤样癌。根据该定义,本研究的22例SHC患者中,6例肉瘤样成分的梭形细胞未检测到上皮细胞标志物表达,因此属于癌肉瘤病例。而2010和2019年修订版WHO消化系统肿瘤组织学分类将肝脏癌肉瘤定义为伴肉瘤样分化的癌,也归类为肉瘤样癌。其中的肉瘤样成分由分化差的HCC或肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)克隆进化而来,分别形成SHC与肉瘤样ICC[1]。修订后的版本在一定程度上提高了临床诊断的一致性。有研究[3]比较了10例肝脏肉瘤样癌及14例癌肉瘤的临床病理学特征,提示肝脏癌肉瘤与肝脏肉瘤样癌在病理学形态上相似,肝脏癌肉瘤的中位OS较肉瘤样癌稍低(4.8个月 vs 9.6个月),但差异无统计学意义。因此,二者是否存在本质上的差异尚需更多分子病理学研究加以证实。
[参考文献]
BOSMAN F T, CARNEIRO F, HRUBAN R H, et al. World Health Organization classification of tumours of the digestive system, 4th ed[M]. Lyon: IARC Press, 2010: 249.
YOKOMIZO J, CHO A, YAMAMOTO H, et al. Sarcomatous hepatocellular carcinoma without previous anticancer therapy[J]. J Hepatobiliary Pancreat Surg, 2007, 14(3): 324-327.
WANG Q B, CUI B K, WENG J M, et al. Clinicopathological characteristics and outcome of primary sarcomatoid carcinoma and carcinosarcoma of the liver[J]. J Gastrointest Surg, 2012, 16(9): 1715-1726.
GAO H F, LI A N, YANG J J, et al. Soluble c-Met levels correlated with tissue c-Met protein expression in patients with advanced non-small cell lung cancer[J]. Clin Lung Cancer, 2017, 18(1): 85-91.
WANG M, LIANG L, LEI X, et al. Evaluation of c-MET aberration by immunohistochemistry and fluorescence in situ hybridization(FISH) in triple negative breast cancers[J]. Ann Diagn Pathol, 2018, 35: 69-76.
KIM H S, CHON H J, KIM H, et al. MET in gastric cancer with liver metastasis: the relationship between MET amplification and Met overexpression in primary stomach tumors and liver metastasis[J]. J Surg Oncol, 2018, 117(8): 1679-1686.
HUANG C Y, ZHOU Q Y, HU Y, et al. Hepatocyte growth factor is a prognostic marker in patients with colorectal cancer: a Meta-analysis[J]. Oncotarget, 2017, 8(14): 23459-23469.
HUANG X, GAN G, WANG X, et al. The HGF-MET axis coordinates liver cancer metabolism and autophagy for chemotherapeutic resistance[J]. Autophagy, 2019, 15(7): 1258-1279.
CHOUEIRI T K, PLIMACK E, ARKENAU H T, et al. Biomarker-based phase Ⅱ trial of savolitinib in patients with advanced papillary renal cell cancer[J]. J Clin Oncol, 2017, 35(26): 2993-3001.
SPIGEL D R, ERVIN T J, RAMLAU R A, et al. Randomized phase Ⅱ trial of onartuzumab in combination with erlotinib in patients with advanced non-small cell lung cancer[J]. J Clin Oncol, 2013, 31(32): 4105-4114.
ARENDS M J, FUKAYAMA M, KLIMSTRA D S, et al. WHO classification of tumours, 5th edition digestive system tumours[M]. Lyon: IARC Press, 2019: 262.
SEO S, RYU M H, RYOO B Y, et al. Clinical significance of MET gene amplification in metastatic or locally advanced gastric cancer treated with first-line fluoropyrimidine and platinum combination chemotherapy[J]. Chin J Cancer Res, 2019, 31(4): 620-631.
MAEDA T, ADACHI E, KAJIYAMA K, et al. Spindle cell hepatocellular carcinoma. A clinicopathologic and immunohistochemical analysis of 15 cases[J]. Cancer, 1996, 77(1): 51-57.
KAYE D R, PINTO P A, CECCHI F, et al. Tumor and plasma Met levels in non-metastatic prostate cancer[J]. PLoS One, 2016, 11(6): e0157130.
BARISIONE G, FABBI M, GINO A, et al. Potential role of soluble c-Met as a new candidate biomarker of metastatic uveal melanoma[J]. JAMA Ophthalmol, 2015, 133(9): 1013-1021.
LEE S J, LEE J, SOHN I, et al. A survey of c-MET expression and amplification in 287 patients with hepatocellular carcinoma[J]. Anticancer Res, 2013, 33(11): 5179-5186.
PATANE S, AVNET S, COLTELLA N, et al. MET overexpression turns human primary osteoblasts into osteosarcomas[J]. Cancer Res, 2006, 66(9): 4750-4757.
ISHAK K G, ANTHONY P P, NIEDERAU C, et al. WHO international histological classification of tumours, pathology & genetics of the tumours of the digestive system[M]. Lyon: IARC Press, 2000: 198.