打开新大门 这个发现可以提前预知结直肠癌复发转移
随着结直肠癌靶向治疗的不断发展,新型靶点被发现,根据新型靶点衍生出的新药日新月异。但是你有没有想过这样一个问题:目前大多数靶向药物治疗是基于基因突变进行筛选的,没有相关基因组特征的患者该何去何从?
并且早期结直肠患者的生存预后已经得到了极大的改善,甚至可以治愈;但晚期结直肠癌治疗依旧是个难题:如何在肿瘤复发转移之前“抢先一步”进行预知并采取对策?
中国科学院系统生物学重点实验室曾嵘研究组和吴家睿研究组联合海军军医大学长海医院张卫研究组带着一系列问题,对结直肠癌以及转移相关的特征进行了更深一层次基于系统生物学的探索与剖析,绘制出了首个中国人结直肠癌及转移相关的多组学基因图谱。该研究成果发表于Cancer Cell上。医学界肿瘤频道邀请到了长海医院张卫教授从研究三大创新之处为广大临床医生和患者详解此项成果。
 图1 官网截图
图1 官网截图
1、创新一:新结直肠癌分子亚型可预测预后
研究者系统性地收集了转移性结直肠癌患者480个临床样本,包括原发灶与相应的转移灶,近端癌旁组织与相应的远端癌旁组织,以及患者的外周血;然后对这些样本分别进行了全外显子测序、甲基化芯片、定量蛋白质组和磷酸化蛋白质组等多组学数据采集。
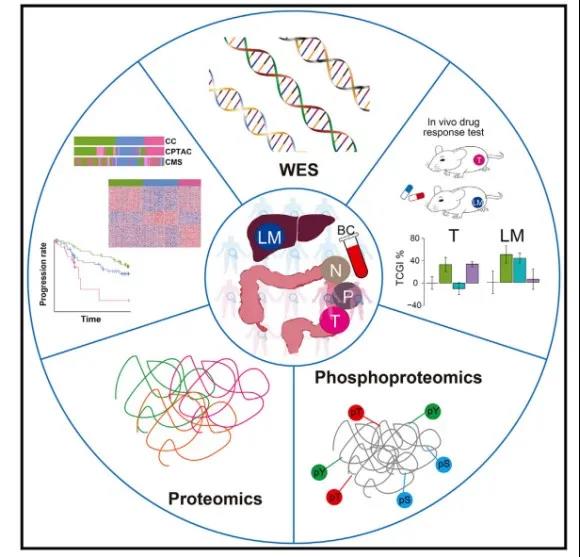 图2 研究示意图
图2 研究示意图
通过定量蛋白质组数据分析,划分出了三个具有显著不同功能偏好的结直肠癌分子亚型:
CC1:对RNA的增加处理+DNA错配修复(MMR);
CC2:上调蛋白在细胞外基质(ECM)-受体相互作用、局部免疫粘附和免疫相关通路富集;
CC3:上调DNA复制以及代谢通路同时富集。
 图3 蛋白质分子分型
图3 蛋白质分子分型
三类亚型的预后有显著差异:三种亚型的无复发生存(RFS)率存在显著差异(p=0.014)(图4B);并且在转移性结直肠癌(mCRC)患者中,与CC1+CC2亚型相比,CC3亚型的RFS最低(p=0.004)(图4C)。该分型为CRC的孤立预后因素。
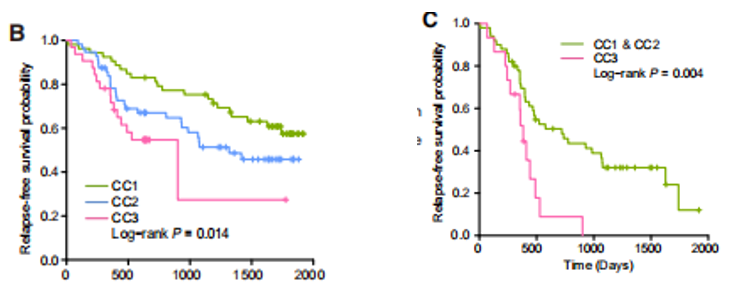 图4 不同分型CRC的RFS
图4 不同分型CRC的RFS
张卫教授表示:“我们的研究很特别的一点是,基于定量蛋白质组的三分型,仅在晚期癌症患者中,也能有效区分预后,这为晚期癌症患者临床决策和及时治疗提供了重要指标。并且我们还发现:基于原发灶的磷酸化蛋白质组定量谱,提示蛋白质磷酸化调节的异常与肿瘤转移显著相关,那么就能够有效判别结直肠癌患者的转移情况,及时采取措施。”
2、创新二:转移灶与原发灶在蛋白组学水平上存在差异
研究还发现同一患者转移灶相比于原发灶的突变图谱并没有明显差异(图5A和B),但与原发肿瘤相比,转移性肿瘤有更多上调蛋白(图5F)。这些差异表达的蛋白清楚地区分了转移组织和原发组织(图5G)。转移灶中上调的蛋白与ECM-受体相互作用、药物代谢、细胞黏附和紧密连接相关(图5H),而转移灶中下调的蛋白在代谢途径、脂肪酸降解、柠檬酸循环和氧化磷酸化中富集(图5H)。
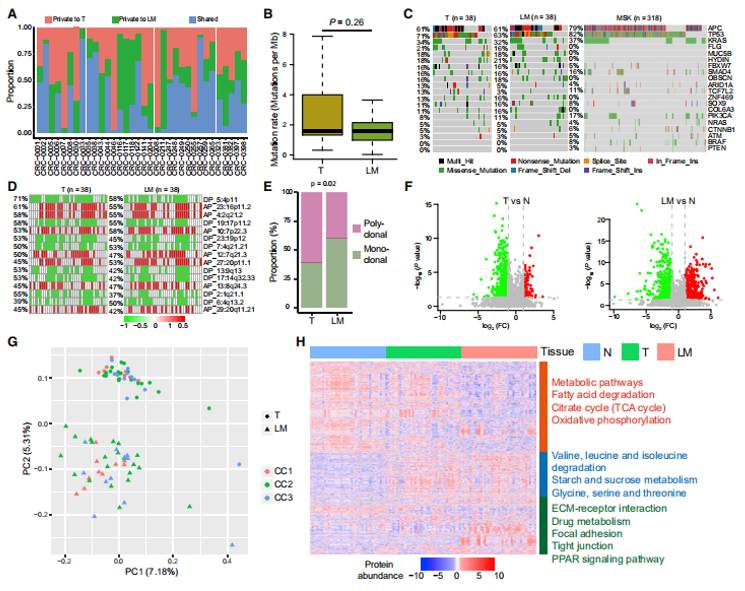 图5 患者基因图谱以及相关蛋白组学水平情况
图5 患者基因图谱以及相关蛋白组学水平情况
这与近期Nature发表的一项涵盖2520例全基因组测序数据的转移性泛癌研究结果一致,提示肿瘤转移灶和原发灶的基因组特征非常相似。但转移性结直肠癌的转移灶与原发灶在蛋白质、磷酸化修饰、激酶底物网络水平上却明显不同,表明对于转移性肿瘤的分析需要同时考虑原发灶和转移灶状态。
张卫教授补充道:
“
虽然与Nature发表的泛癌相关研究相比,结论上有一定的相似之处,但也有不同之处:
①研究对象不同:Nature研究样本量更大且针对22个不同种类的实体瘤,并纳入2300多例病人。而我们的研究将目光集中于结直肠癌以及其转移的患者。
②研究样本不同:除外肿瘤组织,我们研究的样本种类来源更精确也更丰富,包括:包括原发灶与相应的转移灶,近端癌旁组织与相应的远端癌旁组织,以及患者的外周血。
③研究手段不同:Nature研究是基于全基因组测序的研究并进行大数据的分析。我们的研究包括全外显子测序、甲基化芯片、定量蛋白质组和磷酸化蛋白质组研究。我们的数据会更加全面。
”
3、创新三:直接针对作为药靶的蛋白质进行筛选
研究者基于mini-PDX模型进行了三种激酶靶向药物(Afatinib、Gefitinib和Regorafenib)的药敏实验,验证了来自同一患者的原发灶和转移灶对同一药物表现出不同的反应。研究结果表明,对于转移性肿瘤的治疗不仅是个性化的,甚至位置也具有特异性。
研究小组构建了基于1696个边缘强度特征的弹性回归模型,用于预测药物反应。在药敏模型对应的肿瘤组织中,三种药物靶向基因几乎没有发生相关突变,然而,一些肿瘤组织却显示出良好的药物敏感性,这表明在指示药物敏感性方面,激酶底物相关性网络的判别可能比基因突变存在与否更为敏感和直接。

图6 三种激酶靶向药物药敏试验结果
张卫教授谈到:“这个研究提供给了临床医生以新思路:或许可以不再依赖于基因突变来进行靶向治疗的选择。一些没有特定基因突变的患者,在完善了多组学数据采集后,也许就能有新的希望。我们可以从蛋白组学水平,从激酶底物相关性网络水平来预判疗效或者选择药物。由此一来就可以更加完善、更加全面、更加精确地来治疗患者。”
4、未来可期:从基础到临床,从精准到更精准
对此,张卫教授表示:“在此工作基础上,研究团队正在构建更大规模的基于组学大数据肿瘤用药数据库,更深入、更精准地认识肿瘤的本质和特征。我们现在已经开展了小规模的验证性研究来寻找新的特征以及寻找相似度。最终目的是争取早日发布并在临床应用,具体指导患者用药,最终使患者获益。”
2015年“精准治疗”被首次提及,研究者对结直肠癌基因突变认识也逐渐深入:RAS、 MSI(微卫星不稳定)、BRAF、HER2等等。基于这些基因突变的发现,各种靶向药物也“横空出世”。但我们对精准治疗的认识应该仅仅停留在基因突变的层面吗?
张卫教授谈到:“我们现在对肿瘤本质的认识是远远不足的。靶向药物治疗只基于基因突变进行筛选,患者覆盖范围不够并且从临床需求上来讲也是无法满足的。因此我们应该对‘精准治疗’、‘个体化治疗’有更多外延的理解,从分子本质、从蛋白组学、从药物敏感特征等方面更加全面地践行‘精准治疗’。”
相信在不久的将来,随着肿瘤本质被不断地揭示,对抗肿瘤的手段会越来越多,肿瘤患者的生存和预后也会随之越来越可观。
参考文献:
[1] LiC, Sun YD, Yu GY, et al. Integrated Omics of Metastatic Colorectal Cancer [publishedonline ahead of print, 2020 Aug 25]. CancerCell. 2020;S1535-6108(20)30413-X. doi:10.1016/j.ccell.2020.08.002
[2] Priestley, P., et al.(2019). Pan-cancerwhole-genome analyses of metastatic solid tumours. Nature 575,210–216.