穆德广教授团队 RET抑制剂日新月异,“小众”突变走入大众视野

在NSCLC患者中,RET多以融合形式发生,发生率约为1~2%,由此可见这是一个很“小众”的驱动基因。RET融合形式包括最常见的KIF5B-RET,以及CCDC6-RET, NCOA4-RET, TRIM33-RET等 [1]。在NSCLC中,RET融合患者多以腺癌、年轻、不吸烟/轻度吸烟为主。RET突变的NSCLC患者对培美曲塞为基础的化疗方案有效,但疗效持续时间短;且对单药免疫效果差。
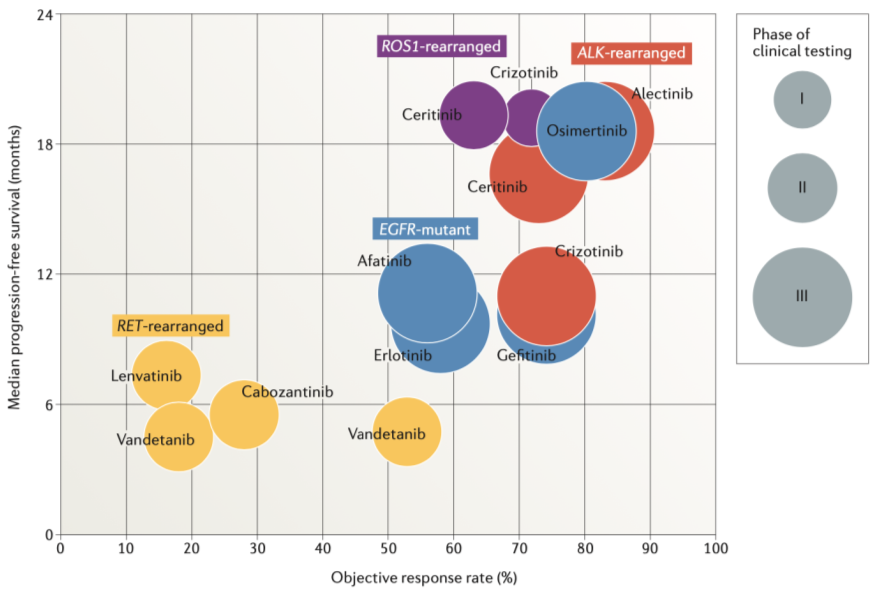
既往RET抑制剂在许多瘤种中均有探索,例如多靶点的酪氨酸激酶抑制剂(TKI)卡博替尼、凡德他尼、舒尼替尼开始,在临床前研究中展示出了不同水平的体外抑癌效果[1]。

但在NSCLC中,这些多靶点TKI的临床数据却不尽如人意。全球RET注册研究中,卡博替尼、凡德他尼、舒尼替尼中位PFS始终徘徊在2~4个月左右,而中位OS也不超过11个月 [2];而仑伐替尼虽然较这3个药物有所改善,生存数据仍然没有显著提升。
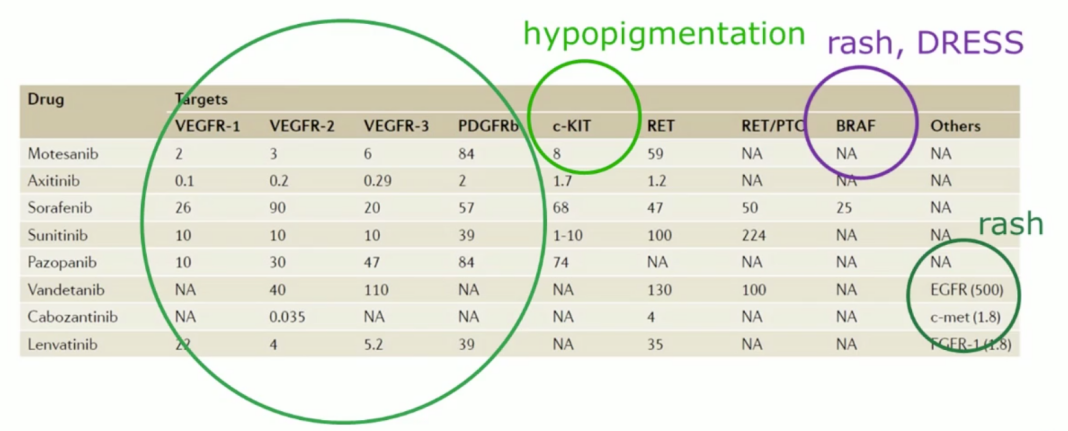
究其原因,可能与药物的血浆药物暴露率低有关;有研究表明,这类多靶点的RET-TKI多为非高选择性TKI,脱靶效应明显(针对VEGFR-1,2,3, PDGFRb, c-kit等靶点),造成了皮疹、高血压等毒性,导致大部分患者需要剂量调整,影响了疗效。
2017年,两个专门针对RET靶点设计的RET-TKI 进入了临床试验。其中BlU-667(pralsetinib) 作为针对RET靶向研发的选择性RET抑制剂,在体内外研究中表现出对多种RET重排形式更强大的抑瘤效果,同时对卡博替尼耐药克隆也有作用 [3]。以此临床前数据为基础的单臂1/2期Arrow研究,结果在今年的ASCO年会上做了相关报告。
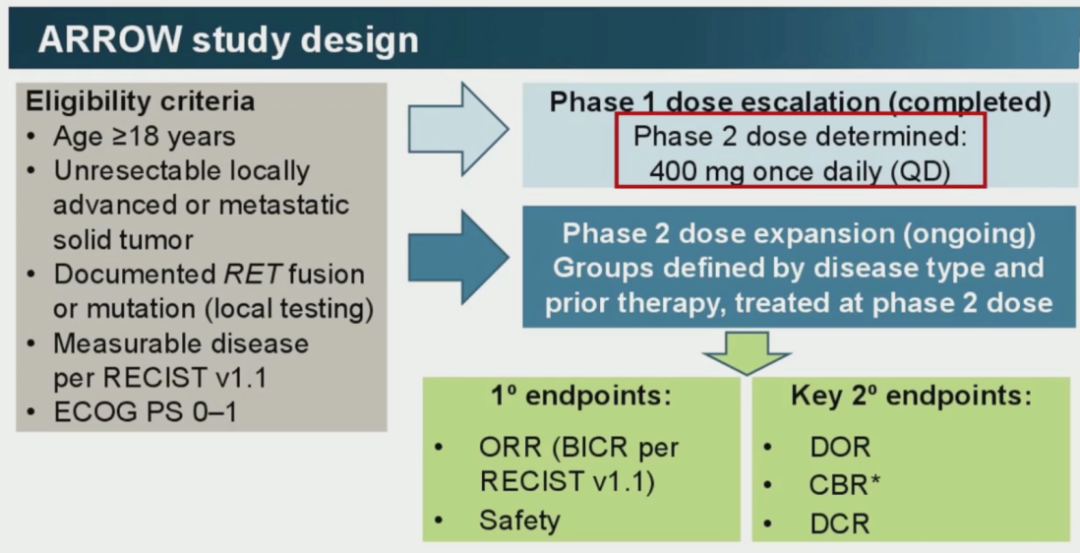
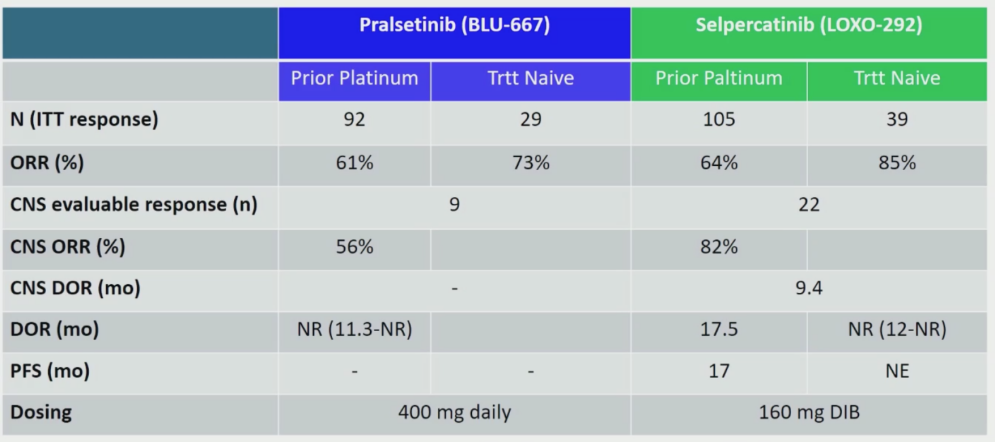
其中I期剂量爬坡阶段已结束,主要终点为ORR(客观缓解率)和安全性。根据I期剂量爬坡的结果,400mg QD为2期推荐剂量。2期剂量扩展部分正在进行,终点包括DOR(缓解持续时间),CBR(临床获益率)和DCR(疾病控制率)。ITT疗效评估的132例NSCLC患者中,ORR达到66%,其中92例接受过含铂化疗和29例初治患者,ORR分别达到了61%和73%。BLU-667治疗RET+的NSCLC的患者CR率高达10%,远高于NSCLC化疗和其他靶点靶向治疗CR率。孤立评审委员会评估的CNS活性中,9例存在可测量CNS转移灶患者,颅内ORR达到了56%,其中3例患者达到了颅内CR。
另一种RET高选择性抑制剂,LOXO-292(selpercatinip) 的1/2期LIBRETOO-001研究,结果发表在NEJM杂志 [4]。
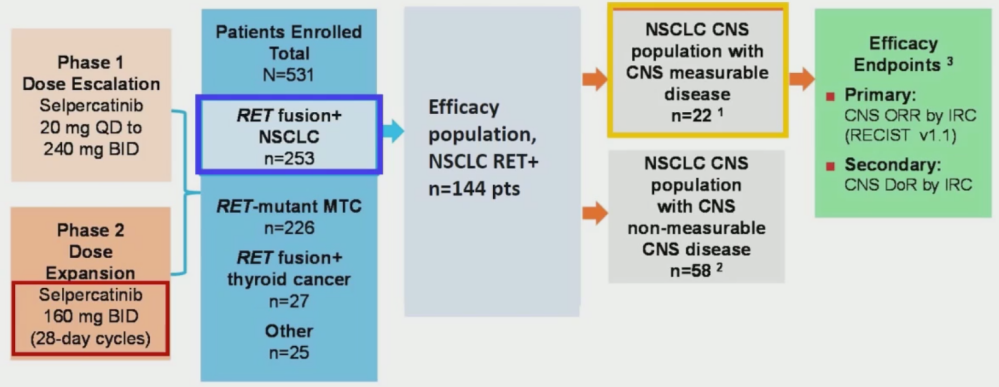
在以160mg QD给药方案的39例初治患者中,ORR 达到了85%;105例既往接受过含铂化疗方案的患者ORR 为64%。22例伴有CNS的患者 ORR达到了81.8%,没有患者发生颅内PD。在讨论环节中,本次报告的讲者David Planchard 教授对这一数据给予的评价是“神奇的疗效”(magic efficacy)。既往接受含铂化疗患者的中位DOR和中位PFS分别为17.5个月和17个月;这群患者中,无论既往是否接受过PD-1/PD-L1抑制剂、是否接受多靶点TKI治疗,ORR均类似。

从疗效角度来看,LOXO-292和BlU-667均明显优于老一代非选择性RET抑制剂,但这些数据均基于单臂1/2期研究,生存获益的疗效确认仍需要RCT给出答案。
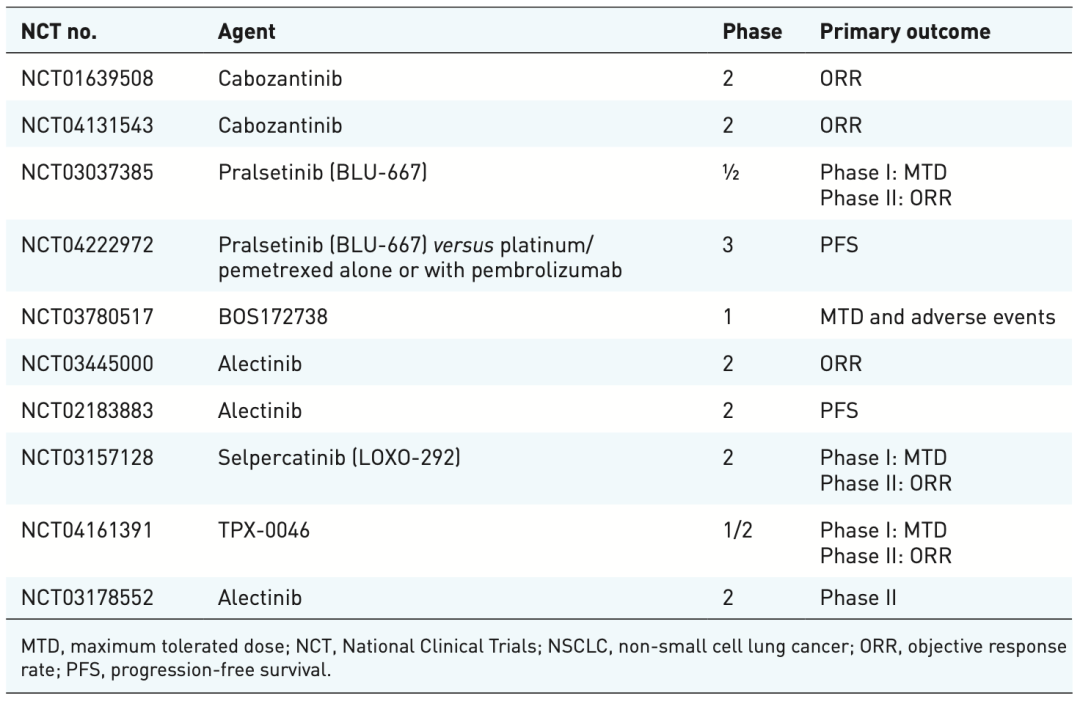
目前RET突变的NSCLC一线在研的RCT研究还包括:AcceleRET Lung研究(NCT04222972),Blu-667一线对照研究者选择的含铂化疗方案±帕博利珠单抗;LIBRETTO-431研究(NCT04194944),LOXO-292一线对照培美曲塞/铂类±帕博利珠单抗。期待这些RCT研究结果给出更加惊艳的数据。
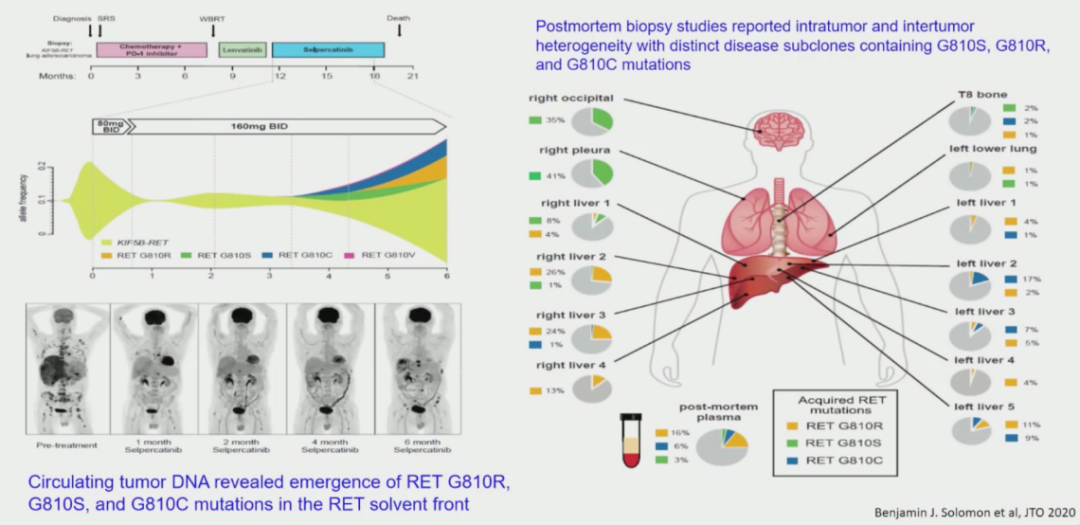
在RET抑制剂耐药机制的探索上,近期也有诸多研究发表。目前已探明的RET抑制剂耐药机制是旁路激活,包括KRAS扩增 [5] 和MET扩增[6]。今年Solomon教授等学者也报道了RET抑制剂“在靶“(on-target) 耐药机制。患者接受LOXO-292治疗后,ctDNA检出RET可溶性表面G810突变[7],包括G810R, G810S, G810C,且这些突变早于临床进展前几个月即可在外周血中被检测到。
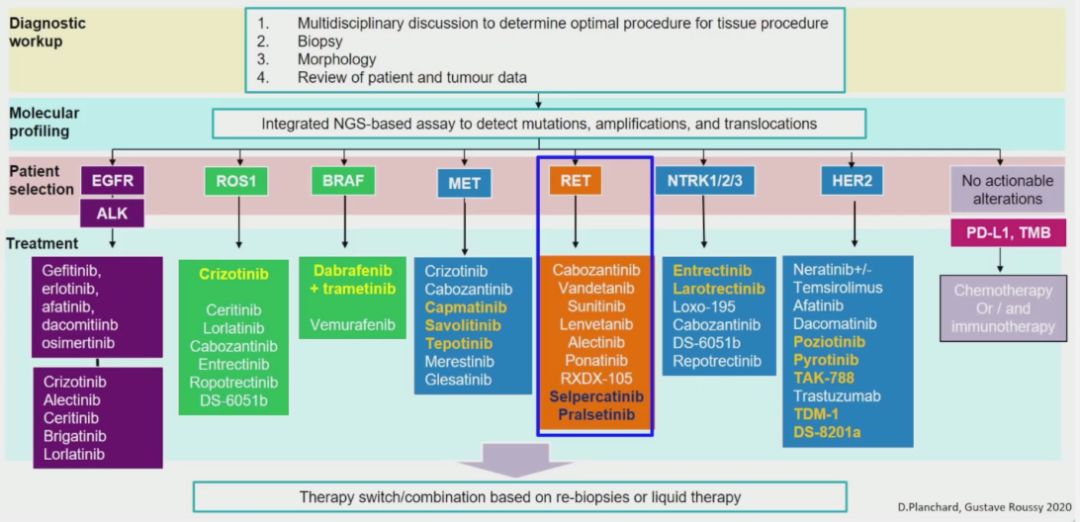
RET融合作为NSCLC的治疗靶点,从非选择性的RET TKI到高选择性的RET TKI,疗效显著提高,其他RET TKI的研究也正在进行中 [8]。
尾记
虽然RET作为靶点的探索研究已初有成效,但仍有许多问题有待探索,包括不同的融合伴侣是否疗效差异、既往接受PD-1/PD-L1抑制剂是否影响RET抑制剂疗效等。
从一个NSCLC被忽略的小众靶点,到高选择性RET TKI展示出惊艳的临床疗效,针对RET靶点的药物在NSCLC中的研发道路从未止步。而在NSCLC靶向治疗的版图上,Blu-667和LOXO-292的出现更是填补了RET靶向疗效欠佳的空白,让RET突变正式走入了大众视野。我们也期望在未来的ASCO和ESMO上能有更加瞩目的研究成果得以展现。
参考文献
1. Drilon A, Hu ZI, Lai GGY, Tan DSW. Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes. Nat Rev Clin Oncol. 2018;15(3):151-67.
2. Gautschi O, Milia J, Filleron T, Wolf J, Carbone DP, Owen D, et al. Targeting RET in Patients With RET-Rearranged Lung Cancers: Results From the Global, Multicenter RET Registry. J Clin Oncol. 2017;35(13):1403-10.
3. Subbiah V, Gainor JF, Rahal R, Brubaker JD, Kim JL, Maynard M, et al. Precision Targeted Therapy with BLU-667 for RET-Driven Cancers. Cancer Discov. 2018;8(7):836-49.
4. Drilon A, Oxnard GR, Tan DSW, Loong HHF, Johnson M, Gainor J, et al. Efficacy of Selpercatinib in RET Fusion-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2020;383(9):813-24.
5. Lin JJ, Liu SV, McCoach CE, Zhu VW, Tan AC, Yoda S, et al. Mechanisms of Resistance to Selective RET Tyrosine Kinase Inhibitors in RET Fusion-Positive Non-Small Cell Lung Cancer. Ann Oncol. 2020. Sep 29;S0923-7534(20)42465-2.
6. Zhu VW, Madison R, Schrock AB, Ignatius Ou SH. Emergence of High Level of MET Amplification as Off-Target Resistance to Selpercatinib Treatment in KIF5B-RET NSCLC. J Thorac Oncol. 2020;15(7):e124-e7.
7. Solomon BJ, Tan L, Lin JJ, Wong SQ, Hollizeck S, Ebata K, et al. RET Solvent Front Mutations Mediate Acquired Resistance to Selective RET Inhibition in RET-Driven Malignancies. J Thorac Oncol. 2020;15(4):541-9.
8. Stinchcombe TE. Current management of RET rearranged non-small cell lung cancer. Ther Adv Med Oncol. 2020;12:1758835920928634.