转移性肺癌免疫治疗与靶向治疗重磅研究新进展
2020 ESMO线上年会已圆满落幕,大会期间,在转移性非小细胞肺癌(NSCLC)领域有多项重磅研究公布。一起来回顾下,口头报告专场的部分重磅研究进展吧!
ESMO口头报告专场:免疫治疗
EMPOWER-Lung 1达到主要终点:PD-L1高表达NSCLC一线治疗再添利器!
背景:对于PD-L1≥50%且无驱动基因突变的晚期NSCLC患者,PD-L1/PD-1单抗或联合化疗是可选的治疗方案。
Cemiplimab是一种高亲和力人源化PD-1单抗,已获美国FDA批准用于晚期皮肤鳞状细胞癌(CSCC)的治疗。在I/II期临床研究中,Cemiplimab在包括NSCLC在内的其他实体瘤中显示出较好的安全性和初步的抗肿瘤活性。
EMPOWER-Lung 1是一项多中心、开放标签、全球III期临床研究,旨在评估Cemiplimab对比研究者选择的双药化疗在初治IIIB、IIIC或IV期鳞状或非鳞状且PD-L1≥50% NSCLC患者中的疗效和安全性。
方法:入组患者按1:1比例随机分配接受cemiplimab(350 mg Q3W IV)或研究者选择的化疗。进展后允许交叉至化疗组或cemiplimab组。主要终点为孤立审查委员会(IRC)评估的总生存期(OS)和无进展生存期(PFS)。数据截止日期为2020年3月1日。
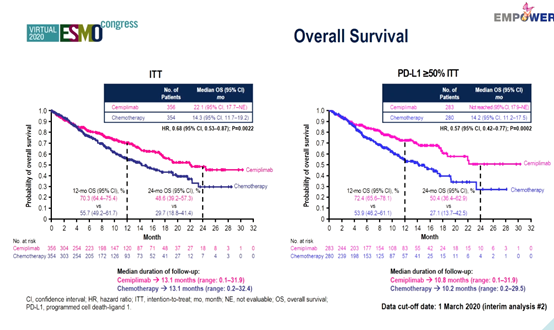
结果:中位随访13.1个月时,ITT人群中,cemiplimab组(n = 356)和化疗组(n = 354)的中位OS分别为22.1个月和14.3个月(HR=0.68,P= 0.0022),两组的中位PFS分别为6.2个月和5.6个月(HR=0.59,P < 0.0001)。在PD-L1≥50% ITT人群中,cemiplimab组(n = 283)和化疗组(n = 280)的中位OS分别为未达到和14.2个月(HR=0.57,P = 0.0002),两组的中位PFS分别为8.2个月和5.7个月(HR=0.54,P < 0.0001)。

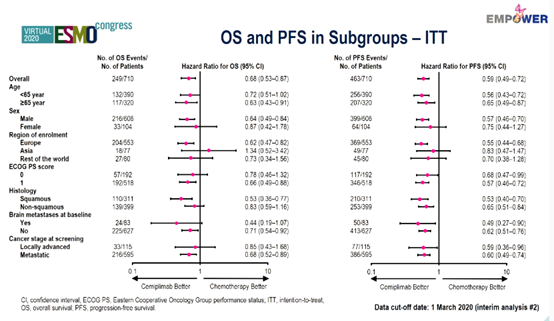
OS和PFS亚组分析结果见下图
化疗组中73.9%患者进展后交叉至cemiplimab组接受治疗,cemiplimab组中31.6%患者进展后接受了cemiplimab+化疗。
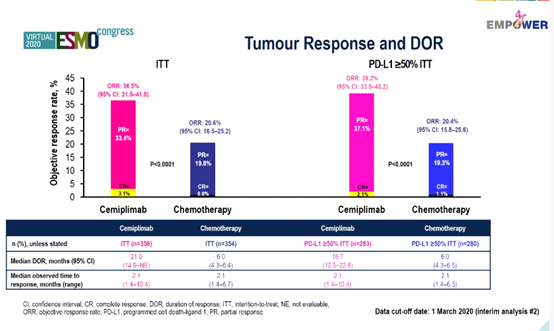
在ITT人群中,与化疗相比,cemiplimab的客观缓解率(ORR)更高(36.5% vs 20.6%),中位缓解持续时间(DOR)更长(21.0个月vs 6.0个月),≥3级不良事件的发生率更低(37.2% vs 48.5%)。
在PD-L1≥50% ITT人群中,与化疗相比,cemiplimab的ORR更高(39.2% vs 20.4%),中位DOR更长(16.7个月vs 6.0个月)。
结论:EMPOWER-Lung 1研究达到了主要终点和次要终点。结果显示,尽管化疗组患者进展后的交叉率较高,与化疗相比,cemiplimab一线单药治疗仍可显著改善PD-L1≥50%晚期NSCLC患者的OS和PFS。研究结果为cemiplimab用于该类患者的一线治疗提供了依据。
纳武利尤单抗+卡铂/紫杉醇+贝伐珠单抗或成非鳞状NSCLC一线治疗新选择
背景:纳武利尤单抗已获批用于NSCLC的二线及以上治疗。研究显示,细胞毒化疗联合抗血管生成药物可增加免疫检查点抑制剂的临床获益。
ONO-4538-52/TASUKI-52是探索纳武利尤单抗+铂类+贝伐珠单抗用于非鳞状NSCLC患者一线治疗的首项随机双盲、III期临床研究。
方法:初治EGFR/ALK突变阴性IIIB/IV期或复发非鳞状NSCLC患者,按1:1比例随机分配接受纳武利尤单抗(360mg)或安慰剂+卡铂(AUC 6)/紫杉醇(200 mg/m2)+贝伐珠单抗(15 mg/kg)治疗。每3周一次,最长持续6个周期。随后接受纳武利尤单抗或安慰剂+贝伐珠单抗维持治疗,直至疾病进展或产生不可接受的毒性。主要终点是孤立放射学审查委员会(IRRC)评估的PFS。
结果:2017年5月至2019年6月期间,研究纳入日本、韩国和中国台湾共550例患者,275例(纳武利尤单抗组)和275例(安慰剂组)接受了≥1剂研究药物治疗。
2020年7月中期分析时,中位随访时间为13.7个月,纳武利尤单抗组的PFS显著长于安慰剂组,两组的中位PFS分别为12.1个月和8.1个月(HR=0.56,P<0.0001),两组的12个月PFS率分别为50.1%和30.2%。
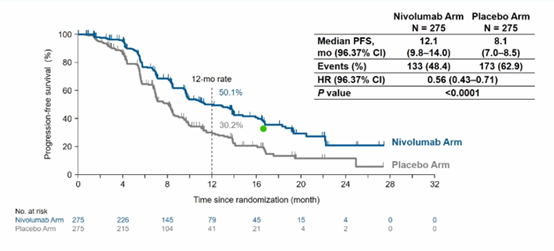
亚组分析显示了与总人群一致的PFS获益。
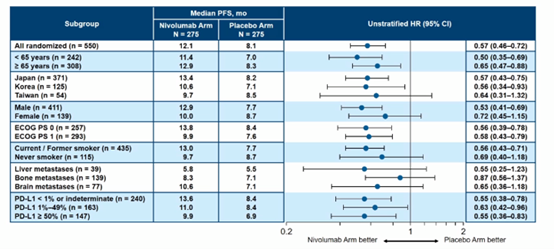
由IRRC评估的两组的ORR分别为61.5%和50.5%,两组的中位DOR分别为11个月和7个月。
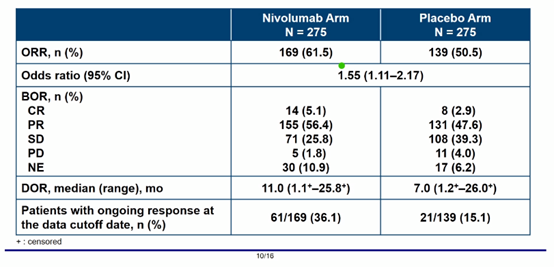
OS虽然不成熟,但与安慰剂组相比, 纳武利尤单抗组OS有延长趋势(HR=0.85)。两组分别有73.6%和16.5%、72.0%和4.4%的患者观察到3级或4级治疗相关不良事件(TRAE)和导致治疗中止的TRAE。最常观察到的不良事件为脱发、外周感觉神经病变和中性粒细胞计数降低。
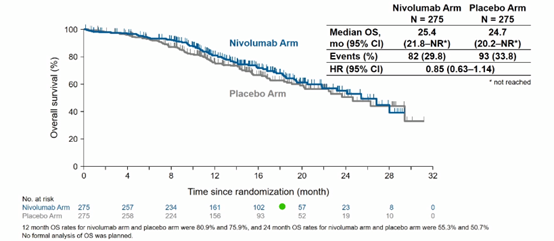
结论:ONO-4538-52/TASUKI-52研究达到了主要终点,纳武利尤单抗+卡铂/紫杉醇+贝伐珠单抗显著延长了非鳞状NSCLC患者的PFS,且具有可控的安全性。
WJOG @Be达到主要终点:阿替利珠单抗+贝伐珠单抗或成高表达PD-L1 NSCLC患者新希望
背景:肿瘤细胞PD-L1表达是PD-1/PD-L1抗体治疗晚期NSCLC疗效的预测指标之一。在PD-L1高表达患者中,与铂类双药化疗相比,帕博利珠单抗或阿替利珠单抗均可延长患者OS。
研究显示,贝伐珠单抗可增强细胞毒化疗和EGFR TKI用于非鳞状 NSCLC的疗效。此外,临床前研究显示,贝伐珠单抗也可增强PD-1/PD-L1抗体的抗肿瘤活性。
方法:WJOG @Be是一项单臂II期研究,旨在探索阿替利珠单抗(1200 mg/bw)+贝伐珠单抗(15 mg/kg)一线治疗PD-L1高表达患者的疗效。两种药物均于第1天给药,q3w,直至疾病进展。入组标准包括经病理学确认为晚期非鳞状 NSCLC、无任何EGFR/ALK/ROS1突变、ECOG体能状态评分为0-1、经Dako 22C3抗体检测为PD-L1表达≥50%。主要终点是中心审查委员会(CRC)评估的ORR。次要终点为PFS、DOR、OS和安全性。
结果:2018年8月至2020年1月期间,研究纳入14家研究中心的40例患者。其中,33例(83%)为男性,中位年龄为68,36例(90%)有吸烟史。1例患者不合格,未接受治疗。截至2020年3月31日,39例患者中无患者能达到完全缓解(CR),25例患者达到部分缓解(PR),ORR为64.1%。
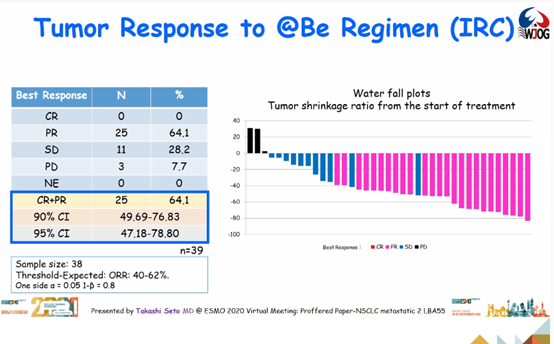
1年PFS率为54.9%。中位治疗周期数为12(1-27)。
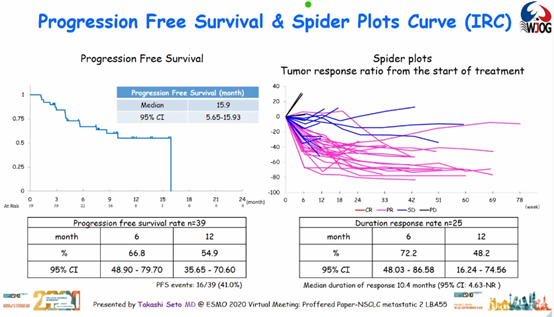
19例患者中止了治疗,其中17例和2例患者中止治疗的原因分别为疾病进展和免疫相关不良事件,包括硬化性胆管炎和脑病。
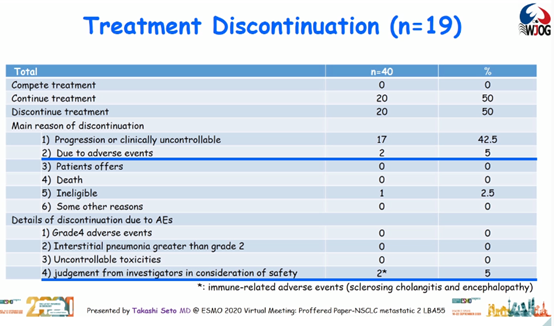
结论:研究达到主要终点,结果支持阿替利珠单抗+贝伐珠单抗可作为PD-L1高表达非鳞状NSCLC患者的潜在一线治疗选择。
ESMO口头报告专场:靶向治疗
中国之声 | 张力教授团队:阿帕替尼+吉非替尼替尼显著改善中国NSCLC患者PFS
背景:敏感EGFR突变见于10%白人患者和50%亚裔患者中。EGFR TKI是目前敏感EGFR突变NSCLC患者的标准一线治疗方案,但大部分患者最终会产生获得性耐药。
阻断血管内皮生长因子受体(VEGFR)通路可增强EGFR TKI在敏感EGFR突变 NSCLC患者中的疗效。阿帕替尼是一种口服小分子VEGFR2 TKI,阿帕替尼+吉非替尼在临床研究中已显示出初步的抗肿瘤活性。
ACTIVE是由中山大学肿瘤防治中心张力教授团队开展的一项III期研究,是探索阿帕替尼+吉非替尼对比安慰剂+吉非替尼用于敏感EGFR突变NSCLC一线治疗的首个III期研究。
方法:初治敏感EGFR突变(ex19del或L858R)患者随机(1:1)接受每日一次口服阿帕替尼500 mg+吉非替尼250 mg(AG组)或安慰剂+吉非替尼250 mg(G组)。分层因素包括EGFR突变类型(ex19del,L858R)、性别和体力状况(0,1)。主要终点为IRRC评估的PFS。次要终点包括研究者评估的PFS(INV)、OS、ORR、DCR(疾病控制率)、DOR和安全性等。
结果:研究纳入中国30个地区的313例NSCLC患者(AG组:n = 157;G组:n = 156)。中位随访时间15.8个月时,AG和G组由IRRC评估的中位PFS分别是13.7个月和10.2个月(HR = 0.71,P= 0.0189),亚组分析显示,ex19del患者获益更明显,优于L858R突变(HR = 0.67)。
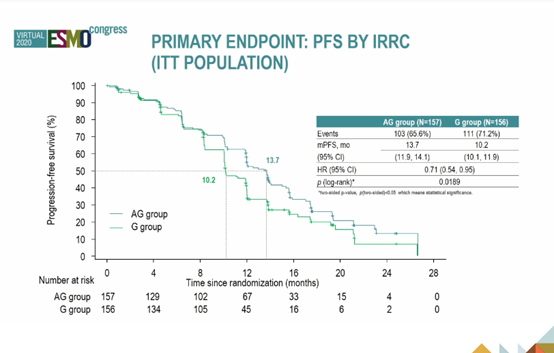
研究者评估的PFS分别为13.8个月和12个月(HR = 0.71,P= 0.0186)。时间截止时OS数据不成熟(29.4%事件)。AG和G组的ORR分别为77.1%和73.7%(P = 0.5572),两组的中位DCR分别为12.9个月和9.3个月(HR=0.64,P=0.005)。
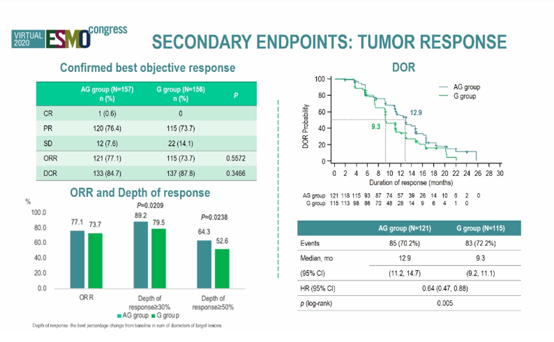
基线样本NGS结果显示,TP53突变类型的PFS略有改善。TP53外显子8突变的患者显著受益于双药治疗(HR = 0.24)。两组的3-4级不良事件(AE)相似,但AG组高血压和蛋白尿风险增加。未见超出预期的AE。
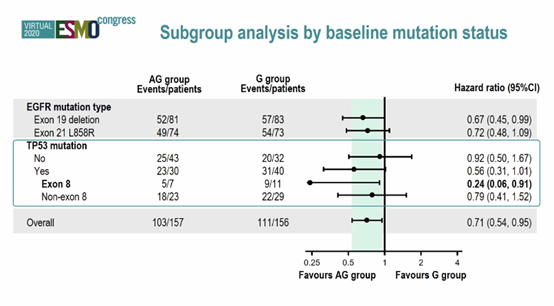
结论:阿帕替尼+吉非替尼用于敏感NSCLC患者的一线治疗,显示出了明显的PFS获益。TP53外显子8突变或可作为疗效预测指标。
AMG 510(sotorasib)用于经治NSCLC,DCR达91.2%
背景:KRAS G12 C突变见于13%NSCLC、3%-5%结直肠癌和1%-3%其他实体瘤中。sotorasib是一种新型高选择性KRAS G12 C抑制剂。
I期研究中,sotorasib在KRAS G12 C突变晚期实体瘤患者中显示了较好的安全性和初步的抗肿瘤活性。本次ESMO大会公布了sotorasib在NSCLC患者中的临床疗效,并分析了相关生物标志物数据。
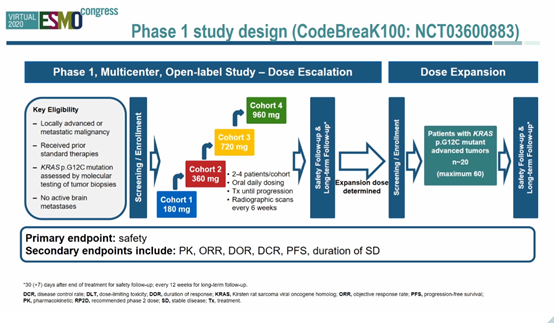
方法:这是一项多中心开放标签I期研究,包括剂量递增和剂量扩增阶段。关键入组标准包括KRAS G12 C突变和既往接受过系统性抗肿瘤治疗。主要终点是安全性,关键次要终点包括ORR、DCR、DOR和PFS。研究检测了KRAS G12 C突变等位基因频率(MAF)和PD-L1水平。
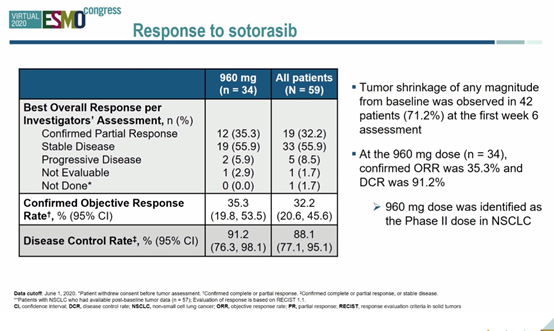
结果:截至2019年7月17日,共入组40例NSCLC患者,其中22例(55.0%)患者为女性,中位年龄为68.0岁。数据截止日期为2020年6月1日,中位随访时间为11.7个月,未出现剂量限制性毒性或致死性治疗相关不良事件。总人群的中位PFS为6.3个月。34例患者使用了960mg剂量sotorasib,12例患者达到PR,确认的ORR为35.3%,DCR为91.2%。总人群(n=59)中,19例患者达到PR,ORR为32.2%,DCR为88.1%,达到PR患者的中位PFS为10.9个月。
数据截止时,32例患者(9例PR,19例疾病稳定[SD],2例疾病进展[PD])具有可用的KRAS G12 C MAF数据。KRAS G12 C MAF与缓解无显著相关性。18例患者PD-L1数据可用,PD-1表达水平与肿瘤缓解无显著相关性。33例患者血浆肿瘤突变负荷(TMB)水平可用,TMB水平与肿瘤缓解无显著相关性。
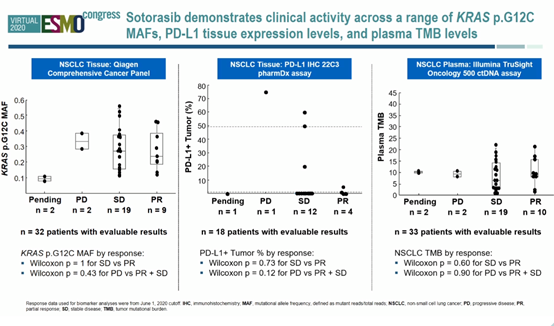
结论:在既往曾接受过治疗的NSCLC患者中,观察到sotorasib治疗能带来的持续缓解,大多数患者达到SD,中位PFS为6.3个月。目前数据显示,KRAS G12 C MAF、PD-L1表达水平和TMB水平均不能预测sotorasib的疗效。
参考文献:
1. LBA52 - EMPOWER-Lung 1: Phase III first-line(1L) cemiplimab monotherapy vs platinum-doublet chemotherapy(chemo) in advanced non-small cell lung cancer(NSCLC) with programmed cell death-ligand 1(PD-L1) ≥50%
2. LBA54 - Randomized phase III trial of nivolumab in combination with carboplatin, paclitaxel, and bevacizumab as first-line treatment for patients with advanced or recurrent non-squamous NSCLC
3. LBA55 - WJOG @Be study: A phase II study of atezolizumab(atez) with bevacizumab(bev) for non-squamous(sq) non-small cell lung cancer(NSCLC) with high PD-L1 expression
4. LBA50 - ACTIVE: Apatinib plus gefitinib versus placebo plus gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant(EGFRm) non-small-cell lung cancer(NSCLC): A multicentered, randomized, double-blind, placebo-controlled phase III trial
5. 1257O - Durability of clinical benefit and biomarkers in patients(pts) with advanced non-small cell lung cancer(NSCLC) treated with AMG 510(sotorasib)