这些针对血液肿瘤的CAR-T治疗,你一定得知道!

2020年9月24日-26日,中华医学会第16次全国血液学年会采用“线上+线下”模式召开。血液学年会上,国内外血液领域大咖云集,聚焦血液学研究最新进展。
血液肿瘤是指发生在血细胞和造血系统内的肿瘤,主要包括白血病、淋巴瘤、多发性骨髓瘤等,一般采用化学治疗和移植治疗。近年来,在血液肿瘤方面,免疫治疗得到了较大的发展,特别是嵌合抗原受体T细胞疗法(CAR-T)经过优化改良在临床治疗上取得了较好的效果。
免疫疗法是利用免疫系统来治疗疾病的方法,免疫识别需要两个信号,第一信号是抗原特异性信号,第二信号是T细胞与抗原呈递细胞(APC)表面多对共刺激分子相互作用的非特异性信号。CAR-T基本原理是把T淋巴细胞提取出来,经过改造、加工、培养,然后输到体内再清除体内的癌细胞。
本文整理自2020年9月25日中国医学科学院血液病医院王建祥教授于第16届全国血液学会议会上所作的关于血液肿瘤免疫治疗的大会汇报。
1
揭秘CAR-T作用机制
急性淋巴细胞白血病(ALL)主要表现为血液、骨髓、淋巴结、脾脏和其他器官中出现大量类似于淋巴细胞的未成熟白细胞。该病随着年龄的增加,疗效递减,疾病远期疗效非常差,因而比较难治。ALL主要治疗包括化疗、免疫疗法、靶向治疗及造血干细胞移植等。
ALL的第二免疫信号缺失,为了表达缺失分子并恢复其免疫激活途径,可以通过CD19抗体介导共刺激性分子的表达。经激活的T细胞大量增殖、扩增并分泌大量的干扰素,杀伤白血病细胞。
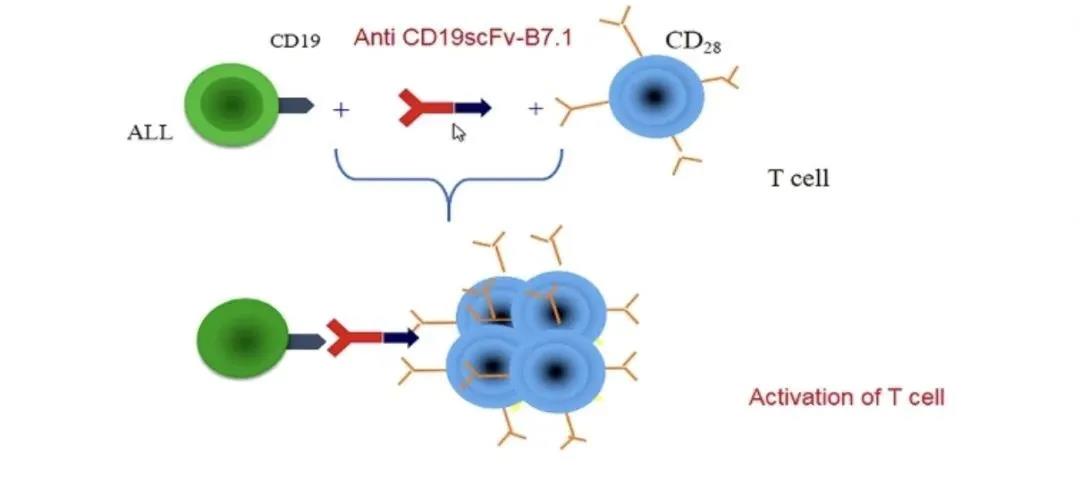
在受到抗CD19-CD80抗体刺激后,T细胞增殖、活化更加活跃并释放更多的干扰素。
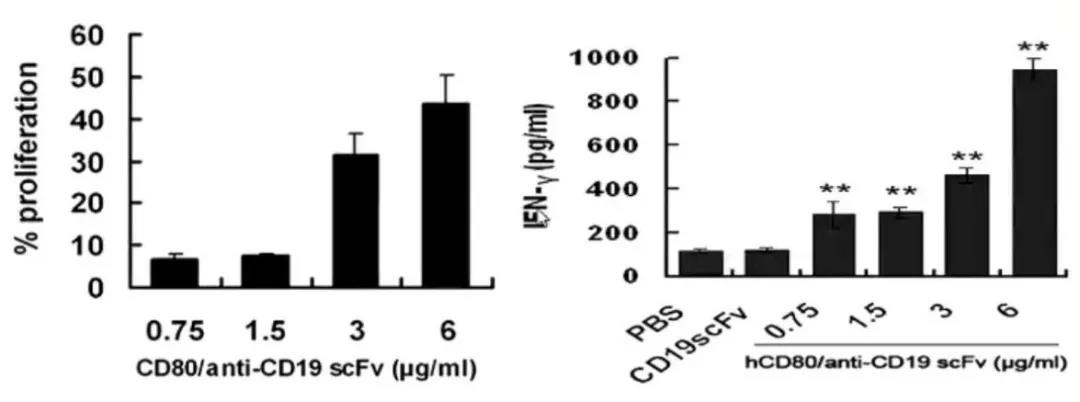
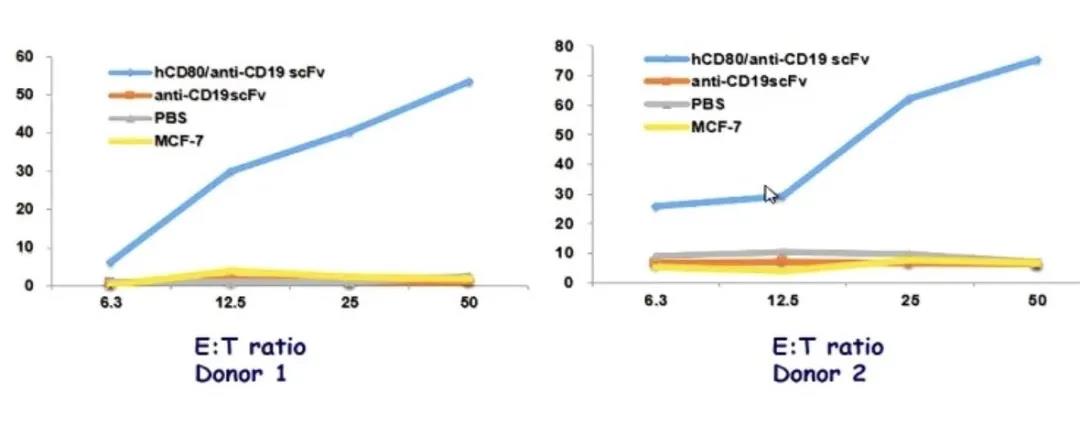
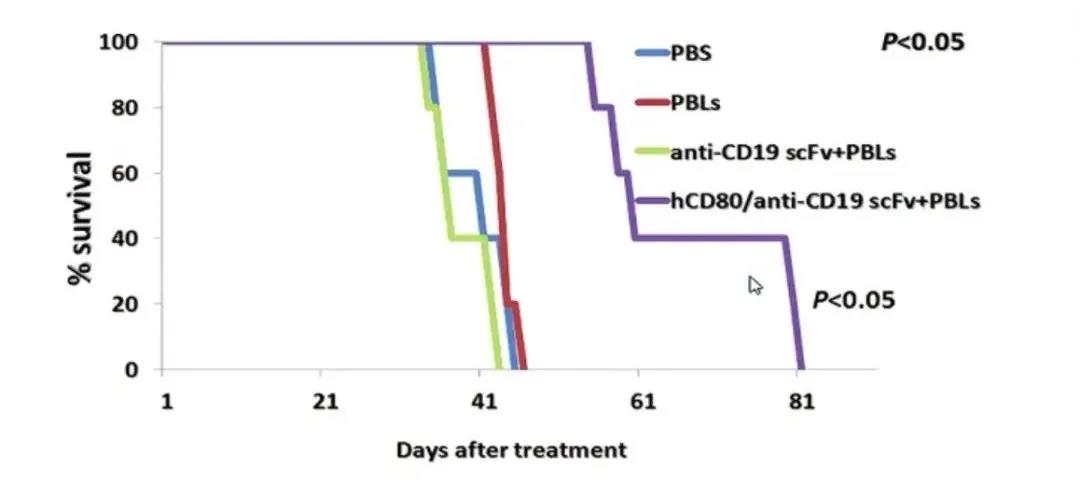
研究人员发现,抗CD19-CD80抗体成功表达共刺激分子并激活T细胞第二信号,促进T细胞增殖、活化并杀伤白血病细胞,因而抗CD19-CD80抗体组的生存率显著高于抗CD19抗体组。
但这种治疗的问题在于其抗原细胞激活、杀灭白血病细胞并非特异性的,而是一种非T细胞抗原受体(TCR)限制性激活,因此同时也会杀伤机体正常细胞。
2
双靶点CAR-T的诞生
2002年,研究人员研制出抗CD3/CD20双靶点抗体能特异性激活T细胞。

在此实验中,研究人员发现,抗CD3/CD20 双靶点抗体可以结合T细胞和B细胞,但由于科研转化体制等一系列原因限制,该项研究和产品被搁置。
后来,研究人员研发出了共刺激分子4-1BBL介导抗αCD20抗体靶向激活T细胞的方法,通过联合使用抗CD3/CD20抗体和抗4-1BBL/αCD20抗体激活T细胞第一和第二信号。进一步体内实验中发现联合基因工程设计的双靶点抗体可同时激活抗体CD3,从而发挥细胞杀伤及抗肿瘤作用。
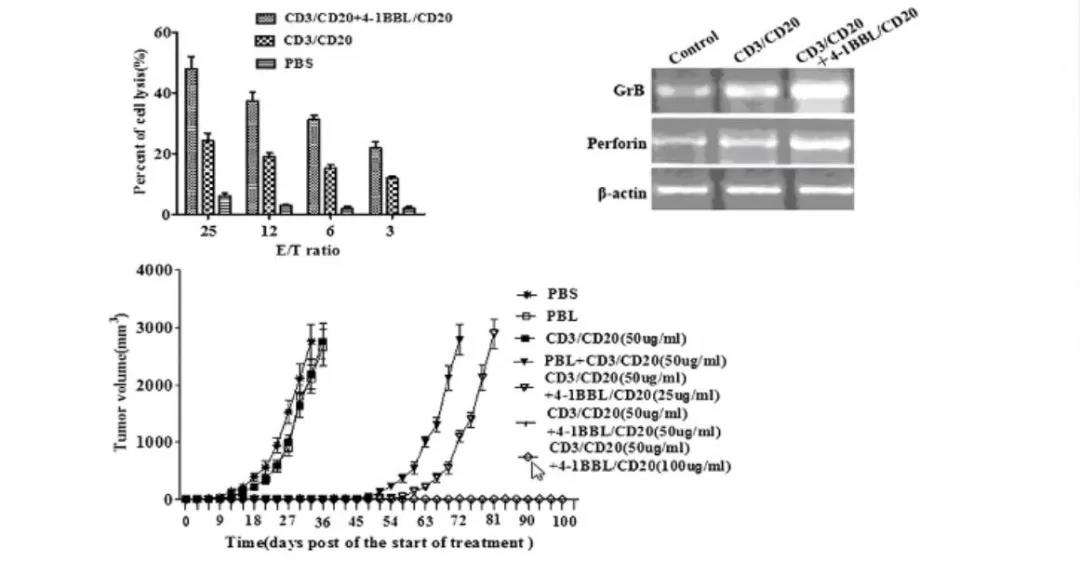
在前期识别抗体、CD3激活、共刺激分子激活的基础上,构建出逆转录病毒或者慢病毒载体来转染T细胞构建CAR-T,目前,王建祥教授团队实验室已完成针对CD19靶点的CAR-T设计:

3
CAR-T新单抗——HI19a
CAR-T设计一般都是基于FMC63单抗进行,王建祥教授采用了以往实验室所构建的杂交细胞株HI19a进行CAR-T设计。
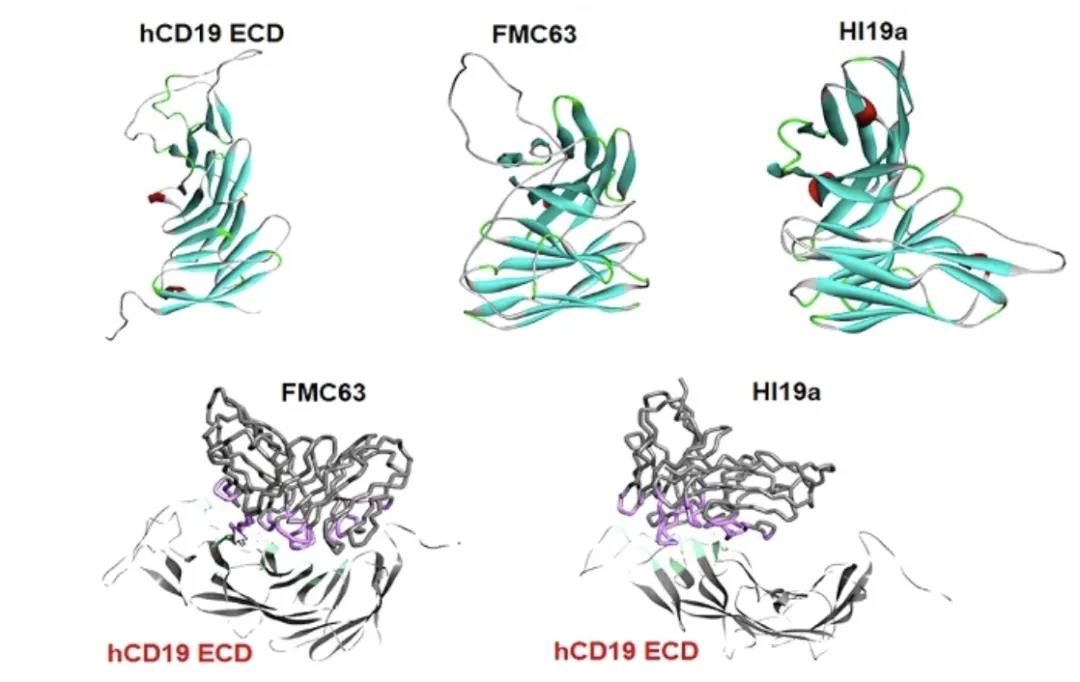
杂交细胞株HI19a在识别胞外区的抗原表位及抗体构象方面与FMC63不同,意味着这两株抗体没有交叉耐药性。使用单抗HI19a构建的抗CD19 CAR-T在体外实验中表现出对白血病细胞的特异性杀伤作用。
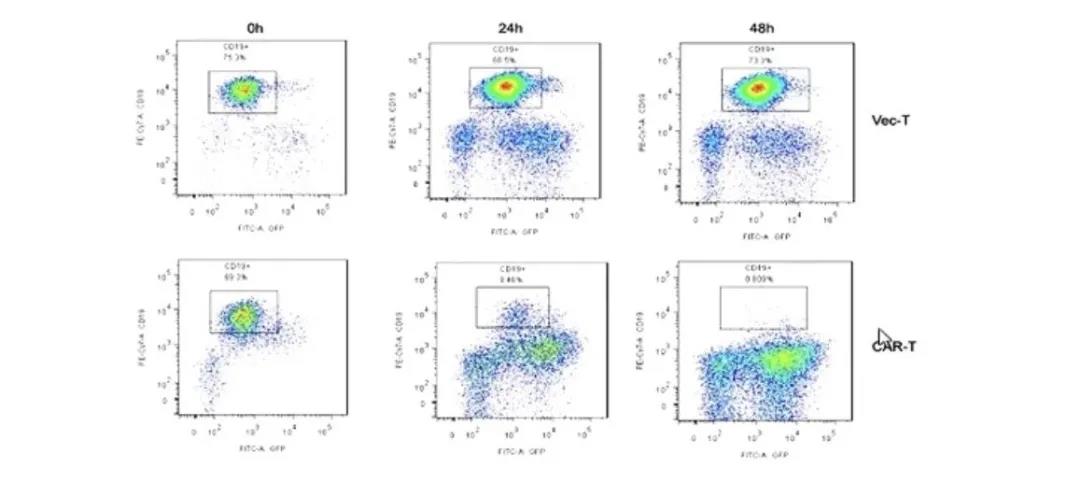
同时,体内实验也发现,使用单抗HI19a构建的抗CD19 CAR-T治疗使白血病小鼠生存时间明显延长。
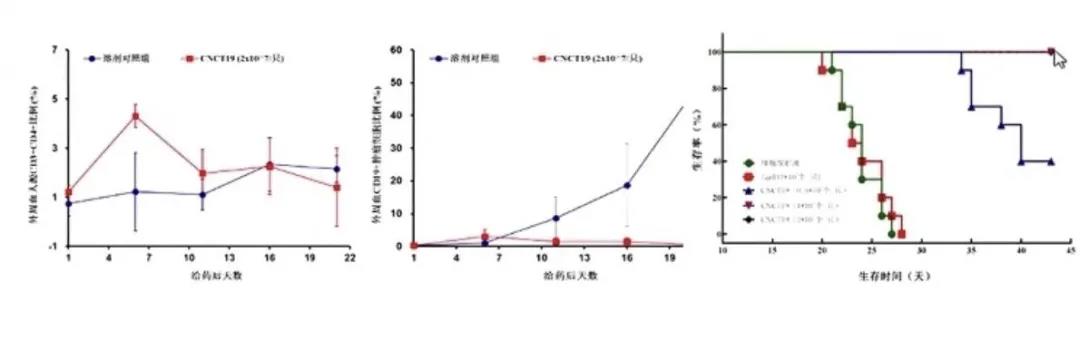
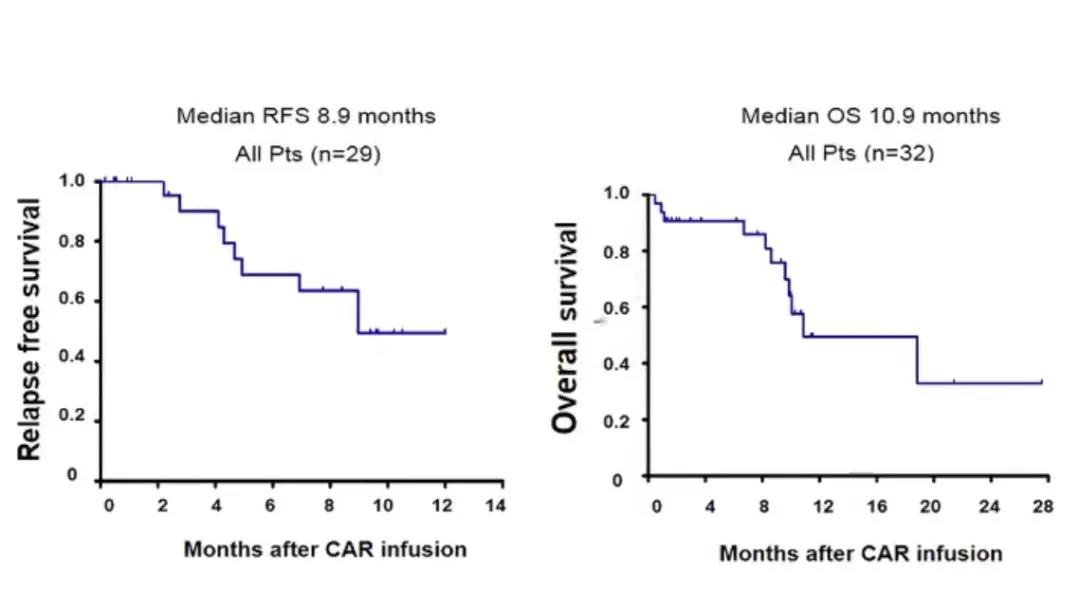
相关临床试验发现,接受CAR-T治疗后的32名患者的缓解率达90.6%[包括微小残留病灶(MRD)阴性及阳性缓解],其中包括9名经造血干细胞移植(HSCT)后复发的患者(MRD阴性缓解率达100%)及经化疗后复发及难治性ALL患者23名(MRD阴性及阳性缓解率达87%)。

目前获批的CAR-T产品和药物的适应证大多为儿童ALL和B细胞淋巴瘤,但暂无针对成人ALL的适宜CAR-T产品获批。此次临床试验发现CD19 CAR-T细胞治疗成人ALL效果显著,患者无复发生存(RFS)为8.9月,总生存(OS)达10.9月。
4
CAR-T vs. 造血干细胞移植
王建祥教授认为CAR-T治疗与造血干细胞移植不同,在难治/复发ALL患者中一般使用CAR-T治疗,使用异基因造血干细胞进行治疗的情况较为少见。对于CAR-T治疗达到缓解的患者可通过移植治疗进一步加强疗效。通过不同疾病阶段使用不同的治疗方法,使患者获得稳定的长期效果。
5
难治/复发ALL,CAR-T治疗还能有效吗
CAR-T细胞治疗一般选取自体细胞进行修饰,而使用异体细胞来源的供体多来自于病后复发的患者。
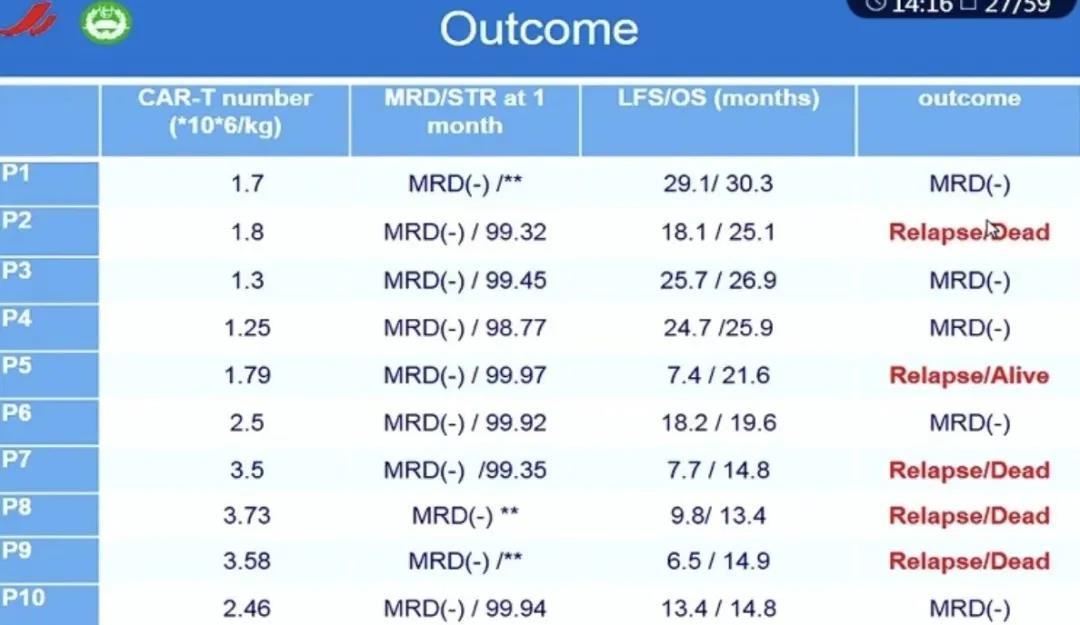
一项纳入了10例经移植治疗后复发ALL患者的研究经中位随访20.6个月后发现,使用供体来源的CAR-T细胞治疗仍能取得较好的疗效,通过CAR-T治疗后5名经造血干细胞移植的患者获得了长期生存。该研究末次随访终点时间为2020年1月31日,2.5年的OS和局部治疗失败时间(LFS)分别为51.4%和48%。
ALL复发常见部位为中枢和睾丸,针对睾丸病变的治疗以往较为有效的治疗包括化疗、放疗和手术切除。尽管化疗和放疗有较好疗效,但患者生理功能受到显著影响,而使用CAR-T治疗的7例睾丸复发的ALL患者中6例获得了长期缓解甚至治愈,其生理功能也得得以保存。国内第一例的睾丸白血病也证明了CAR-T细胞可透过血睾屏障取得治疗效果。
6
CAR-T设计新靶点
除单一靶点CAR-T外,王建祥教授团队实验室设计了针对CD19和CD22双靶点CAR-T,包括并联、串联及环状形式组合,下面是单一靶点CAR-T和多靶点CAR-T治疗后的生存情况:
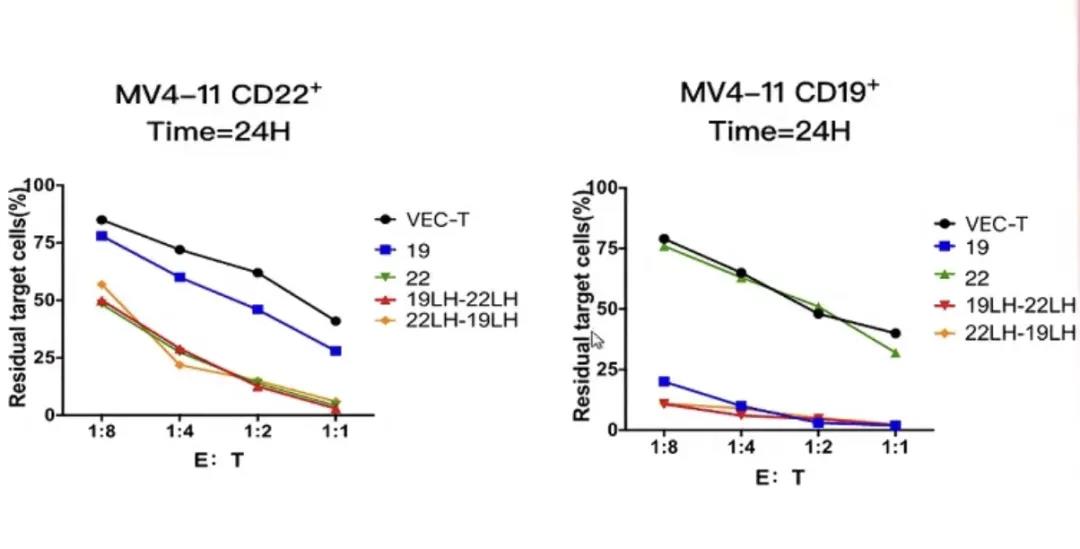
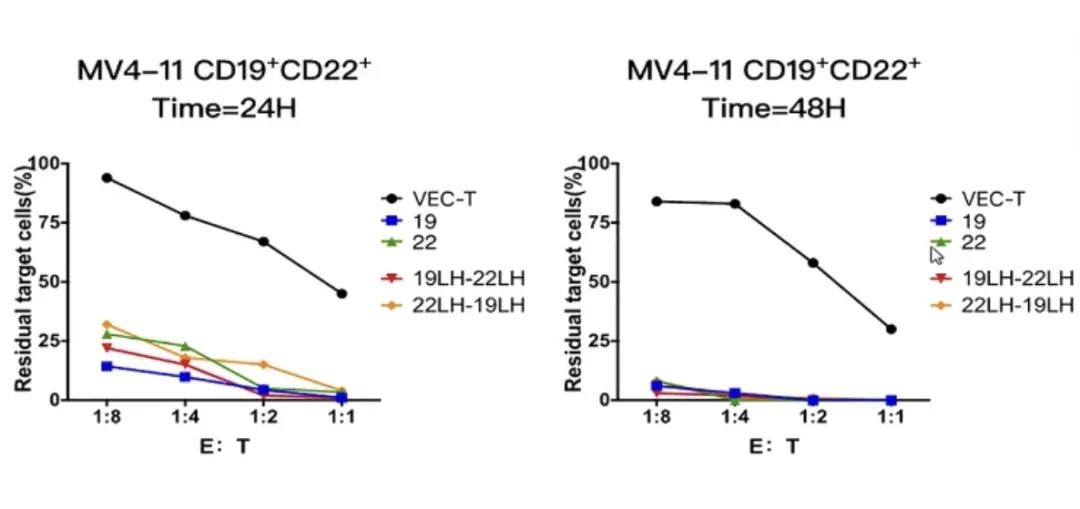
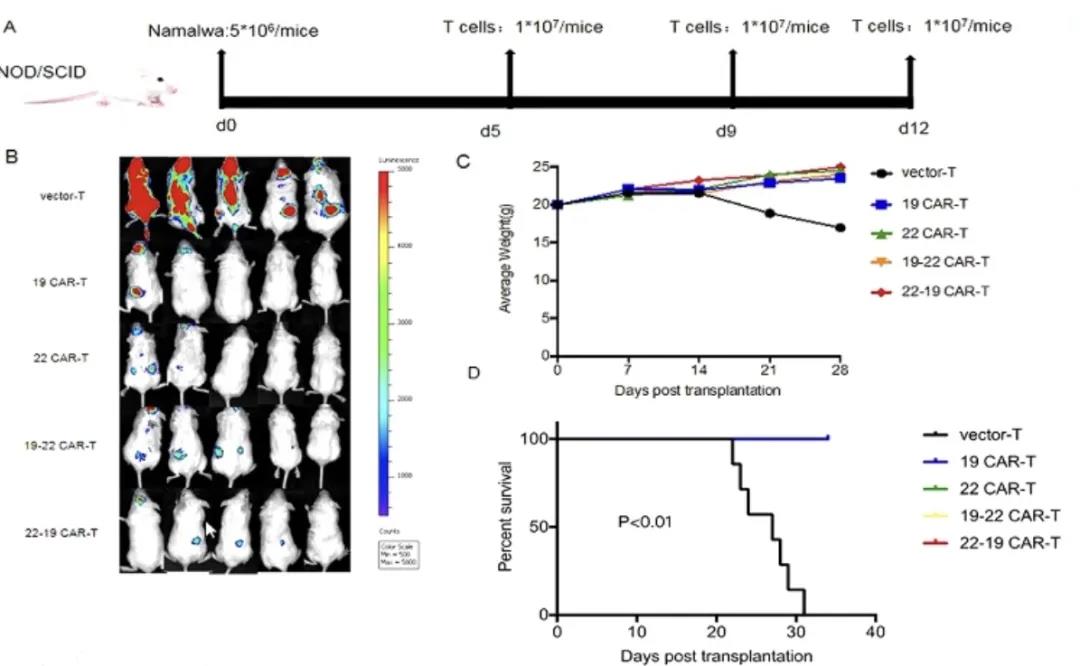
相比于单一靶点,双靶点CAR-T治疗组小鼠平均生存明显升高,双靶点CAR-T治疗能较为有效地杀灭CD19或CD22阳性的白血病细胞。
另外,在髓系白血病的探索方面,王建祥教授团队实验室做了四株抗CD123抗体,并选取较好的两株(因其可在T细胞表面表达并自我恢复的水平较高,即在T细胞滞留的水平时间比较好)中的其中一株CD123的单抗和CD33构建并联型双靶点的CAR-T。下面是该CAR-T细胞体外杀伤白血病细胞的结果:
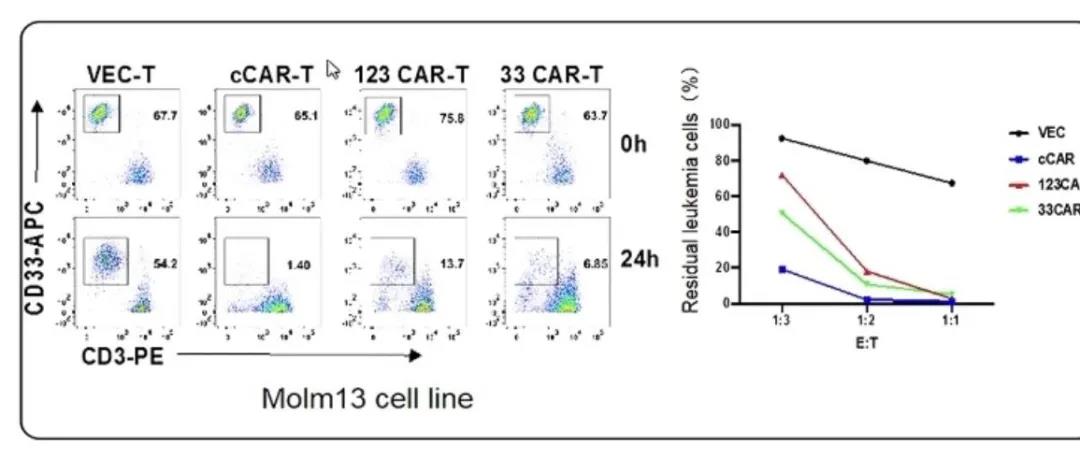
研究结果发现:双靶点CAR-T治疗组残留白血病细胞低于其他组,较单一靶点体外杀灭白血病细胞效果更好。
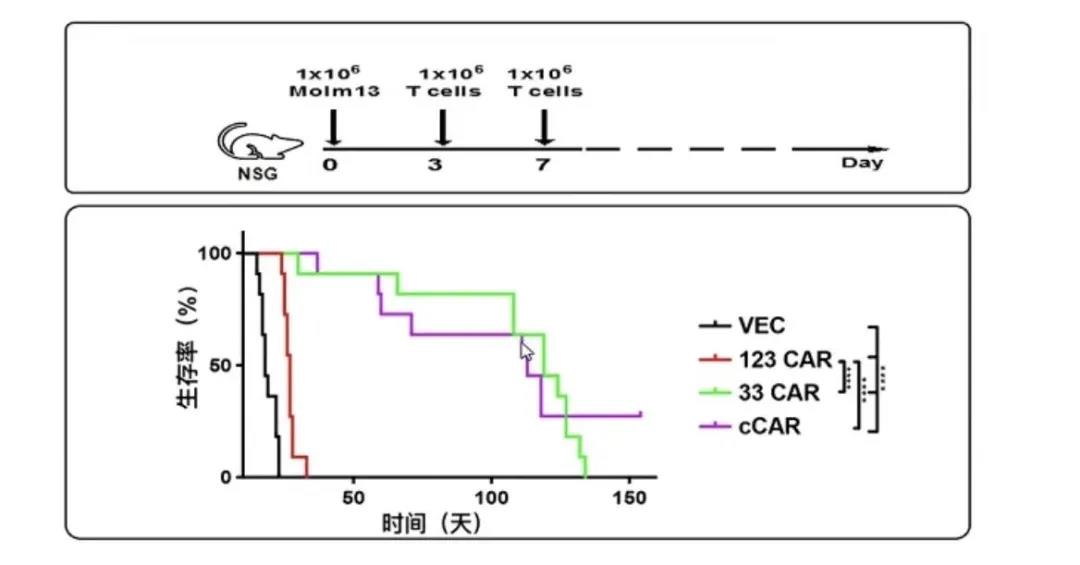
经CAR-T治疗1月后发现,使用双靶点CAR-T细胞治疗组小鼠生存率高于单一靶点CAR-T治疗组,双靶点CAR-T较CD123或CD33单一靶点CAR-T细胞在体内的白血病细胞杀伤作用较强。
7
CAR-NK——新选择,新可能!
以往研究发现,CAR-T治疗可能存在对自身正常细胞的自我杀伤作用。为了更好地特异性杀灭T细胞肿瘤,可利用自然杀伤细胞(NK)细胞——构建出不同的共刺激分子结构域,精准杀灭T细胞的肿瘤细胞。相关实验证明,NK细胞对于杀灭肿瘤细胞确有疗效。
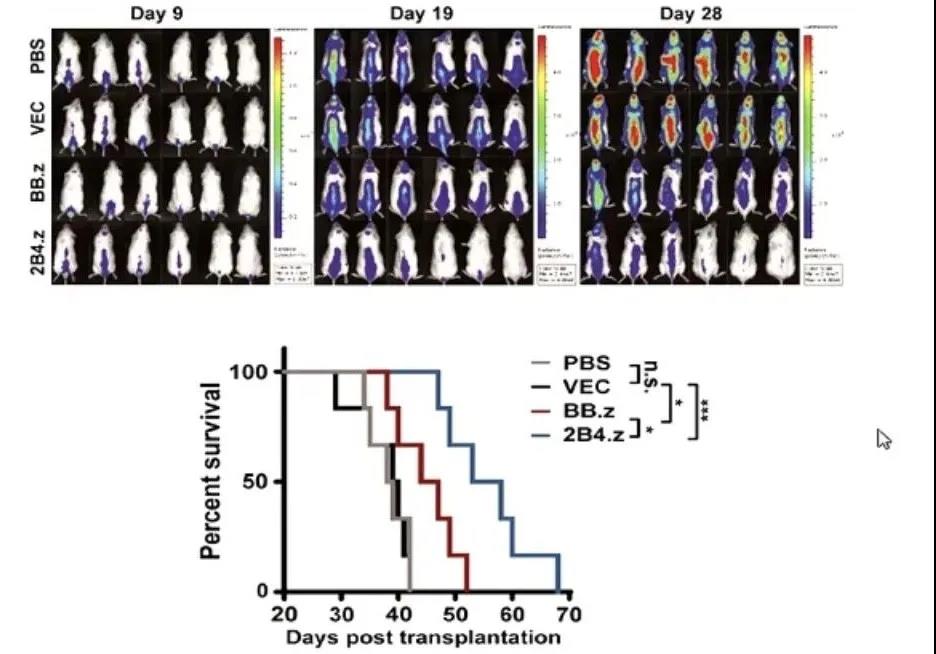
目前来讲,NK细胞是个非常好的免疫细胞来源。作为通用型的细胞来源可通过一次制备供多人使用。近年来,国内外研究人员为了寻找更好、更便利NK细胞来源,也在不断尝试更多探索。