新药时代来临 多发性骨髓瘤诱导治疗新进展 你知道多少?
2020年9月24日,来自中山大学附属第一医院的李娟教授分享了关于新药年代多发性骨髓瘤(multiple myeloma, MM)移植前诱导治疗进展的专题讲座,本文整理自其演讲内容。
MM的移植治疗分为:诱导治疗、自体干细胞移植(autologous stem cell transplantation,ASCT)、巩固治疗和维持治疗。
诱导治疗的目的是为了:
快速降低肿瘤负荷、控制症状;
获得深层次缓解,延长移植后生存期;
尽可能小的毒副作用;
不影响干细胞的动员和采集。
李教授选择了依次从三个方面进行阐述——诱导药物的进展、诱导方案的选择以及诱导终点。
Part1:诱导药物的进展
MM移植前诱导药物的演变经历了传统药物、一代新药、二代新药和单抗时代,每个时期都有不同的代表药物(图1)。

图1:移植前诱导药物的演变
(1)传统药物
传统药物中最常使用VAD方案,其完全缓解(complete response, CR)率非常低,仅5%-10%,总体反应率(overall response rate, ORR)55%-84%,但VAD方案应用不受肾功能损伤的限制,无HSC毒性。
即便如此,在这种情况下完成移植(ASCT)的患者CR率也仅为30%-40%左右,总体生存率(overall survival,OS)为4-5年,因此传统药物方案还有很大的提升空间。
(2)一代新药
因此,以硼替佐米为基础联合细胞毒药物(阿霉素等)或limids(来那度胺等)的一代新药应运而生,其诱导后的ORR达到了75%-100%,移植前CR率可达20%。而移植后的CR率可高达59%,延长无进展生存期(progression-free survival, PFS)延长至43-50个月,4年OS率>80%,与传统年代相比进步巨大。
(3)二代新药
随着新药时代进步,以伊沙佐米和卡非佐米为代表联合细胞毒药物(阿霉素等)或limids(来那度胺等)的二代药物也逐渐出现。其中以卡非佐米为基础的方案缓解率优于伊沙佐米,其ORR达到了78%-100%,移植前CR率可达20%,移植后的CR率可高达60%-78%,3年PFS高达86%,3年OS率高达93%。
(4)单抗时代
单抗时代指的是在三药基础上联合单克隆抗体治疗,可使患者ORR达100%,微小残留病(minimalresidualdisease, MRD)转阴率高达40%,移植后的CR率可高达22.6%-83%,2年PFS达90%,2年OS率达90%。
诱导治疗演变进程如下图2所示,单克隆抗体有很好的MRD转阴率,但我国CD38单抗尚未纳入临床一线使用。
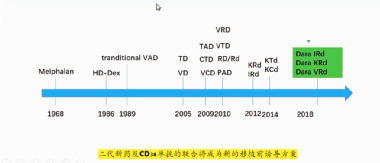
图2:MM患者移植前诱导治疗方案的演变。
Part2:诱导方案选择原则
那么,在如此多的方案中如何选择出疗效好、毒副作用少、不影响患者干细胞动员和采集的最佳方案呢?
一代新药中含硼替佐米方案优于不含硼替佐米的方案,其中VRD方案是硼替佐米的最佳联合方案,其疗效最优、毒副作用最小(图3)
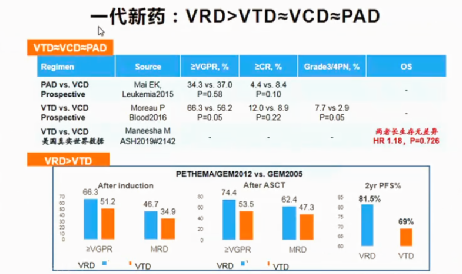
图3:VRD方案是硼替佐米的最佳联合方案
注射用硼替佐米同时拥有1.0mg、2.5mg和3.2mg适合国人体表面积、经济实惠,来那度胺胶囊也具有5mg、10mg和25mg适合对肾功能不全的患者进行调整药物剂量。
二代新药的疗效优于一代新药,其中二代KRD方案CR率为35%,VGPR为87%,而一代VRD方案CR率为14%,VGPR为68%(图4)
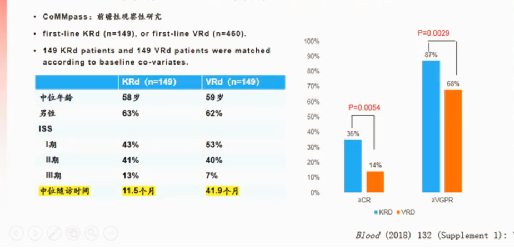
图4:一二代新药VRD与KRD疗效对比
■ 那么是否三药联合单抗一定会优于原有的三药方案呢?
事实上,不同的临床试验结果不尽相同。
CASSIOPEIA Study Design临床试验结果显示VTD联合地塞米松方案诱导方案完成后其MRD转阴率明显高于未联合CD38单抗组(图5)
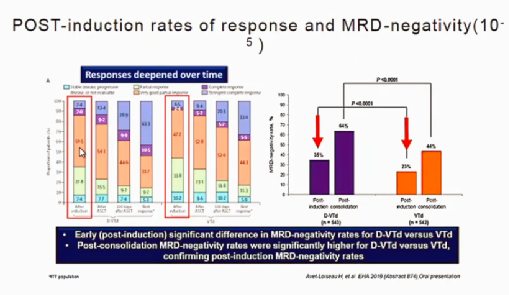
图5:CASSIOPEIA Study Design临床试验表明CD38单抗组MRD转阴率更优
GRIFFIN(NCT02874742)临床试验结果显示VRD联CD38单抗,不同阶段(诱导阶段、巩固阶段和维持阶段)的MRD转阴都是由于未联合CD38单抗(图6)

图6:GRIFFIN(NCT02874742)临床试验表明CD38单抗组MRD转阴率更优
然而并非所有的单抗都有更优的MRD转阴率,如针对CS1的单抗elotuzumab,其VGPR和CR等疗效并未优于单用三药组(图7)
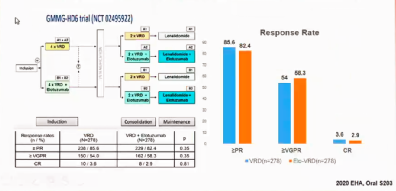
图7:Elo不改善患者缓解率
各诱导药物主要的毒副作用有周围神经炎、胃肠道反应、感染、深静脉血栓、骨髓抑制、心脏毒性、输液相关反应等(图8)

图8:各诱导药物的主要毒副作用
肝功能不全的患者慎用硼替佐米和卡非佐米,肾功能不全的患者使用伊沙佐米需减量,使用来那度胺需严格按照肌酐清除率调整剂量。
关于来那度胺对干细胞采集的影响,国际骨髓瘤工作组(IMWG)共识提到:使用来那度胺不能超过4个疗程,我们的临床实践经验认为:3个疗程已经对干细胞采集产生了有意义的影响。
■ 那么单抗是否对干细胞采集有影响呢?
以下两个临床试验(GRIFFIN:Dara+VRD, Dara+IRD)证明——单抗不影响干细胞的采集(图9)。
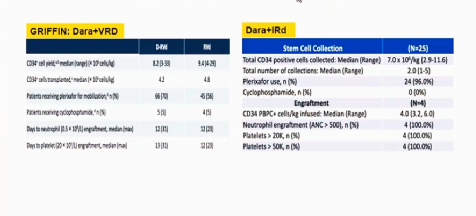
图9:单抗不影响干细胞采集及植入
不同指南推荐的移植患者的诱导方案不尽相同。美国首选VRD方案,其次是VCD方案,其他方案也可选用,梅奥高危患者推荐KRD,中低危选用VRD,欧洲最优推荐VCD。
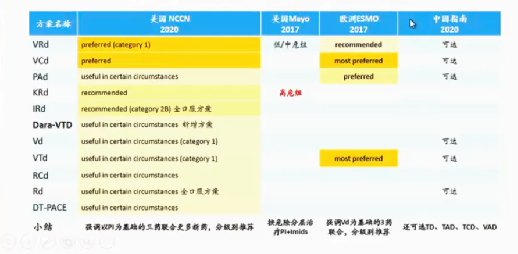
图10:各指南推荐的适合移植患者诱导方案
■ 高危患者该如何选用诱导治疗方案呢?
目前为止,二代蛋白酶体抑制剂卡非佐米可能克服高危患者的不良预后。
CD38单抗联合KRD方案,其ORR达100%,MRD转阴率60.6%(图11),因此高危患者选用KRD或KDR联合CD38单抗是比较理想的诱导方案。

图11:KRD联合CD38可明显改善患者ORR和MRD转阴率
Part3:诱导治疗终点的选择
■ 是选用固定疗程数,还是追求所有患者MRD阴性?
研究结果证实MM治疗4-6疗程后,M蛋白达到瓶颈不再有显著下降(图12),因此指南大多推荐4-6疗程后序贯自体干细胞移植(ASCT)。
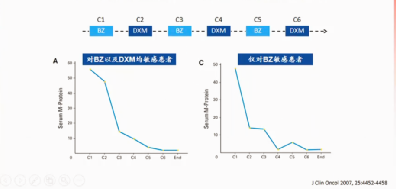
图12:4-6疗程后M蛋白不再下降
■ 那么移植前是否所有的患者都需要追求MRD转阴呢?
研究结果显示,移植前MRD转阴的患者,移植后能获得更好的PFS和OS(图13),但并不是所有的患者都能达到MRD转阴。
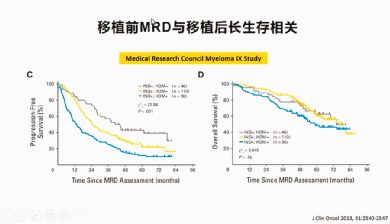
图13:移植前MRD与移植后生存相关
■ 那么哪类患者需要以追求MRD转阴为目标呢?哪些患者不需要追求MRD转阴直接序贯ASCT也能获益呢?
IFM/DFCI的联合临床试验设计了具体方案进一步求证,目前该试验正处于入组阶段,暂未有最终的结论面世。但李教授结合其自身经验表示,高危患者最好能追求移植前MRD转阴,标危患者不一定要追求MRD转阴,达到PR以上可序贯ASCT。
李教授小结:
一、二代新药的应用极大地改善了MM患者疗效及预后;
单抗的引入可进一步提高MM患者的缓解深度,可能是今后诱导治疗的一线选择;
诱导方案的选择需要根据疗效、对干细胞采集的影响、毒副作用综合考虑后选择;
含PI的方案优于不含PI的方案;
研究发现KRD的短期疗效优于VRD,但该研究随访时间短,对长期生存的影响有待进一步观察;
单抗中Dara(并非Elo)+三药的疗效优于单用三药;
对于高危患者而言,目前仍无方案可以真正克服其不良预后。