又一利妥昔单抗生物类似药上市 KRAS突变新药来了 双免疫组合在多癌种取得新突破
要点提示
NEJM: PD-L1单抗阿替利珠单抗一线治疗晚期NSCLC成功延长生存
JCO: 伊沙佐米维持治疗可延长未进行自体干细胞移植的新诊断的多发性骨髓瘤患者的PFS
JCO: 纳武利尤单抗一线治疗可显著提高BRAF野生型黑色素瘤患者的5年总生存率
JAMA Oncology:双免疫治疗晚期肝癌的OS可达近两年,疗效令人满意
Clinical Cancer Research:哌柏西利联合曲妥珠单抗后线治疗HER2阳性的晚期乳腺癌患者安全有效
新方案:纳武利尤单抗+化疗术前新辅助NSCLC可显著提高pCR,达到主要研究终点
新药:AMG510再传佳音,治疗KRAS突变NSCLC的II期研究结果积极
新药:O+Y获得FDA批准用于胸膜间皮瘤,双免疫可延长生存
新药:迪妥昔单抗和泽布替尼拟纳入NMPA优先审评
新药:两款国产PD-1单抗分别达到肝癌和鼻咽癌III期临床试验主要研究终点
利妥昔单抗生物类似药在中国获批上市
1 NEJM: PD-L1单抗阿替利珠单抗一线治疗晚期NSCLC成功延长生存
近期,NEJM在线发布IMpower110试验结果,该研究是一项随机,开放标签的临床III期研究,旨在评估阿替利珠单抗用于PD-L1高表达的转移性NSCLC患者的安全性和疗效。研究显示,与铂类化疗相比,阿替利珠单抗一线治疗可延长PD-L1高表达的转移性非小细胞肺癌(NSCLC)的总生存期(OS)。

官网截图
该研究纳入先前未接受过化疗,且在至少1%的肿瘤细胞或至少1%的肿瘤浸润免疫细胞上表达PD-L1的572例转移性非鳞状或鳞状NSCLC患者,并将患者以1:1的比例接受阿替利珠单抗治疗或化疗。
研究结果显示,在PD-L1高表达的EGFR和ALK野生型肿瘤患者中,与化疗相比,阿替利珠单抗可将患者中位OS延长7.1个月(20.2个月 vs. 13.1个月,HR=0.59)。在所有可评估安全性的患者中,阿替利珠单抗组不良事件发生率为90.2%,化疗组为94.7%;阿替利珠单抗组中3-4级不良事件发生率为30.1%,而化疗组为52.5%。阿替利珠单抗也可显著改善高肿瘤突变负荷(TMB)患者的OS和无进展生存期(PFS)。
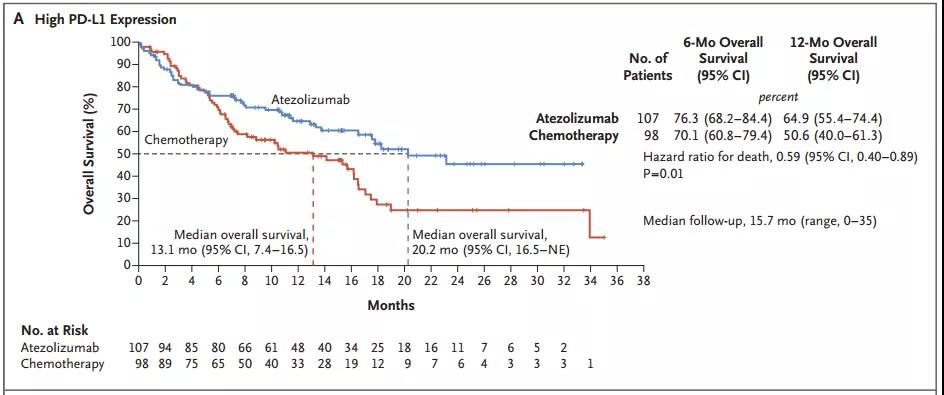
PD-L1高表达人群生存曲线
研究表明,无论患者组织学类型如何,与铂类化疗相比,阿替利珠单抗一线治疗可显著延长PD-L1高表达的转移性NSCLC患者的总生存期。
2 JCO: 伊沙佐米维持治疗可延长未进行自体干细胞移植的新诊断的多发性骨髓瘤患者的PFS
近期,JCO在线发布一项双盲,安慰剂对照的临床Ⅲ期试验(TOURMALINE-MM4)结果,该研究将未进行自体干细胞移植的新诊断的多发性骨髓瘤,且在6-12个月的标准诱导治疗后达到了优于或等于部分反应的患者以3:2的比例随机分为口服蛋白酶体抑制剂伊沙佐米组(n=425)或安慰剂组(n=281),结果显示伊沙佐米成功延长了PFS。

官网截图
结果显示,与安慰剂相比,伊沙佐米将疾病进展或死亡风险降低34.1%(17.4 vs 9.4个月,P<0.001)。标准诱导治疗后达到优于或等于部分反应的患者使用伊沙佐米获益显著(中位PFS:25.6 v 12.9 个月; HR=0.586)。伊沙佐米组中有36.6%患者出现≥3级治疗引起的不良事件(TEAEs),而安慰剂组为23.2%;伊沙佐米组中12.9%的患者由于TEAEs暂停治疗,安慰剂组为8%;伊沙佐米组和安慰剂组中常见的TEAEs包括:恶心(26.8% vs. 8.0%)、呕吐(24.2% vs. 4.3%)、腹泻(23.2% vs. 12.3%)。伊沙佐米组和安慰剂组死亡率分别为2.6%和2.2%。
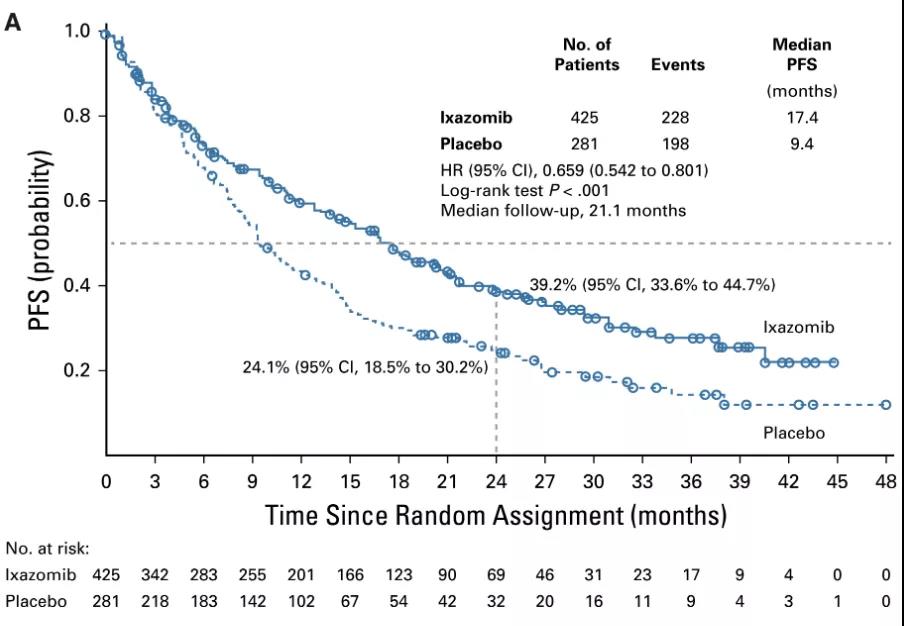
PFS结果
研究表明,伊沙佐米维持治疗可显著延长未进行自体干细胞移植的新诊断的多发性骨髓瘤患者的PFS,且没有发生意料之外的毒性。
3 JCO: 纳武利尤单抗一线治疗可显著提高BRAF野生型黑色素瘤患者的5年总生存率
近期,JCO在线发布了CheckMate 066试验的部分结果。CheckMate 066试验是一项多中心,双盲的临床III期研究,旨在研究纳武利尤单抗作为一线疗法用于先前未接受过治疗,且无法手术切除的BRAF野生型晚期黑色素瘤患者。该研究提供了5年研究结果,数据显示,纳武利尤单抗单药一线治疗可延长患者的OS。

官网截图
该研究纳入418名患者,并以1:1的比例随机分配至纳武利尤单抗组(每两周3 mg/kg)或达卡巴嗪组(每3周1000mg/m2)。研究主要终点是OS,次要终点包括PFS、客观缓解率(ORR)和安全性。
在至少60个月的随访后,结果显示,纳武利尤单抗组5年OS率为39%,达卡巴嗪为38%。纳武利尤单抗组PFS率为28%,达卡巴嗪为3%。纳武利尤单抗组ORR为42%,达卡巴嗪为14%。75名接受纳武利尤单抗治疗且存活的患者中,83%没有接受后续治疗;23%仍在接受研究治疗,60%处于治疗间歇期。安全性与3年报告相似。
研究表明,纳武利尤单抗单一疗法可显著延长患者OS率,即使治疗停止也能维持持久的反应。
4 JAMA Oncology:双免疫治疗晚期肝癌的OS可达近两年,疗效令人满意
CheckMate-040的I/II期试验的完整数据于10月1日发表于JAMA oncology上。研究结果显示:各治疗组的ORR大于30%,PD-1单抗纳武利尤单抗+CTLA-4单抗伊匹木单抗(O+Y)联合使用可提高OS,并具有可管理的安全性。
官网截图
该研究纳入148例患者,其中84%服用索拉非尼后出现疾病进展,以1:1:1的比例被随机分配到A、B、C三组中。
A组(n=50): O药1mg/kg + Y药3mg/kg;
B组(n=48): O药3mg/kg + Y药1mg/kg;
C组(n=48): O药3mg/kg + Y药1mg/kg。
研究结果显示:A组的ORR为32%,其中完全缓解(CR)率为8%;B组的ORR为27%,CR率为6%;C组的ORR为29%。A组未达到反应的中位(范围)持续时间(8.3-33.7+),B组为15.2个月,C组为21.7个月。
不同治疗组的缓解、疾病控制以及持续时间情况
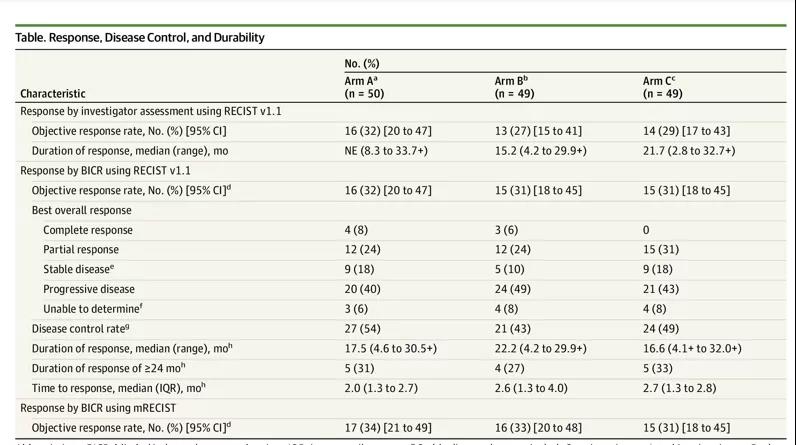
A组的中位OS为22.8个月,B组为12.5个月,C组为12.7个月。A组12个月OS率为61%,24个月OS率为48%。O+Y联合治疗安全性可控:A组有46例患者(94%)发生任何等级治疗相关的不良事件,B组有35例(71%),C组有38例(79%);并且有1例治疗相关死亡(A组;5级肺炎)。
研究者表示:对于索拉非尼经治疗的晚期HCC患者,无论HCC病因或PD-L1的表达情况如何,O+Y方案都具有高ORRs的持久反应,尤其是在A组中展现了潜在的生存获益。这种联合疗法作为HCC患者的一线治疗方法(NCT04039607)的研究正在进行中。
5 Clinical Cancer Research:哌柏西利联合曲妥珠单抗后线治疗HER2阳性的晚期乳腺癌患者安全有效
10月7日,Clinical Cancer Research在线发布了哌柏西利联合曲妥珠单抗用于有或无内分泌经治的HER2阳性的晚期乳腺癌患者的临床Ⅱ期研究(PATRICIA)结果,结果显示该方案后线保底治疗的疗效可观。

官网截图
PATRICIA是一项前瞻性,开放标签,多中心的临床试验。纳入的患者已经接受了2-4个抗HER2方案。治疗方案为哌柏西利(每日200mg,共2周),休息一周加曲妥珠单抗。该研究包括3个队列:队列A:雌激素受体阴性,队列B1:雌激素受体阳性,队列B2:雌激素受体阳性+来曲唑。主要终点是6个月PFS率,次要终点为安全性,PAM50亚型评估等。
研究共纳入71名患者,其中队列A为15名,队列B为28名。队列A,队列B1和队列B2的PFS率分别为:33.3%(5/15)、42.8%(12/28) 和46.4%(13/28)。
安全性方面:1-2级和3-4级毒性发生率分别为97.7%和84.4%。最常见的3-4级毒性为中性粒细胞减少(66.4%)和血小板减少(11.3%)。根据PAM50亚组分析显示,与非管腔型相比,PAM50定义的管腔型与PFS较长有关(中位PFS分别为10.6个月vs. 4.2个月,HR = 0.40)。
研究表明,哌柏西利联合曲妥珠单抗用于曲妥珠单抗预处理的ER-阳性/HER2阳性且PAM50为管腔A或B型晚期乳腺癌患者时,安全性良好并展现出有希望的生存结局。
6 新方案:纳武利尤单抗+化疗术前新辅助NSCLC可显著提高pCR,达到主要研究终点
10月7日,百时美施贵宝官宣,在可切除的NSCLC患者中进行的III期临床研究CheckMate-816达到病理完全缓解(pCR)的主要研究终点。研究结果显示,在术前接受欧狄沃(纳武利尤单抗)联合化疗的患者中,手术切除标本未发现癌细胞的患者人数显著多于单用化疗的患者。这意味着,纳武利尤单抗+化疗为可切除非小细胞肺癌患者带来显著优于化疗的治疗获益。

官网截图
7 新药:AMG510再传佳音,治疗KRAS突变NSCLC的II期研究结果积极
10月5日,安进公司(Amgen)公开了II期CodeBreaK 100试验的主要研究结果,其公司研发药物Sotorasib(AMG 510)治疗KRAS G12C突变的晚期非小细胞肺癌患者,展现出了持久的疗效。
该Ⅱ期研究与先前报道的Ⅰ期研究得到了一致的结果,在缓解持续时间等方面展现出了良好的潜力。截至目前为止,获得临床缓解的患者中仍有超过一半还在接受治疗。
官网截图
8 新药:O+Y获得FDA批准用于胸膜间皮瘤,双免疫可延长生存
10月2日,美国食品药品监督管理局(FDA)批准O+Y的联合疗法,一线治疗无法通过手术切除的恶性胸膜间皮瘤成人患者。这是16年来首个获批用于间皮瘤的药物疗法,也是FDA批准的第二个间皮瘤系统疗法。

官网截图
在一项随机,开放标签的临床试验中,605名先前未经治疗,肿瘤不可切除的胸膜间皮瘤患者接受这款免疫组合疗法的治疗,目的是确定与化疗相比,该组合能否改善总生存期。分析结果表明,接受组合疗法的患者中位OS为18.1个月,而接受化疗的患者中位OS为14.1个月。
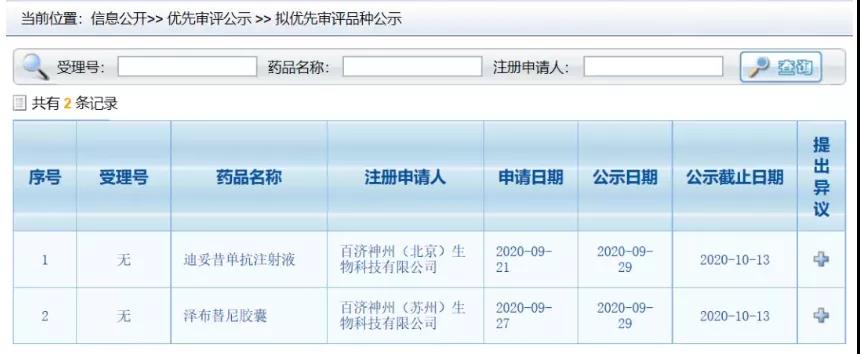
9 新药:迪妥昔单抗和泽布替尼拟纳入NMPA优先审评
9月29日,中国国家药监局(NMPA)药品审评中心(CDE)公示,迪妥昔单抗注射液(正在开发用于治疗多种神经母细胞瘤)和BTK抑制剂泽布替尼被纳入优先审评,适应证为:适用于治疗≥12月龄的高危神经母细胞瘤患者;适用于治疗成人华氏巨球蛋白血症(WM)患者。
官网截图
10 新药:两款国产PD-1单抗分别达到肝癌和鼻咽癌III期临床试验主要研究终点
9 月 28 日,信达生物发布公告,信迪利单抗注射液联合贝伐珠单抗生物类似药用于晚期肝癌一线治疗的 III 期临床研究(ORIENT-32) 在期中分析达到PFS及OS的主要研究终点。
9月28日,君实生物宣布,、特瑞普利单抗、联合化疗治疗复发性或转移性鼻咽癌的随机、双盲、安慰剂对照、国际多中心3期临床研究(JUPITER-02研究)在期中分析中,由孤立数据监察委员会(IDMC)判定达到了预设的主要研究终点。
以上两项III期研究的成功意味着国产PD-1单抗取得新进展,为国内肝癌和鼻咽癌患者带来喜讯。
11 新药:利妥昔单抗生物类似药在中国获批上市
10月9日,信达生物和礼来共同宣布,重组人-鼠嵌合抗CD20单克隆抗体注射液(利妥昔单抗注射液)正式获得国家药品监督管理局(NMPA)的上市批准,用于治疗弥漫性大B细胞淋巴瘤,滤泡性淋巴瘤,及慢性淋巴细胞性白血病。
利妥昔单抗的多个大型确证性临床试验数据充分地证实了其在CD20阳性的非霍奇金淋巴瘤的临床疗效和安全性,已成为CD20阳性的非霍奇金淋巴瘤的标准治疗。原研药利妥昔单抗注射液自上市以来,全球已批准其用于治疗包括非霍奇金淋巴瘤(NHL)、慢性淋巴细胞性白血病(CLL)、类风湿性关节炎(RA)、血管炎肉芽肿(GPA)、显微镜下多血管炎(MPA)、中重度成人天疱疮(PV)等多个适应证,其显著的疗效和良好的安全性已得到普遍认可,期待其生物类似药的上市能给中国患者带来更多的新治疗选择。
参考文献
[1]Roy S. Herbst,Giuseppe Giaccone,Filippo de Marinis,et al. Atezolizumab for First-Line Treatment of PD-L1–Selected Patients with NSCLC. N Engl J Med 2020; 383:1328-1339
[2]Meletios A. Dimopoulos,Ivan Špička,Hang Quach,et al. Ixazomib as Postinduction Maintenance for Patients With Newly Diagnosed Multiple Myeloma Not Undergoing Autologous Stem Cell Transplantation: The Phase III TOURMALINE-MM4 Trial. Journal of Clinical Oncology. 2020
[3]Caroline Robert,Georgina V. Long,Benjamin Brady,et al. Five-Year Outcomes With Nivolumab in Patients With Wild-Type BRAF Advanced Melanoma. Journal of Clinical Oncology. 2020
[4]Yau T, Kang Y, Kim T, et al. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial. JAMA Oncol. Published online October 01, 2020. doi:10.1001/jamaoncol.2020.4564
[5]Eva Ciruelos, Patricia Villagrasa, Tomás Pascual, et al. Palbociclib and Trastuzumab in HER2-Positive Advanced Breast Cancer: Results from the Phase II SOLTI-1303 PATRICIA Trial. Clinical Cancer Research. 2020
[6]https://news.bms.com/news/corporate-financial/2020/Opdivo-nivolumab-Plus-Chemotherapy-Shows-Statistically-Significant-Improvement-in-Pathologic-Complete-Response-as-Neoadjuvant-Treatment-of-Resectable-Non-Small-Cell-Lung-Cancer-in-Phase-3-CheckMate--816-Trial/default.aspx
[7]https://www.amgen.com/media/news-releases/2020/10/amgen-announces-positive-topline-phase-2-results-for-investigational-kras-g12c-inhibitor-sotorasib-in-advanced-non-small-cell-lung-cancer/
[8]https://news.bms.com/news/details/2020/U.S.-Food-and-Drug-Administration-Approves-Opdivo-nivolumab--Yervoy-ipilimumab-as-the-First-and-Only-Immunotherapy-Treatment-for-Previously-Untreated-Unresectable-Malignant-Pleural-Mesothelioma/default.aspx
[9]http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#
[10]https://mp.weixin.qq.com/s/hGkhJPT00k3fne5tGbjOjA
[11]https://mp.weixin.qq.com/s/W4itTrWYNBOHY58Xwus4hQ
[12]https://mp.weixin.qq.com/s/EreuyQDGJhdjvV3qMTTncw
本文首发:医学界肿瘤频道
本文作者:肿瘤情报组
责任编辑:Sharon