周彩存教授 7个免疫制剂新面孔
近年来,免疫治疗的发展方兴未艾,在肿瘤综合治疗中的重要地位愈加凸显,PD-1/PD-L1 通路的研究通道已经非常拥挤,然而临床上仅有部分患者能从免疫治疗中长期获益,需要有更多的新的联合不同作用机制的免疫治疗,以带来更多有效的治疗选择。2020 年 CSCO 学术年会肺癌专场上,来自上海市肺科医院的周彩存教授为我们解读了新型免疫制剂研发的现状、机遇与挑战。

抗肿瘤免疫涉及到多细胞、多步骤、多分子的参与,PD-1/PD-L1最具代表性的免疫检查点抑制剂,但是只有25%-30%的肿瘤是采用PD-1/PD-L1通路来实现免疫逃逸的。随着对免疫检查点研究的深入,我们也发现LAG-3,TIM-3 及 TIGIT这几个免疫检查点产生的免疫效应,均会影响 CD8+细胞及 NK 细胞功能,可以联合阻断不同免疫检查点受体以达到明显的免疫反应效应。
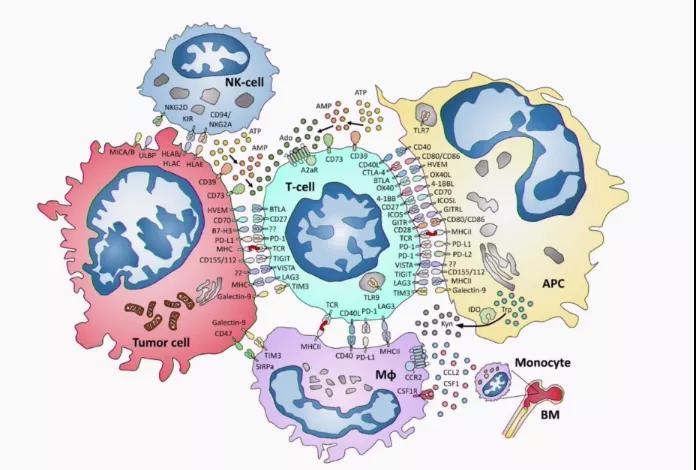
1 TIGIT 通路
TIGIT 是一种新型抑制性受体,表达于多种免疫细胞,包括 T 细胞和 NK 细胞。TIGIT 通过与肿瘤细胞和抗原提呈细胞(APC)上的PVR配体结合,起到抑制T细胞和NK细胞的作用。TIGIT表达与 PD-1 表达密切相关,尤其是肺癌的肿瘤浸润 T 细胞。
Tiragolumab 就是一种全人源化的 TIGIT 单克隆抗体,具有完整的 Fc 段,可阻断 TIGIT 与其受体结合。临床前模型显示, 抗TIGIT和抗PD-L1抗体联合治疗对肿瘤起到协同抑制作用,并延长了小鼠的生存期。Ⅱ期CITYSCAPE研究比较了TIGIT单抗tiragolumab联合阿替利珠单抗和阿替利珠单抗单药一线治疗PD-L1阳性、局部晚期不可切除或转移性NSCLC的疗效和安全性。结果显示,与阿替利珠单抗相比,Tiragolumab+阿替利珠单抗能显著提高意向治疗人群中人群的ORR和PFS,在PD-L1高表达(TPS≥50%)的人群中联合治疗组获益进一步改善。
在联合治疗中,抗TIGIT药物更多是起到锦上添花的作用,阻断治疗过程中出现的伴随表达,保证PD-1/L1的最大疗效,更多的答案还需要不断探索。
2 LAG-3 通路
LAG-3是一种免疫检查点受体蛋白,表达于活化的T细胞、NK细胞、B细胞和浆细胞样树突状细胞上。FGL-1 蛋白可与 LAG-3 紧密结合,肿瘤通过 FGL-1 蛋白激活 T 细胞 LAG-3 受体,从而实现免疫逃逸。研究表明,同健康人相比,血清中 FGL-1 水平越高,免疫治疗效果越差,FGL-1 蛋白水平或许可以作为预测 PD-1 抑制剂疗效的生物标志物。未来,阻断 FGL1-LAG3 相互作用可能增强抗肿瘤免疫活性,为肿瘤治疗提供新的思路。
Relatlimab是目前研发进度最快的LAG-3抗体,已经启动全球范围的II/III期临床试验。55名PD-1/PD-L1抗体治疗耐药或者失败的恶性黑色素瘤患者,使用relatlimab 80mg+纳武利尤单抗240mg,两周一次静脉注射。在48名疗效可评估的患者中,6位患者肿瘤明显缩小,有效率为12.5%;对于LAG-3表达量大于1%的25位患者来说,有效率20%;对于LAG-3表达量小于1%的患者,有效率只有7.1%。
3 TIM-3 通路
TIM-3是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞衰竭,在肿瘤细胞杀伤过程中起到重要作用。TIM-3在T细胞,NK细胞,NKT细胞和树突状细胞上表达。仅在 CD4+辅助 T 细胞 1(Th1)和 CD8+细胞毒性 T 细胞中上调,参与协同抑制作用,抑制效应 T 细胞的活性,并引起外周耐受。并且,TIM-3 在用抗 PD-1 治疗产生耐药性的动物的 T 细胞中高表达。
TSR-022是首个公布试验数据的抗TIM3药物,在202例PD-1/PD-L1抗体难治的非小细胞肺癌患者中,TSR-022联合固定剂量的抗PD-1抗体TSR-042,随着TSR-022的剂量增加其显示出的临床活性也在增加(体现在SD或PR患者的比例上)。最重要的是,这种组合疗法的耐受性也较好,未观察到剂量限制毒性。
在抗 TIM-3 抗体 LY3321367 单药或联合抗 PD-L1 抗体 LY3300054 的 IA/IB 研究中,单药或联合耐受性良好,其中一例广泛期PD-L1阴性小细胞肺癌患者,经顺铂/依托泊苷、PD-1/CTLA-4 单抗治疗进展,使用抗 TIM-3(LY3321367 )单药治疗后达到部分缓解,初步观察到抗肿瘤活性,仍需要 II、III 期研究验证。
4 腺苷
腺苷是一种免疫抑制代谢物,可通过与免疫细胞上表达的G蛋白偶联腺苷受体A2a(A2aR)结合,抑制免疫细胞的免疫响应能力,在肿瘤微环境中这一抑制过程的结果就表现为肿瘤细胞的免疫逃逸,使肿瘤细胞无法被免疫细胞杀伤。腺苷介导了多个靶点的免疫耐药,研究人员基于此开发出了A2aR拮抗剂、CD39抑制剂、CD73抑制剂。目前,许多靶向腺苷抑制途径的临床试验正在进行当中。
5 双特异性抗体
双特异性抗体是最重要的一类双靶点药物,也是近些年来最热门的药物研发领域之一。
M7824 是一种创新的双功能融合蛋白,可同时靶向 PD-L1 通路和 TGF-&β; 通路,也是全球范围内第一个进入临床研究的此类药物。在 M7824 二线治疗非小细胞肺癌的 I 期开放研究中,经过 2 年时间的随访,患者的中位持续缓解时间达 18 个月,63.6% 的患者持续缓解时间 ≥ 12 个月。M7824 1200 mg Q2W二线治疗非小细胞肺癌表现出持续缓解和长期生存,尤其是PD-L1高表达的患者(PD-L1阳性患者的中位总生存期为 21.7 个月,PD-L1 高表达患者的中位总生存期尚未达到)。
KN046 是全球首个PD-L1-CTLA-4双特异性治疗药物。KN046联合含铂化疗对比安慰剂联合含铂化疗在IV期鳞状非小细胞肺癌患者中的疗效与安全性的多中心Ⅲ期临床研究已经启动,约60个研究中心开展,计划招募约500名志愿者以评估KN046-5mg剂量下联合化疗的安全性和有效性,主要终点为IRC根据RECIST 1.1标准判断的无进展生存期。
6 TIL 治疗
肿瘤浸润性淋巴细胞(TIL),是来自患者自身的免疫细胞,他们可以穿透癌组织内部,识别并杀死癌细胞。然而,由于各种原因,癌组织的免疫抑制环境会限制TIL细胞的数量和活性,降低它们对癌细胞的杀伤力。
TIL疗法,简单来说,就是从患者的肿瘤样本中分离出TIL细胞,然后在体外使用IL-2细胞因子刺激细胞扩增,筛选,最后回输患者体内的疗法。TIL疗法不但增加了TIL细胞的数量,还激活了TIL细胞的抗肿瘤能力,能更有效地杀伤肿瘤细胞。
在2020年AACR会议上,TIL疗法治疗PD-1耐药性NSCLC患者的1期研究发布了积极的结果。在12名可评估的NSCLC患者中,TIL疗法可达到25%的最佳总体缓解率(BORR)。,回输 TIL 之前,接受PD-1单抗治疗的 20 例患者中仅 3 例肿瘤明显缩小;回输 TIL 后,大部分患者肿瘤明显缩小,其中 4 例患者持续 12 个月以上,1 例患者持续缓解 24 个月。
7 肿瘤疫苗
治疗性肿瘤疫苗因其促使T细胞高特异性的针对肿瘤攻击,成为实体瘤治疗的重要突破口。HS-110 是一种同种异体肿瘤细胞疫苗,同种异体疫苗指疫苗携带的抗原不是来自于患者自身,而是来自实验室培养的肿瘤细胞系,这些细胞系的细胞具有特定癌种肿瘤细胞的典型特征,HS-110就带有典型的腺癌细胞高表达的抗原。
DURGA(HS-110-102)是一项 2 期多队列研究,旨在评估 HS-110 联合纳武利尤单抗在晚期NSCLC患者中的疗效和安全性。2020ASCO会议公布了A队列(经治且既往未接受过PD-1/PD-1抑制剂治疗)研究数据,初步结果证实HS-110 联合纳武利尤单抗耐受性好,ITT人群中位OS可达了 28.7 个月。研究还发现,有输注反应的患者OS显著更好。并且,无论是 PD-L1 阳性还是 PD-L1 阴性组,患者OS均有获益。