多腺苷二磷酸核糖聚合酶抑制剂联合抗血管生成药物治疗卵巢癌的不良事件及处理
本文刊登于《中国实用妇科与产科杂志》2020,36(9):900-904
DOI:10.19538/j.fk2020090125
【引用本文】刘昀昀,林仲秋.多腺苷二磷酸核糖聚合酶抑制剂联合抗血管生成药物治疗卵巢癌的不良事件及处理[J].中国实用妇科与产科杂志,2020,36(9):900-904.
作者:刘昀昀 综述,林仲秋 审校
基金项目:国家自然科学基金面上项目(81972433);国家自然科学基金青年项目(81602290)
作者单位:中山大学孙逸仙纪念医院妇科肿瘤专科,广东 广州 510000
通讯作者:林仲秋,电子信箱:[email protected]
卵巢癌是病死率最高的妇科恶性肿瘤,70%的卵巢癌患者就诊时已达晚期。卵巢癌治疗模式为肿瘤细胞减灭术联合以铂类为基础的化疗。虽然大多数患者经过初始治疗可获得临床缓解,但仍有70%的患者在3年内复发,5年生存率不足50%。近年来,多腺苷二磷酸核糖聚合酶抑制剂(PARPi)的问世为卵巢癌的治疗带来了重大变革。目前,全球上市了3种PARPi,即奥拉帕利、尼拉帕利和卢卡帕利,它们被批准用于初治晚期或复发性卵巢上皮性癌、输卵管癌或原发性腹膜癌患者。奥拉帕利是第一种在欧美上市、第一个在我国上市的PARPi,其累积病例数最多、安全性数据最完全、3级以上血液学不良事件的发生率最低。
几项大型Ⅲ期随机对照临床研究(NOVA,Study 19,SOLO2,ARIEL3,SOLO1等)已经证实,奥拉帕利、尼拉帕利和卢卡帕利用于初治晚期或铂敏感复发卵巢癌患者的维持治疗,能显著延长无进展生存期(PFS),延缓复发。在2020美国临床肿瘤学会(ASCO)会议上,SOLO2公布了奥拉帕利用于铂敏感复发卵巢癌患者的维持治疗有总生存获益。如何进一步提高PARPi的疗效并扩大PARPi获益人群是目前的研究热点。研究者正在探索不同的联合方案,如联合抗血管生成药物、免疫检查点抑制剂和DNA损伤修复通路抑制剂等研究均在进行中。在铂敏感复发卵巢癌的两项Ⅱ期研究和初治晚期卵巢癌的一项Ⅲ期研究中已证实,与抗血管生成剂联合使用时,PARPi能够进一步提高非BRCA突变人群的疗效。奥拉帕利联合西地尼布治疗铂敏感复发卵巢癌患者的Ⅱ期研究表明,与奥拉帕利单药相比,联合治疗显著延长PFS(16.5 vs. 8.2个月,P=0.006),其亚组分析提示获益主要来自于非BRCA突变组。AVANOVA2研究显示,与尼拉帕利单药对比,尼拉帕利+贝伐珠单抗联合治疗铂敏感复发卵巢癌患者,可显著延长总人群PFS(11.9 vs. 5.5个月,P<0.001),尤其是非BRCA突变组。PAOLA-1研究证实了奥拉帕利与贝伐珠单抗联合维持治疗用于接受一线含铂化疗后完全缓解或部分缓解的同源重组缺陷(HRD)阳性晚期卵巢癌患者,可以使治疗组患者PFS达到37.2个月,将卵巢癌一线维持治疗优势获益人群从20%提高到50%。然而,在疗效提高、获益人群扩大同时,联合用药是否会带来更多毒性的发生?患者能否耐受?这些问题是临床上关注的热点。本文主要根据目前已发表的PAOLA-1、AVANOVA2、奥拉帕利联合西地尼布Ⅱ期研究来分析和总结PARPi联合抗血管生成药物的常见毒性及处理措施,以期为卵巢癌患者临床用药提供参考。
1 作用机制
1.1 PARPi的机制 BRCA1/2基因是抑癌基因,在DNA损伤修复、细胞正常生长等方面均具有重要作用。该基因突变可抑制DNA损伤后正常修复能力,引起同源重组修复缺陷(HRD),使双链断裂的DNA修复不能通过同源重组修复(HRR),最终导致癌变。正常细胞出现DNA损伤-单链断裂时,可依赖PARP蛋白通过碱基切除修复(BER)途径进行细胞修复。当PARPi作用于正常细胞时,PARP蛋白无法发挥作用,抑制BER导致复制叉缩短,进而形成双链断裂。此时,BRCA1/2可通过启动HRR进行细胞修复。如果细胞存在HRD,二者的“合成致死”效应最终导致细胞死亡。
1.2 抗血管生成药物的机制 血管内皮生长因子(VEGF)通过与血管内皮细胞生长因子受体(VEGFR)结合,激活一系列信号传导通路,调控肿瘤营养血管内皮细胞活化、增殖、迁移,促进肿瘤生长、侵袭和转移。基于阻断肿瘤血管生成机制研发出的靶向VEGF、VEGFR和其他相关分子的药物,统称为抗血管生成药物。根据抑制血管生成的靶点和作用机制,分为血管内皮生长因子抑制剂(如贝伐珠单抗)、酪氨酸激酶抑制剂(如索拉非尼、阿帕替尼、西地尼布、尼达尼布等)、血管生成素抑制剂(如曲巴那尼)和整合素抑制剂(如&α;4&β;1整合素抑制剂)等。VEGFR在大多数妇科恶性肿瘤组织中表达,VEGF抑制剂(如贝伐珠单抗)通过结合VEGFR阻止其与内皮细胞表面受体结合,抑制肿瘤新生血管的形成;此外,还可使肿瘤组织血管结构正常化,使化疗药物能够有效到达肿瘤组织,发挥协同作用。
1.3 PARPi 联合抗血管生成药物的机制 抗血管生成药物可通过抑制肿瘤血管生成造成肿瘤细胞乏氧状态,导致肿瘤细胞DNA损伤,其中最具细胞毒性的损伤就是DNA双链断裂(DSB),此时DNA复制压力增加,DNA的复制压力通过多种途径下调同源重组修复相关蛋白的表达,如RAD51和BRCA1/2,从而相当于在HRR正常肿瘤中诱导HRD表型。其次,已有证据表明PARPi可减少血管生成。因此,与抗血管生成药物联用,可能会增加肿瘤对PARPi的敏感性。
2 PARPi联合抗血管生成药物的毒性
PARPi联合抗血管生成药物研究中,不同PARPi联合治疗的不良事件(AE)的发生率和严重程度均有所不同。PAOLA-1研究中,奥拉帕利联合贝伐珠单抗和贝伐珠单抗单药治疗的≥3级AE发生率分别是57%和51%。AVANOVA2研究中,尼拉帕利联合贝伐珠单抗和尼拉帕利单药治疗的≥3级AE发生率分别为65%和45%。与单药相比,联合治疗观察到更多的≥3级AE。奥拉帕利联合西地尼布Ⅱ期研究中,联合组和单药组的≥3级AE发生率分别为70%和50%。不同研究因为AE导致的药物剂量减少、停药和停止治疗的比例也不同,分别为AVANOVA2(52%、54%和69%)、PAOLA-1(41%、54%和20%)和奥拉帕利联合西地尼布Ⅱ期(77%和6.8%)(见表1)。

PARPi联合抗血管生成药物常见AE主要发生在血液系统、胃肠道系统及心血管系统,以轻中度为主,见表2。PAOLA-1研究中,与贝伐珠单抗相比,奥拉帕利联合贝伐珠单抗常见AE主要是疲劳、恶心和贫血,≥3级AE主要是高血压(19% vs. 30%)和贫血(17% vs. <1%)。AVANOVA2研究中,联合和尼拉帕利单药组常见AE是贫血、疲劳、胃肠道不良事件和高血压,其中≥3级AE主要是高血压(21% vs. 0)、贫血(15% vs. 18%)和血小板减少(10% vs. 12%)。奥拉帕利联合西地尼布Ⅱ期试验研究中,联合和单药组3~4级AE主要是高血压(41% vs. 0)、疲劳(27% vs. 11%)和腹泻(25% vs. 0),两组均未报告有≥3级血液系统AE。
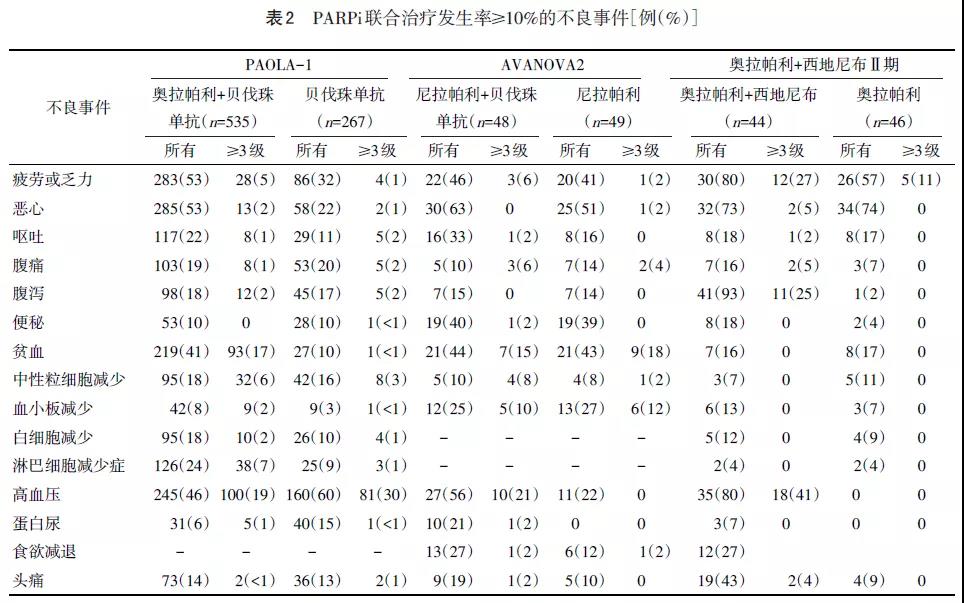
在PARPi联合用药过程中,大部分患者会出现不同程度的AE,血液学和胃肠道不良事件最常见,以轻中度为主,其中血液学毒性的发生主要与PARPi相关,高血压、蛋白尿主要与抗血管生成药物相关,大部分不良事件通过用药中断、对症治疗、减量等方法可控制。总体处理原则是:如果因与PARPi有关的毒性而暂时中断PARPi,抗血管生成药物将继续使用,除非PARPi毒性影响抗血管生成药物使用或增加其毒性发生风险;如果因与抗血管生成药物有关的毒性而暂时中断治疗,PARPi将继续使用,除非抗血管生成药物的毒性影响PARPi使用或增加其毒性发生风险。在这种情况下,两种治疗都将中断,直到毒性消失或恢复到美国国立癌症研究所-常见不良反应事件评价标准(NCI-CTCAE)1级。
2.1 疲劳或乏力 疲劳或乏力是PARPi联合抗血管生成药物常见AE,发生率为46%~80%,以轻中度为主,其中奥拉帕利/尼拉帕利联合贝伐珠单抗≥3级AE发生率仅约5%。奥拉帕利联合西地尼布治疗≥3级AE发生率为27%,提示不同抗血管生成药物AE发生率可能不同。
预防和管理:(1)给患者合理的预期,告知可能发生的疲劳症状(2)对症治疗,必要的镇痛、抗抑郁治疗,可给予精神兴奋剂(如哌甲酯)(3)非药物干预,认知行为疗法和营养咨询(4)如果疲劳仍然持续,出现CTCAE 2级以上AE,且处理后无法缓解,或出现3级以上AE,应暂停用药,待症状改善后原剂量或减量(特别是第2次暂停用药后)继续用药。对于剂量已减至最低、疲劳症状仍难以控制的患者要考虑停止用药。
2.2 胃肠道AE(恶心、呕吐、腹泻、腹痛、便秘等) PARPi联合抗血管生成药物较常见胃肠道系统AE主要是恶心(53%~73%)、呕吐(20%~33%)、腹痛(10%~21%)、便秘(10%~40%),以1~2级AE多见,仅2%~6%的患者发生3~4级AE。横向比较奥拉帕利单药和尼拉帕利单药的数据(图1a),便秘似乎更多见于尼拉帕利,恶心更常见于奥拉帕利,这一结论在横向比较奥拉帕利+贝伐珠单抗与尼拉帕利+贝伐珠单抗的数据(图1b)较为一致,这说明不同的PARPi发生AE的特点不尽相同。
另外,奥拉帕利联合西地尼布的Ⅱ期临床试验中,联合使用西地尼布似乎不增加使用奥拉帕利患者的恶心比例(所有级别AE:73% vs. 74%,3~4级AE:5% vs. 4%),而详观PAOLA-1的数据,贝伐珠单抗本身导致恶心的发生率较高(22%),联合使用贝伐珠单抗和奥拉帕利时,恶心的程度或比例可能会进一步增加。对比奥拉帕利+贝伐珠单抗,腹泻的发生明显在奥拉帕利联合西地尼布时增加(图1c),这也值得注意。

预防和管理:(1)告知患者发生恶心等胃肠道症状的可能性较大,给患者合理的预期(2)对症治疗,可以参照细胞毒药物化疗引起胃肠道AE的管理,可使用胃肠动力药、5-羟色胺受体拮抗剂等止吐药物,必要时在睡前30~60min服用止吐药物,PARPi在睡前服用有助于减少恶心的发生(3)CTCAE 2级以上AE经治疗后未能缓解,或出现3级以上AE,需暂停用药,直至AE降至1级或缓解。
2.3 血液系统AE
2.3.1 贫血 贫血是PARPi联合抗血管生成药物较常见的血液系统AE,总体发生率为16%~44%,以轻中度为主,3~4级发生率约15%。由图1可见:贫血较常见于尼拉帕利治疗中(发生率为43%),且其3~4级AE几乎占据总贫血发生率的一半,相比之下奥拉帕利单药治疗的贫血发生率约17%,但一旦开始联合使用贝伐珠单抗,两药之间的贫血发生差异消失(图1b),推测可能贝伐珠单抗会显著增加奥拉帕利使用过程中贫血的发生,然而奥拉帕利联合西地尼布并不显著增加贫血发生率,这提示不同的抗血管生成药物在联合靶向治疗时导致AE的偏好性有很大差别。因抗血管生成药物导致出血风险较高,所以,当联合用药者出现贫血时,应首先寻找出血原因,排除活动性出血(神经、呼吸、消化、泌尿等系统出血)后,方考虑为骨髓抑制等原因导致的贫血。
处理方法:如发现出血事件,1级出血时无需停药;2级出血时,暂停抗血管生成药物治疗;≥3级出血事件一旦发生,则永久停用贝伐珠单抗。当排除活动性出血后,血红蛋白降至80~100g/L时,首次出现者可在监测血常规的情况下继续使用靶向治疗,必要时对症治疗;再次出现时则需暂停使用PARPi和抗血管生成药物,必要时输注红细胞,待血红蛋白恢复至90g/L水平以上后减量恢复PARPi使用,并根据临床指征酌情恢复抗血管生成药物;如中断4周患者仍不能恢复至轻度贫血,则行血液遗传学分析;对于血红蛋白<80g/L且合并血小板减少和(或)中性粒细胞减少者,处理方案同再次出现血红蛋白降至80~100g/L者;当患者血红蛋白<80g/L但不合并其他两系细胞减少时,暂停使用PARPi,必要时采用红细胞输注治疗,待血红蛋白水平恢复至>90g/L后减量恢复PARPi使用;如果中断4周患者仍不能恢复至轻度贫血,进行血液遗传学分析。
2.3.2 血小板减少 血小板减少的总体发生率为8%~25%,3~4级血小板减少的发生率为2%~10%。其中尼拉帕利联合贝伐珠单抗3~4级血小板减少的发生率为10%,略高于奥拉帕利联合西地尼布(0)和奥拉帕利联合贝伐珠单抗(2%),见图1b、c。
处理方法:血小板计数<100×109/L者,暂停使用PARPi,待血小板计数恢复至100×109/L以上,根据血小板计数的最低值决定恢复使用PARPi剂量:如血小板计数最低值为(75~100)×109/L,可原剂量恢复PARPi使用;如血小板计数最低<75×109/L,或2次以上发生血小板计数<100×109/L,减量恢复PARPi使用,每周监测血小板计数至平稳,必要时给予促血小板生成素等治疗;如果停药28d内血小板计数仍未能恢复至可用药水平,或减至用药最低剂量仍再次发生血小板减少,应停止用药。如果发生4级血小板减少(无论与治疗的关系如何),应同时暂时停用抗血管生成药物。
2.3.3 中性粒细胞减少 PARPi联合抗血管生成药物中性粒细胞减少的总体发生率为9%~18%,其中3~4级发生率为6%~8%。奥拉帕利联合西地尼布治疗时,无≥3级的AE,而联合使用贝伐珠单抗时,中性粒细胞减少的发生率增加(图1c),且后者出现约6%的3~4级AE,推测含有贝伐珠单抗的联合用药方案更容易导致中性粒细胞减少。
处理方法:当中性粒细胞计数降至(1.5~2.0)×109/L,在监测血常规的情况下可继续使用PARPi;若中性粒细胞计数<1.5×109/L,应暂停使用PARPi,必要时使用粒细胞刺激因子等药物治疗,待中性粒细胞计数恢复至1.5×109/L以上,减量恢复PARPi使用,恢复用药后每周监测中性粒细胞水平至平稳;如果停药28d内中性粒细胞计数仍未恢复至可用药水平,或减至用药最低剂量仍再次发生中性粒细胞计数降低至1.5×109/L以下,应停止用药。如果发生4级中性粒细胞减少(无论与治疗的关系如何),应同时暂时停用抗血管生成药物。
2.3.4 心血管系统AE 高血压和蛋白尿主要由抗血管生成药物引起。奥拉帕利联合贝伐珠单抗高血压和蛋白尿总体发生率为46%和6%,≥3级比例为19%和1%,低于贝伐珠单抗单药总体发生率(高血压60%和蛋白尿15%)。尼拉帕利联合贝伐珠单抗高血压和蛋白尿总体发生率分别为56%和21%,略高于奥拉帕利联合贝伐珠单抗。奥拉帕利联合西地尼布治疗时高血压和头痛发生的比例增加,3~4级AE的占比也稍高于奥拉帕利联合贝伐珠单抗(图1c)。
处理方法:使用抗血管生成药物如贝伐珠单抗治疗时,需动态监测患者血压;如发生高血压,或患者血压较基线明显升高,推荐开始使用降压药物,以达到良好的血压控制,推荐低危患者的血压控制目标为140/90mmHg(1mmHg=0.133kPa),高危患者为130/80mmHg。如出现中度以上的高血压(高于160/100mmHg),且降压药物暂不能控制血压,则应暂停抗血管生成药物,直至血压恢复至可控状态。在每次开始抗血管生成药物治疗前都应进行尿蛋白的检测。如果出现24h尿蛋白水平>2g,应暂停抗血管生成药物治疗,并密切观察,直至24h尿蛋白水平<2g。肾病综合征(24h尿蛋白水平>3.5g)患者应停用抗血管生成药物。推荐使用血管紧张素转换酶抑制剂(ACEI)和血管紧张素Ⅱ受体拮抗剂(ARB)类降压药物,可降低蛋白尿的严重程度和终末期肾病发生风险。如果出现4级高血压(高血压危象)或4级蛋白尿(肾病综合征),应永久终止抗血管生成药物的治疗。
2.4 少见但需关注的AE 包括出血、血栓形成/栓塞、充血性心力衰竭、伤口愈合并发症、肠穿孔,属于主要是由抗血管生成药物引起的少见但需关注的AE。PARPi联合抗血管生成药物发生出血的总体发生率约为1.0%,栓塞/肺栓塞/静脉血栓形成的发生率约为4%,慢性心力衰竭发生率约<1%,肠穿孔的发生率约<1%。虽然以上AE发生率极低,但认识和了解其处理措施仍很重要,有利于充分监测患者病情变化,方便对患者进行长期监测。
处理方法:在开始治疗前评价潜在风险因素,识别出血高风险人群。如存在活动性胃溃疡会增加胃肠道出血风险;近期瘤块中有出血征象的患者使用抗血管生成药物应持审慎态度;3个月内发生过肺出血/咯血的患者不应使用抗血管生成药物;监测患者中枢神经系统出血相关症状和体征,一旦出现颅内出血应中断抗血管生成药物。治疗过程中发生1级出血事件,不需停药;发生2级出血事件,应暂停治疗;发生≥3级出血事件,应永久停用抗血管生成药物。
使用抗血管生成药物治疗中出现静脉血栓栓塞症(VTE)事件的患者,应停止治疗,并推荐使用低分子量肝素(LMWH)进行抗凝治疗;对于出现≤3级VTE的患者,在开始LMWH治疗后可恢复抗血管生成药物治疗;对于出现≥4级VTE或抗凝治疗后复发性或难治性血栓栓塞的患者,应停用抗血管生成药物。
穿孔和吻合口瘘一般比较严重,一旦发生应停药,并针对并发症进行治疗。使用抗血管生成药物治疗的患者应监测心电图、心脏功能变化。有心血管疾病的患者要慎用。对Ⅲ~Ⅳ级充血性心力衰竭患者,应停止使用抗血管生成药物,并进行相应的抗心力衰竭治疗。
3 结语
PARPi维持治疗用药时间较长,在延缓复发的同时,药物安全性显得尤为重要。随着PARPi联合抗血管生成药物数据的不断公布,在提高疗效、扩大获益人群的同时,安全性也得到关注。PARPi联合抗血管生成药物与PARPi单药类似,AE以轻度或中度为主,且大部分AE可通过中断、对症治疗、减量等方法得到控制(参考文献略)