哪些评分可以预测卵巢癌是否能行满意的肿瘤减灭术?
晚期卵巢癌的标准化治疗包括手术及以铂类为主的辅助化学治疗。对于部分晚期卵巢癌患者,初始手术治疗有时难以彻底切除肿瘤,实现满意的肿瘤减灭术。对于卵巢癌术前评估,目前临床上广泛应用的主要有两种:Suidan’sCT评分标准及Fagotti的腹腔镜评分标准。另附PCI评分、R0评分系统及并发症评分。
Suidan CT评分
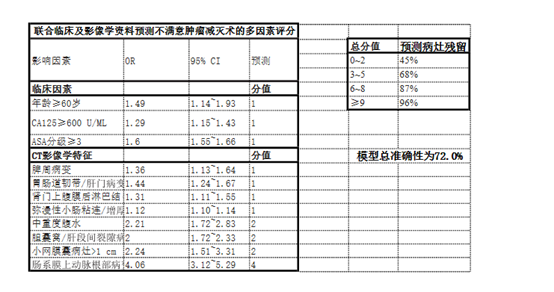
Suidan等的回顾性非随机多中心研究建立了预测III,IV期卵巢癌患者不满意肿瘤减灭术的多因素评分模型。他们认为评分值≥3分者应行NACT。后来,Suidan研究组进行前瞻性非随机多中心研究, 进一步完善了多因素评分模型,包括3项临床特征及8项影像学特征(表2),得分为0~2,3~5,6~8,≥9分组预测病灶残留的准确性分别为45%,68%,87%, 96%,模型总准确性为72.0%。
Fagotti腹腔镜评分
1998年首先由Vergote等报道了腹腔镜探查术在晚期卵巢癌术前评估方面的作用。Fagotti等基于腹腔镜技术建立了预测满意肿瘤减灭术的Fagotti评分模型,模型参数包括腹膜转移、横膈转移、肠系膜转移、网膜转移、肠浸润、胃浸润、肝浸润等, 每项参数记2分,所有分数相加获得的总分数为腹腔镜预测分数(laparoscopic predictive score,PIV)。该模型准确性为77.3%~100%。当PIV≥8分时不满意PDS可能性为100%,即PIV≥8分的患者PDS达到满意的概率为0,从而可以避免初诊时不必要的剖腹探查。

PCI评分
PCI 评分即腹膜癌指数,曾用于描述盆腔恶性肿瘤的腹膜扩散情况,但其也应用于卵巢癌的肿瘤扩散程度的评估。PCI为肿瘤的负荷提供有价值的信息,并且详细描述了肿瘤的腹膜散布情况。其主要是对腹部进行分区:0-中央区、1-右上区、2-上腹部、 3-左上腹、4-左侧腹、5-左下腹、6-盆腔、7-右下腹、8-右侧腹、9-上段空肠、10-下段空肠、11-上段回肠、12-下段回肠。每个区域的肿瘤大小若有且<0.5cm 评1分,0.5~5 cm(包括 5 cm)评 2 分,>5 cm 或融合病灶评3分。对于R0的患者PCI平均值为10分,而残余肿瘤量>0的患者平均PCI值为24分。
R0预测评分
Dessapt 等在2016年提出了基于临床、影像学检查和腹腔镜探查结果的新的预测评分系统。其主要是对年龄>60岁的患者评4分,CT 提示膈膜受累的患者评3分,PCI>10分的患者评 3 分。对于 R0预测评分≥4分的患者,预测非满意减瘤术的敏感度可高达 92.8%。对于≤3 分的患者行非满意减瘤术的危险度仅为4.4%,可行无瘤手术;而 4~6 分的患者行非满意减瘤术的危险度中等(25.6%),可以考虑行满意减瘤术;而对于≥7分的患者则有 42.9%的危险可能行非满意减瘤术。此评分系统综合了临床指标、影像学指标(易判断的 CT 征象)和 PCI 评分,全面地对卵巢癌患者进行评估,但其特异度还有待提高,且需要更多的临床中心的验证。
并发症评分
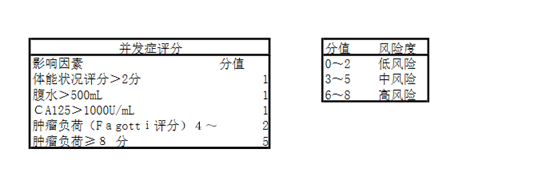
Vizzielli 等于 2016 年就预测患者术后并发症的发生风险建立了一个新的评分机制。体能状况评分>2分(1分)、腹水>500mL(1分)、 CA125>1000 U/mL(1分)、肿瘤负荷(Fagotti评分)4~8分(2 分)、肿瘤负荷≥8 分(5 分)。研究发现评分0~2分的人群为低风险人群;评分 3~5 分的人群为中等风险人群;评分6~8 分的人群为高风险人群。这个模型意义在于可以指导术者术前决定治疗方案,但也存在一定缺陷,比如模型中的肿瘤负荷需要术中探查才能评分,这就限制了其术前评估的能力。该研究是单中心,虽然样本量大, 但还是需要更多的研究去证实。
基于术前CT的影像学评估得出腹膜癌指数与卵巢癌手术结局及生存结局相关
01
目的
评估术前CT(CT-PCI)评估的腹膜癌指数(PCI)是否可以用作预测手术结局,无病生存期(DFS)和总生存期(OS)的无创术前工具。
02
方法
这是一项在单个机构中进行的回顾性观察性队列研究。我们考虑了所有诊断为卵巢癌并行术前CT的患者,这些患者在2008年至2010年之间进行了前期的细胞减灭术,并在2015年12月之前进行了术后临床随访。两名放射科医生使用Sugarbaker的图检查了CT扫描并评估了CT-PCI。我们通过ROC曲线分析评估了CT-PCI评分对手术结果的区分能力。通过Kaplan–Meier非参数曲线和多变量Cox回归分析评估了DFS和OS。
03
结果
本分析共纳入297例患者。CT-PCI与术后残余疾病呈正相关[比值比(OR)1.04,95%CI 1.01–1.07,p = 0.003]。ROC曲线分析返回的AUC = 0.64,用于预测宏观肿瘤的总体清除率。在多变量分析中,CT上未发现腹膜疾病的患者的DFS明显更长[(HR)2.28,p = 0.007]。放射性浆膜小肠受累是OS较短的孤立预测因素(HR 3.01,p = 0.002)。

04
结论
基于术前CT进行影像学评估得出的PCI与细胞减灭术后残留肿瘤有一定相关性。但是,它并不能可靠的识别出哪些患者可以行满意的肿瘤细胞减灭术。CT-PCI与DFS和OS均呈正相关,在晚期卵巢癌中是孤立的预后因素。
参考文献:
Fagotti A, Vizzielli G, Fanfani F, et al. Introduction of staging laparoscopy in the management of advanced epithelial ovarian, tubal and peritoneal cancer: Impact on prognosis in a single institution experience[ J]. Gynecol Oncol, 2013, 131(2): 341-346.
Suidan RS, Ramirez PT, Sarasohn DM, et al. A multicenter prospective trial evaluating the ability of preoperative computed tomography scan and serum CA-125 to predict suboptimal cytoreduction at primary debulking surgery for advanced ovarian, fallopian tube, and peritoneal cancer[ J]. Gynecol Oncol, 2014, 134(3): 455-461.
Suidan RS, Ramirez PT, Sarasohn DM, et al. A multicenter assessment of the ability of preoperative computed tomography scan and CA-125 to predict gross residual disease at primary debulking for advanced epithelial ovarian cancer[ J]. Gynecol Oncol, 2017, 145(1): 27-31.
Dessap ALt ,Huchon C,Ngo C,et al. Is complete cytoreductive surgery feasible in this patient with ovarian cancer? [J]. Surgical Oncol, 2016,25(3):326-331
Vizzielli G,Costantini B,Tortorella L,et al. A laparoscopic risk-adjusted model to predict major complications after primary debulking surgery in ovarian cancer: A single-institution assessment [J]. Gynecol Oncol,2016, 142(1):19--24.