从北肿R系列研究看局部进展期直肠癌新辅助治疗模式
直肠癌发病率约占结直肠癌总发病率的1/2[1]。近年来,将更多或全部的全身化疗前移到手术之前,而将全直肠系膜切除术(TME)作为治疗模式最后一个环节的直肠癌全程新辅助治疗(TNT)策略[2]越来越受到大家认可。本次我们有幸请到北京大学肿瘤医院武爱文教授,基于中心的R系列研究对直肠癌治疗相关热点问题展开讨论。

局部进展期直肠癌TNT治疗Q&A
Q:目前直肠癌新辅助治疗研究热点主要针对中高危人群,我们知道针对低危人群设计R01前期的部分研究结果已经公布,请您谈谈这项研究的创新点及对临床的意义?
A:PKUCH-R01是一项前瞻性单臂II期研究,旨在探讨对MRI分层低风险直肠癌给予TNT后实施等待观察及器官保留手术的安全性和有效性。自2016年8月至2019年11月共入组72例低风险度的中低位直肠癌患者,共38例患者纳入初步分析[3](研究设计如图1)。
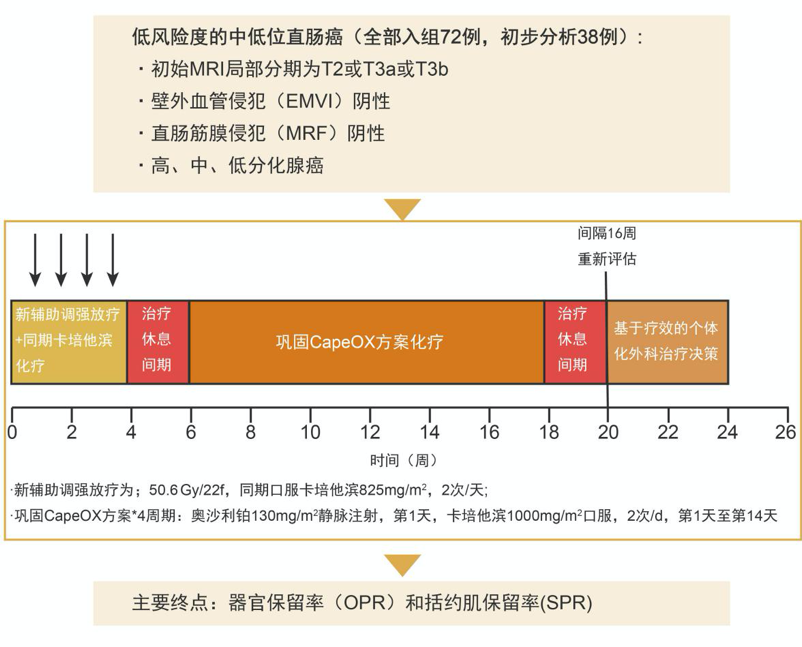
图1. PKUCH-R01研究设计
如表1所示,通过基线MRI筛选低风险亚组,并给予全程新辅助治疗,获得了42.1%的临床完全缓解率(cCR)和52.6%的器官保留率(OPR) [3]。

表1. 初步分析中38例低位直肠癌患者TNT治疗后的评效结果及初始决策[例(%)]
R01研究的设计特点和创新性体现在:1、目前针对低危患者新辅助治疗的前瞻性研究较少,圣保罗医院Habr-Gama等2019年发表的研究[4-5]显示,对T2N0直肠癌实施新辅助治疗+巩固氟尿嘧啶化疗,可获得86%的初始cCR率,这与R01研究中的分析非常接近。2、R01研究的治疗方案整合了高强度的新辅助治疗手段:22f-IMRT生物有效剂量大于常见50.4 Gy/28f方案。巩固化疗强度与TIMING研究[6]类似;并因巩固化疗延长了等待间期至16周以上。
综上,MRI分层低风险直肠癌实施新辅助放化疗联合巩固化疗的治疗模式,可达到较高的cCR/near-cCR 率,使该亚组在个体化外科决策后获得50%以上的器官保留率。该研究为低风险直肠癌亚组保留器官功能提供了新的数据支持。
Q:为达到器官保留的目的,在患者达到cCR或者near-cCR时,医生和患者需要共同决定是否行W&W策略。请您简单介绍一下W&W治疗策略。
A:对新辅助治疗后出现cCR的直肠癌患者暂不实施根治性手术,通过密切的随访观察,以期得到持续cCR,从而避免不必要手术的治疗策略,这就是我们所谓的等待观察(watch and wait,W&W)策略[7]。
W&W的收益是:在不降低肿瘤学疗效前提下,显著提高患者生活质量和重返社会的能力。保留直肠反射弧、直肠及肛门的器官功能、避免手术损伤和并发症风险。W&W的风险主要是等待期间远隔转移的风险,而绝大部分患者原发灶相关的局部再生、补救性根治术后复发都不会影响生存;此外新辅助治疗毒性也是患者要付出的代价[7]。
W&W策略的重要证据如表2所示[10-14]。目前直肠癌根治术后ypCR患者的5年总生存率为88%~90%[8-9]。新辅助治疗后达cCR实施W&W的患者,其5年总生存率为 73%~87%[10-12];2年局部再生率为21%~25%[10-13];5年远处转移率为7%~9%[10-13];肿瘤局部再生后接受补救性TME手术的患者有80%~91%可以达到R0切除[10,12-13]。

表2. 等待观察策略重要循证医学证据
合理的cCR诊断标准是直肠癌患者接受W&W策略的安全保障。我国直肠癌新辅助治疗后等待观察数据库研究协作组(CWWD)建议通过内镜、直肠指检、直肠核磁(T2WI/DWI)、血清癌胚抗原(CEA)水平及胸腹盆增强CT 综合判断患者是否达到cCR或near-cCR,具体诊断标准见表3[7]。

表3. 临床完全缓解、近临床完全缓解及非临床完全缓解的判定标准(CWWD标准)
目前,我国外科医生对W&W策略的认知水平和接受度仍较低,提示未来需要结合各地方各中心的患者情况和治疗情况,开展相应的临床研究,为这一策略提供更多中国数据和诊疗经验[15-16],我们也要认识到等待观察可作为一种治疗选择,患者应享受这方面的知情权并获得参与决策的机会,才能让更多患者从中获益。
Q:今年的ASCO大会直肠癌新辅助治疗模式大放异彩,但仍有部分问题有待深入挖掘。如高危患者如何增加术前治疗强度?
A:基线MRI评价中出现环周切缘阳性(mrCRM+)、mrN2、壁外血管侵犯阳性(EMVI+)以及T3c/T3d/T4a/T4b分期肿瘤的局部风险和转移风险均显著增加,目前国际的趋势是,对于这些高危患者将化疗前移以利于降低远隔转移率并提高生存率,尤其是放化疗前的诱导化疗已被NCCN指南[17]所推荐,具备缩短治疗总时间、提高化疗耐受性、加快术后临时性造口闭合等明显的优点。目前,全程新辅助治疗已经在更多中心开展,其治疗方案也有多种形式。
我们中心采用包括新辅助诱导化疗(3个周期CapeOX)+放化疗(IMRT,50.6Gy/23f)+巩固化疗(2个周期CapeOX)的方案(研究设计如图2)。

图2. PKUCH-R02研究设计
初步数据显示:从2017年8月到2018年8月,72名MRI分层高危直肠癌患者(anycT3c/3d/T4a/T4b、cN2、MRF+、EMVI+)纳入研究,所有患者计划24周的全程新辅助治疗,在治疗的第10周和第24周进行评估,根据评估结果决定进行根治性切除或其他治疗(包括内科治疗以及等待观察策略)。最后共有68例患者完成治疗纳入最终分析(4例患者中途拒绝治疗),结果如表4所示。临床和病理完全缓解率为27.9%(21/68);50例手术患者术后30d并发症率和死亡率分别为12%和0%。这表明全程新辅助治疗是可耐受的治疗方案,但是其3级以上毒副反应较高,需要给予足够的重视。

*4例患者中途拒绝治疗
**其中2例因肿瘤再生接受补救性手术,病理未呈现
表4. 最终分析结果
Q:近年来免疫抑制剂在肠癌新辅助治疗的尝试也是备受期待,请您谈谈对TNT模式+免疫治疗的展望。
A:根据探索性Ⅱ期临床研究NICHE[18]最新公布的结果,早期结肠癌患者或许可以在新辅助免疫治疗(伊匹木单抗+纳武利尤单抗)中获益。其中,错配修复功能缺陷(dMMR)的患者,病理缓解率达100%(20/20),病理完全缓解率(PCR)达60%;错配修复功能完整(pMMR)的患者中,仍有27%(4/15)可达到部分缓解。
如何令免疫治疗抵抗的微卫星稳定(MSS)直肠癌能够对免疫治疗起效一直是当前直肠癌免疫治疗领域的难题。VOLTAGE研究A1队列中纳入37例MSS的局部晚期直肠癌患者。患者在传统新辅助放化疗(卡培他滨+50.4Gy)结束后再接受3~5个周期纳武利尤单抗治疗,最后行TME手术。结果显示,MSS患者pCR率达到30%,达到了其主要研究终点。但新辅助免疫治疗能否改善生存,还有待长期生存随访的结果。
本中心R系列研究中的R04研究与VOLTAGE研究同步进行,区别是我们选择的入组患者是具有高风险因素的局部进展期中低位直肠癌。治疗顺序上基本同R02研究:在CapeOX诱导化疗基础上增加3个周期的免疫抑制剂,然后根据评效序贯同步放化疗及巩固治疗。我们中期的结果cCR及PCR率为35.7%,MPR率为57.1%。我们研究的初步体会是MSS直肠癌免疫抑制剂PD1抗体的介入,应该是在动态检测肿瘤及肿瘤微环境的变化情况下,恰当的时机选择ICI治疗。
最终治疗目标
局部进展期直肠癌的治疗已进入肿瘤学疗效和器官功能并重的时代,对于直肠癌的治疗策略不再是单一的固定模式,传统“放疗→手术→辅助化疗”的三明治治疗模式弊端凸显[2]。新辅助治疗策略主要是经典方案的重新组合,并在不降低生存的前提下提出以“临床完全缓解、等待观察”等新终点为目标。
未来基于功能影像、基因/分子分型以及新辅助治疗反应的个体化策略将得到进一步探索。目前提示局部/全身高危的基线因素有:T3c/d、T4b、MRF+、EMVI+、G4分化、髂内组淋巴结肿大等;系膜内淋巴结因MRI本身准确率限制了其效能;此外对新辅助治疗后mrTRG/ypTRG提示缓解不佳、ypN+、CRM+等也是预后差的因素。CEA升高往往提示对放疗敏感性相对较差,潜在远隔转移率高。合并上述高危因素的病例,其治疗目的是治愈和生存;而不合并上述因素、保肛保功能意愿强的患者,是主动性等待观察疗法的目标和优势人群。此外,KRAS/BRAF/MSI/HER2 状态这些因素还有待进一步探索,但针对局部可治愈性癌,使用新辅助靶向治疗通常难有显著差异,靶向治疗的优势仍主要在IV期病例。
小结
北肿直肠癌协作组成员包括胃肠外科、影像科、放疗科、病理科、消化肿瘤内科、肝胆外科、介入科、核医学等科室,其协作形式与我们常规意义上的MDT讨论运行病例不同,而是以临床科研为导向:对标MSKCC等国际顶尖癌症中心。我们有信心利用国内的病例资源和后发优势,成功追赶甚至超越,并形成我国本领域的学术影响力。
外科医生在直肠癌诊疗中扮演了重要的角色。恶性实体肿瘤治疗策略已从单纯外科为主的治疗进入了综合治疗时代[19]。随着直肠癌新辅助治疗理念的转变,外科医生的角色和观念正逐渐转变:从一线局部治疗的执行者变为整体方案的协调者,治疗目标也将如何平衡生存获益、手术创伤与并发症、器官功能保留和远期生存质量[19]考虑进去。这一目标的实现则需要包含外科在内的多学科互相协作,充分结合各科优势来制定综合性治疗策略。
参考文献:
[1] 杜灵彬, 等. 2013年中国结直肠癌发病与死亡分析[J]. 中华肿瘤杂志 , 2017, 39(9): 701-706.
[2] 陈功, 等.基于器官功能保全的局部进展期直肠癌诊治新策略[J].中国癌症防治杂志,2019,11(01):13-20.
[3] 王林,等.低风险直肠癌患者全程新辅助治疗后主动性等待观察及器官保留策略:一项前瞻性、单中心、单臂研究(PKUCH-R01)的初步报告[J].中华胃肠外科杂志,2020,23(3):258-265.
[4] Habr-Gama A, et al. Ann Surg, 2019, 269(1): 102-107.
[5] Habr-Gama A, et al. Ann Surg, 2019, 270(6): e119-e120.
[6] Garcia-Aguilar J, et al. Lancet Oncol, 2015, 16(8):957-966.
[7] 直肠癌新辅助治疗后等待观察策略专家共识(2020版)[J].中华胃肠外科杂志,2020,23(1):1-9.
[8] Maas M, et al. Lancet Oncol, 2010, 11(9):835-844.
[9] Martin ST, et al. Br J Surg, 2012, 99(7): 918-928.
[10] Smith JJ, et al. JAMA Oncol, 2019, 5(4): e185896.
[11] van der Valk MJM, et al. Lancet, 2018, 391(10139): 2537-2545.
[12] Chadi SA, et al. Lancet Gastroenterol Hepatol, 2018, 3(12): 825 -836.
[13] 王林,等.中低位直肠癌新辅助治疗后临床完全缓解或近临床完全缓解的长期预后分析[J].中华胃肠外科杂志,2018,21(11):1240-1248.
[14] Dattani M, et al. Ann Surg, 2018, 268(6): 955-967.
[15] 孙婷婷,等.直肠癌新辅助治疗后"等待观察"疗法:中国外科医生的认知和态度及治疗选择现况调查[J].中华胃肠外科杂志,2019,22(6):550-559.
[16] 蔡三军,等.局部进展期直肠癌新辅助治疗的现状与展望[J].中国普外基础与临床杂志,2018,25(11):1281-1285.
[17] NCCN clinical practice guidelines in Oncology:Rectal Cancer(2020.V6)
[18] Myriam C, et al. Nat Med 2020 Apr;26(4):566-576.
[19] 武爱文.从肿瘤外科沿革看主动性直肠癌等待观察策略研究的必要性[J].中华胃肠外科杂志,2020,23(3):225-229.