肺癌领域MET-TKI研究进展喜人 光芒外露持续闪耀肺外各大癌种
2020年当之无愧为MET通路研究进展大热的一年,中国原创高选择性MET抑制剂亮相国际舞台捷报频传,MET通路在非小细胞肺癌领域迎来了分子特征、检测和治疗等全方位的研究进展,更在肾癌、前列腺癌、胆道系统肿瘤、胃癌、卵巢癌中显示出极具潜力的治疗前景。【肿瘤资讯】为您细数这些瘤种中的MET故事。
MET影响乳头状肾细胞癌预后,MET抑制剂优于标准治疗
SAVOIR: A phase III study of savolitinib versus sunitinib in pts with MET-driven papillary renal cell carcinoma(PRCC)(2020 ASCO 摘要号:5002)
乳头状肾细胞癌(PRCC)是最常见的非透明肾细胞癌类型,约占肾恶性肿瘤的10%~15%。部分PRCC为MET驱动,在之前的单臂Ⅱ期研究中,高选择性的MET抑制剂赛沃替尼在MET驱动的PRCC中具有抗肿瘤活性。今年美国临床肿瘤年会(ASCO)公布了Ⅲ期SAVOIR研究结果,进一步评估赛沃替尼对比舒尼替尼标准治疗在MET驱动PRCC中的疗效。
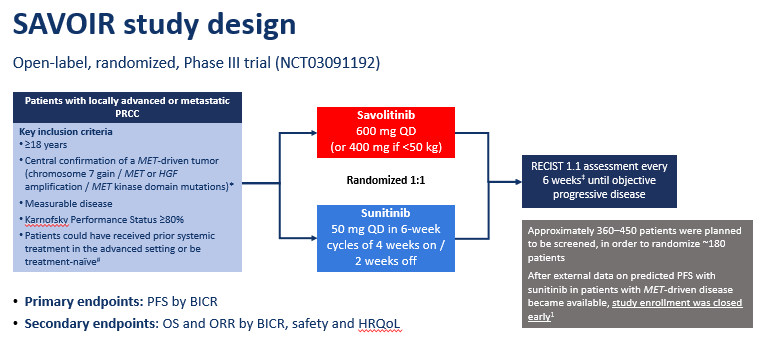
图1. SAVOIR研究设计
在这项开放标签的随机研究中,中心证实为MET驱动[MET或肝细胞生长因子(HGF)扩增,7号染色体增加(多倍体)和/或MET激酶区突变]的初治或经治转移性PRCC患者,随机接受赛沃替尼600mg QD(体重<50kg的患者使用400mg QD)或舒尼替尼50mg QD,连续服药4周,停药2周。主要终点是孤立委员会评估的无进展生存(PFS),次要终点包括总生存时间(OS)、客观缓解率(ORR)、安全性和耐受性。研究计划入组180名患者,数据截止时(2019.8.19)仅随机化入组了60名患者(赛沃替尼组n=33;舒尼替尼组n=27)。大部分患者具有7号染色体增加(赛沃替尼组91%;舒尼替尼组96%)。
和舒尼替尼组相比,赛沃替尼组的PFS、OS和ORR在数值上都有所改善:赛沃替尼组和舒尼替尼组的PFS分别为7.0个月 vs 5.6个月(HR=0.71,P=0.313);OS分别为未估算 vs 13.2个月(HR=0.51,P=0.110);ORR分别为27%(9/33) vs 7%(2/27),6个月的疾病控制率(DCR)分别是48% vs 37%,12个月的DCR分别是30% vs 22%。
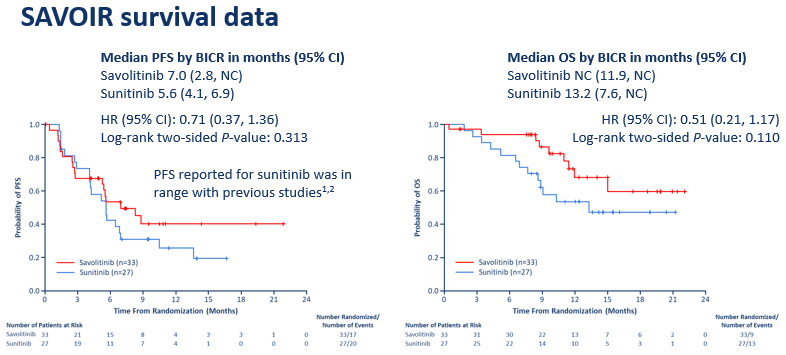
图2. SAVOIR研究中,赛沃替尼组和舒尼替尼组的PFS、OS
安全性方面,两组的治疗相关不良事件(AE)发生率分别为67%和93%,治疗相关严重不良事件发生率为12%和15%。停药后,赛沃替尼组36%的患者和舒尼替尼组19%的患者接受了后续的抗肿瘤治疗。
虽然患者数量和随访时间有限,但是赛沃替尼显示出令人鼓舞的疗效,而且和舒尼替尼相比,安全性改善明显。
MET status and treatment outcomes in papillary renal cell carcinoma(PRCC): Pooled analysis of historical data(2020 ASCO 摘要号:e19321)
PRCC中,可以用来指导靶向治疗的分子标志物数据有限。目前进展期/转移性PRCC患者的治疗药物主要包括批准用于透明肾细胞癌的药物,如舒尼替尼或依维莫司,但是它们在PRCC中的活性有限。部分PRCC为MET驱动,而且可能和预后相关。为明确MET活化在进展期/转移性PRCC中的作用,研究探索了接受靶向治疗的进展期/转移性PRCC患者的MET状态以及对临床结局的影响。
这项大型全球回顾性观察研究纳入了经治的局部进展/转移性PRCC患者,通过二代测序(NGS)方法回顾性分析存档标本的MET状态。MET驱动疾病定义为MET和/或HGF扩增,7号染色体增加(>30%的肿瘤组织)和/或MET激酶域突变。研究目标包括不同MET状态下的PFS、至治疗失败时间(TTF)和OS。
305/308名患者接受了一线治疗,舒尼替尼是最常用的一线治疗药物(68%)。214名(69%)患者接受了二线治疗,依维莫司最为常用(20%)。179名获得NGS结果的患者中,38%为MET驱动,49%为MET非依赖,13%为7号染色体倍性不能评估。各组的基线人群特征大致平衡。舒尼替尼治疗的患者中,MET驱动PRCC患者比MET非依赖PRCC患者的PFS和TTF在数值上更长,PFS分别是9.2月 vs 5.7月(HR=0.67),TTF分别是6.2个月 vs 5.6个月(HR=0.79),但是OS类似,分别是17.1个月 vs 13.9个月(HR=1.09)。依维莫司治疗的患者中,各MET状态组的PFS和TTF类似,但是样本量很小。
表1
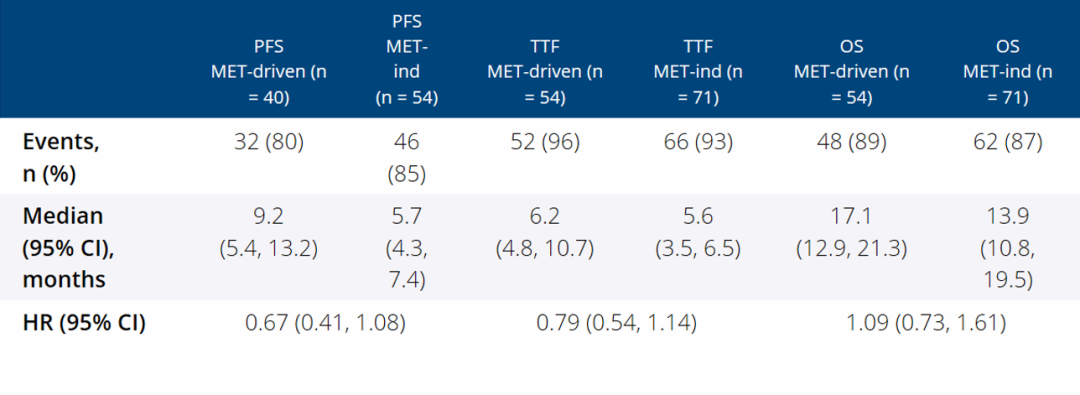
进展/转移性PRCC的MET异常很常见,MET异常或可影响PFS和TTF,需要为MET驱动PRCC寻找更合适的治疗药物。
胆道系统肿瘤存在MET异常,MET抑制剂现潜力
The landscape of MET mutations in Chinese biliary tract cancers(2020 ASCO 摘要号:e16652)
胆道系统肿瘤(Biliary Tract Cancers, BTC)通常预后不良,治疗选择有限。多种肿瘤中都存在MET改变,提示对MET抑制剂敏感。据西方国家报道,肝内胆管癌(ICC)的MET异常发生率是2%~7%,肝外胆管癌(ECC)的MET异常发生率是3.7%,但是MET在中国BTC患者中的特征还不清楚。
使用包含450个基因的NGS方法检测926名中国BTC患者的福尔马林固定、石蜡包埋(FFPE)肿瘤组织以及配对血样,分析单核苷酸变异(SNV)、短和长插入/缺失(Indels)、拷贝数变异和基因重排/融合等基因组改变。检测由美国病理学家协会(CAP)和美国临床实验室改进法案修正案(CLIA)认证的实验室进行。
BTC患者的MET突变发生率为4.1%,其中ICC是5.3%,肝门胆管癌(HCCA)是3.4%,ECC是3.0%,胆囊癌(GBCA)是2.6%。基因扩增是BTC中最常见的MET突变类型(2.6%),比基因融合/重排(1.1%)和SNV(0.9%)发生率更高,此外,还检测到了新型MET融合伴侣TNS3、TRIM4,以及MET 14外显子跳跃突变。有或无MET改变的患者,其肿瘤突变负荷(TMB)无差异(平均TMB:6.5muts/Mb vs 5.6muts/Mb,P=0.213)。一名具有MET基因扩增的进展期ICC患者(一般状况评分[PS]3)接受了克唑替尼作为一线治疗,4个月后,患者达到CR而且没有明显不良反应。
该研究是目前已知的最大BTC队列,也是第一个报道中国患者MET异常情况的研究。MET突变发生于4.5%的BTC患者,MET抑制剂可能是BTC患者潜在的治疗选择。基因扩增、SNV和基因融合等所有类型的MET突变都可以在BTC患者中检测到,证明NGS可能是一种有效的检测MET异常的工具。总的说来,MET是BTC有希望的治疗靶点,检测MET异常对于预测靶向治疗的敏感性而言,非常重要也非常必要。
MET抑制剂可显著抑制MET扩增胃癌细胞生长
Tepotinib inhibits the epithelial-mesenchymal transition and tumor growth of gastric cancers via increasing GSK3&β;, ECAD, MUC5AC, and MUC6(2020 ASCO 摘要号:e16562)
黏蛋白的异常表达可以促进上皮间质转化(EMT),进而导致肿瘤生成。肿瘤生成相关通路包括c-MET和&β;-catenin相关黏蛋白。今年ASCO公布一项基础研究,探索了人胃癌(GC)细胞系中MET、MUC5AC、MUC5B和MUC6 EMT信号通路的表达特征,并进一步明确了这些细胞系对Tepotinib敏感性的差异。
研究评估了GC细胞系中Tepotinib的抗肿瘤活性。通过MTS、流式细胞术、蛋白质印记实验和荧光定量PCR(qRT-PCR)方法,分析Tepotinib对于细胞活力(IC50)、凋亡细胞死亡、EMT、c-MET和&β;-catenin信号通路的作用。
Tepotinib对于c-MET扩增的SNU620、MKN45、KATO Ⅲ细胞具有剂量依赖性生长抑制作用,并可以诱导凋亡,但是Tepotinib对于c-MET降低的MKN28和AGS细胞没有治疗作用。Tepotinib还可以显著降低SNU620和MKN45细胞的磷酸化c-MET、总体c-MET、磷酸化ERK、总体ERK、&β;-catenin和c-Myc蛋白水平。相反的,药物对于KATO Ⅲ细胞活性较低。Tepotinib显著降低MET表达GC细胞中的MMP7、COX-2、WNT1、MUC5B和c-Myc等EMT促进基因的表达,增加GSK3&β;和ECAD等MUC5AC、MUC6 EMT抑制基因的表达。在小鼠移植物模型中,Tepotinib 10mg/kg/d每日口服治疗组的小鼠肿瘤体积显著缩小,而且组织学上,Tepotinib比对照组诱导更多的坏死。
数据表明Tepotinib可能对c-MET扩增GC具有治疗作用,需要临床研究来证实这种治疗作用。
使用c-MET和泛HER抑制剂靶向联合治疗,对c-Met和ErbB高活性卵巢癌可能有效
Test identifies ovarian cancer patients with hyperactive c-Met and ErbB signaling tumors who may benefit from c-Met and pan-HER combination therapy(2020 ASCO 摘要号:e18038)
卵巢癌患者中还没发现存在具有临床意义的ErbB基因变异,因此,检测ErbB通路活性而非基因变异,也许有助于发现能从ErbB靶向治疗中获益的患者。之前发现20%~25%的HER2阴性乳腺癌患者通过CELx信号功能检测发现了ErbB和c-MET通路活性失调。今年ASCO报道一项CELx检测卵巢癌细胞的研究,旨在确定ErbB或c-MET通路失调是否和卵巢癌发病相关。这项基础研究的目的是:1)明确卵巢癌患者肿瘤细胞和肿瘤细胞系的c-MET和ErbB家族信号通路活性;2)在卵巢癌移植物模型中体内评估泛HER和c-MET抑制剂的疗效。
体外研究部分,培养15名卵巢癌患者的新鲜肿瘤标本和12个卵巢癌细胞系的细胞,使用xCELLigence阻抗生物传感器检测活体细胞对于ErbB和c-MET激动剂(NRG1b,EGF或HGF)±拮抗剂[2C4(一种HER2二聚化抑制剂)或c-MET激酶抑制剂Tepotinib]的反应。信号活性高于研究建立的阈值,则为EGFR、HER2和c-MET信号通路活性异常。移植物研究中,使用CELx检查发现具有HER2、EGFR和c-MET信号通路异常的卵巢癌细胞系OVCAR-4。40只NSG雌鼠每只注射200万个肿瘤细胞,小鼠随机进入对照组或接受来那替尼、Tepotinib,或来那替尼联合Tepotinib治疗16天。
患者细胞和细胞系样本进行CELx体外检测,发现4/27(15%;95%CI 6%-32%)具有高活性的HER2和c-MET信号通路。移植物模型研究中,Tepotinib+来那替尼治疗组的小鼠肿瘤体积比对照组缩小40%,而对照组和Tepotinib组或来那替尼组的肿瘤体积没有显著差异。
这些结果表明,卵巢癌患者中有部分存在异常ErbB和c-MET信号通路活性,可能对ErbB和c-MET抑制剂联合治疗有反应。有必要进行临床研究来评估联合c-MET和泛HER抑制剂对于此类患者的疗效。
随着检测技术的普及和各癌种基因图谱的破译,MET靶点也有望成为一个“泛瘤种”标志物,为肾癌、前列腺癌、胆道系统肿瘤、胃癌、卵巢癌等肿瘤的治疗带来突破。相关临床试验已在逐步开展,相信MET抑制剂将为此类治疗选择有限的患者带来更多希望。