抑郁症的抗炎症治疗
抑郁(Major Depressive Disorder)是一种长期心理障碍,包括以下症状:对以往有兴趣的事物丧失兴趣、疲劳、感觉无助、无希望感、坐立不安,可能造成严重的后果如无法工作或自杀。由于大众对抑郁症的认识越来越高以及诊断方法的改进,抑郁的患病率在世界范围内激增。虽然很难精确测量患病率,但大部分统计数据显示在人的一生中抑郁症的患病率可以从6.6%(日本) 到21.0%(法国)。同时,不少证据显示抑郁症患者有罹患一些常见慢性疾病的高风险,如冠心病、中风、糖尿病、心肌梗塞和某些癌症(Kessler & Bromet, 2013)。
病因学探讨
抑郁症的确切发病机理尚未被阐明。基因、环境因素和整体健康在抑郁症发展中均起重要作用。在神经生物学上有几个关于抑郁症的猜想。研究显示单胺神经传递、下丘脑-垂体-肾上腺轴失衡导致高皮质醇水平、炎症、神经新生和可塑性退化都与抑郁有关。其中,压力、炎症和神经新生之间的交错关系提示抑郁心理和身体的症状能从一个不同的角度来尝试疗愈(Dean & Keshavan, 2017)。
单胺神经传递
单胺类神经递质是一类可能在抑郁症中发挥作用的神经递质。据推测,一种或多种单胺类代谢的改变会引起抑郁症。很多治疗抑郁症的药物也是基于这一理论而设计。血清素代谢物在抑郁个体中减少,这表明生物可用性血清素水平可能更低。去甲肾上腺素作为一种情绪调节剂,被认为与皮质醇一起在压力下升高,引起神经内分泌和免疫系统的变化。证据还表明,抑郁症患者的存在多巴胺能传递和中边缘通路改变,进而导致脑源性神经营养因子(BDNF)和神经可塑性改变。所有上述提到的神经递质都能影响大脑功能(Dean & Keshavan, 2017;Verduijn, et.al., 2015)。
压力反应
另一个与抑郁有关的理论是压力反应。在慢性应激模型中,一系列的行为异常是由HPA轴的过度活跃反应引起的(Willner, 2005)。皮质醇在这种情况下会增加,导致大脑某些区域的功能发生转变,包括执行功能、情绪处理、记忆和学习。生命早期的生活压力被认为对HPA轴有持久的影响,这使得个体对后来的压力更加敏感(Pechtel, & Pizzagalli, 2011)。
炎症
研究表明,炎症可导致研究对象产生抑郁行为。Silverman, et al.(2013)发现糖皮质激素受体(corticoid receptor, GR)功能受损可增强小鼠炎症反应,增加疾病/抑郁样行为。GR水平对糖皮质激素的作用至关重要。GR功能受损导致脑促炎细胞因子表达增加。小鼠昏睡、立毛、上睑下垂等疾病行为与脑细胞因子表达(TNF-a、IL-1b、IL-6 mRNA)呈正相关。炎症可能通过其他已知的机制导致抑郁。例如,吲哚胺2,3二氧合酶(IDO)会分解血清素的前体,降低其有效性,导致抑郁行为。与正常血糖动物相比,糖尿病小鼠的IDO表达更高,可以通过间接抑制IDO的方法恢复(da Silva Dias, et al., 2016)。在抑郁症中,慢性炎症与儿童早期创伤、主要精神障碍和某些慢性身体疾病有关。
神经新生与可塑性
另一种假说认为抑郁症抑制了神经新生和神经可塑性。脑源性神经营养因子(BDNF)是一种重要的神经可塑性分子因子。BDNF促进神经元的存活,促进新生神经元的生长和分化。但在各种研究中,血清BDNF水平与抑郁症的结果并不一致。在一个关于帕金森的研究中,帕金森患者的血清BDNF水平明显低于健康对照组(p < 0.01)。同时,帕金森伴抑郁患者的受试者血清BDNF水平明显低于不伴抑郁患者(p < 0.01),显示抑郁与血清BDNF水平相关(Wang, et al., 2017)。然而,在Ryan, Dunne, & McLoughlin(2018)的研究中,对照组(50名受试者)和抑郁组(61名受试者)血浆BDNF水平无差异。也就是说,目前仍缺乏充分证据考虑BDNF与抑郁呈明显相关。
目前的诊疗共识及局限性
抑郁症可按单次及反复发作来区分。单次发作的标准是在过去两周内出现情绪低落或对几乎所有活动失去兴趣或乐趣,以及其他7种症状中的任意3种。抑郁症的不同临床特征因其能影响治疗效果应及时分辨。持续性抑郁情绪的严重症状包括在大多数或所有活动中失去乐趣和/或对通常令人愉快的刺激缺乏情绪反应、早醒、早晨症状恶化、体重显著下降和精神运动迟缓/躁动通常是严重的亚型,经常在精神科住院患者中见到。精神病性抑郁症是一种亚型,有妄想和/或幻觉的症状,也需要精神科干预治疗。非典型亚型的症状有强烈的疲劳和体重增加,可能很难与其他疾病区分(Bauer, et al., 2013)。
目前来说,抑郁症的治疗包括药物、心理治疗、替代疗法或整合疗法。在不同种类的抑郁症患者中,我们已观察到不同的治疗会产生不同的效果。Cuijpers et al.(2012)回顾了涉及4734名患者的52个研究,发现老年患者对于整合治疗的效果反馈最好,优于单独使用药物或心理疗法,而心境恶劣型的患者对药物的反馈更好。大部分患者对于急性发作及时治疗的缓解率很高。但仍有20-30%没有完全缓解。超过50%的患者有过抑郁单次发作,之后会发生第二次。因此,预防抑郁症与治疗抑郁症同样重要(Bauer, et al., 2013)。而持续药物治疗可能产生令人担心的副作用。患者很容易因出现的药物副作用而自行停药,这种情况不仅发生在重症抑郁症患者中,连轻度的患者也会出现。所以,如何最小化药物用量,同时结合其他疗法(如心理治疗、生活方式干预、营养疗法等)对于抑郁症患者想取得最佳治疗效果而言变得非常重要(Bauer, et al., 2015)。
本文将讨论抑郁症状的炎症基础,并从功能医学的“防御与修复失衡”(Defense & Repair Imbalance)角度探讨抑郁症状的另一种治疗方案。炎症作为一个正常的人类免疫反应在抑郁症病理生理中起着不容忽视的作用。急性炎症反应通常见于组织受伤或微生物感染。通常来说,急性炎症比较轻微和局限。如果炎症的激发物一直没有消失,反应可能变成慢性。慢性炎症常见于持续的感染状态,或在高血压、自身免疫系统疾病、代谢问题和某些肿瘤中(Fares-Frederickson, & David, 2018)。
近年来,越来越多的研究表明炎症与抑郁或抑郁行为有着密切的联系。一项在法国进行的ESPRIT老年神经精神疾病研究中,380名患有或没有抑郁症的参与者接受了外周表观遗传标记的检查。虽然影响效应较小,但结果发现抑郁个体IL-6甲基化水平较低,提示炎症相关基因型可能在抑郁病理生理中发挥作用(Ryan, et al., 2017)。另外,抑郁症患者炎症标志物可能升高。在一项有105名参与者参加的对照研究中,没有精神病特征的未经治疗的抑郁症患者的IL-6水平显著高于健康对照组(p<0.001)。与此同时,TNF-α水平在抑郁症组中也明显升高(p < 0.001)(Lindqvist, et al ., 2017)。在老年人,研究结果似乎不太稳定。Smith, Au, Ollis, & Schmitz(2018)回顾了32项研究(23项分类排列研究,7项纵向研究,以及2项分类排列和纵向相关性的研究),以确定c -反应蛋白(C-reactive Protein, CRP)和IL-6与老年人抑郁症的相关性。经调整后,结果显示IL-6与临床抑郁(p=0.003)和抑郁症状(p=0.001)的横断面相关。然而,CRP只与抑郁症状增加的风险纵向相关(p=0.003)。这可能推导出一个结论,即IL-6是当前抑郁症状的一个指标,同时CRP与老年人抑郁的发病有关。
学术界有一种假说认为抑郁和炎症有一个双向循环。炎症过程时,外周血中释放的细胞因子到达神经系统,增加了中枢神经系统炎症。中枢神经系统炎症通过调节神经递质(如血清素、去甲肾上腺素和多巴胺)代谢失调,影响神经可塑性,促进下丘脑-垂体-肾上腺(HPA)轴功能失调,诱发抑郁症状。同时,抗抑郁药显示出具备降低外周血IL-6, TNF-a, IL-10 和C-C 配基2趋化因子的能力,提示抑郁症状可通过降低炎症来治疗(Köhler, et al., 2018)。Semenkovich, Brown, Svrakic, & Lustman(2015)回顾了有关2型糖尿病(T2DM)患者抑郁症状的研究。T2DM是一种促炎状态。与普通人群相比,T2DM患者患抑郁症的风险是普通人群的两倍。
另一方面来说,抑郁症和抑郁行为是慢性炎症疾病的预测因子。一项基于人群健康和营养的10年前瞻性队列研究(ATTICA研究)分析了853名没有心血管疾病病史的中年人的数据,发现抑郁、焦虑和心血管疾病发病率之间存在正相关(Kollia, et al., 2017)。Semenkovich, Brown, Svrakic, & Lustman(2015)的研究分析表明,既往抑郁患者可能会通过体重增加、缺乏体育活动和抗抑郁药物的使用而导致T2DM风险增加。抑郁症患者可能会情绪和食欲失调,导致血糖水平无法稳定。Ambrósio, et al.(2018)回顾了16个分类排列研究和6个纵向研究得出类似的结论,不过还有其他的发现——行为改变、神经化学改变、肠道微生物群和脂肪组织都与肥胖-抑郁-炎症循环有关(如下图,obesity-depression-inflammation cycle. Ambrósio, et al., 2018)。

需要注意的是,证据同样指出不是所有的抑郁亚型被证实出炎症状态。国家健康与营养检查调查发现,非典型抑郁症患者的CRP升高,但这个研究中非典型抑郁症受试者的数量明显低于典型组和对照组(Hickman, Khambaty, & Stewart, 2014)。一项包含2563名受试者的研究显示,抑郁症患者炎症标志物水平存在性别差异。在男性,抑郁组比健康对照组和高危组(定义为目前没有抑郁症诊断但有家族史或轻度抑郁症状)CRP水平显著升高(p < 0.001,调整后),而IL - 6水平也明显高于调整后的健康对照组(p = 0.002)。女性中未发现类似情况(Verduijn, et al., 2015) 。一项从Mashhad中风和心脏动脉粥样硬化障碍(MASHAD)队列研究中招募了9247名参与者的研究发现,男性的白细胞计数随着抑郁和焦虑症状的增加而增加,而女性没有,这表明抑郁和焦虑的增加与炎症的加剧有关(Shafiee, et al., 2017)。Woelfer, Kasties, Kahlfuss, & Walter(2018) 回顾抑郁症和非典型抑郁症亚型所涉及的不同功能部位。作者得出结论,非典型抑郁症亚型患者比抑郁症患者炎症性更强。此外,抗炎药物和抗生素被证明可以增强抗抑郁药物的作用。到目前为止,对于哪种亚型的抑郁症更具有炎症性尚无共识。然而,它给我们一个新的视野,结合药物和营养干预的抗炎治疗,能与抑郁症标准疗法结合以加强治疗效果。
适用于预防和维持抑郁症治疗的饮食法
饮食是减少慢性炎症最好、最安全的方法之一。60名来自RESMENA-S研究的肥胖受试者(BMI大于36)被随机分为两组。经过6个月的减肥计划,体重减轻越多的参与者抑郁症状减轻的越明显,同时CRP和瘦素的降低也越明显。然而,高退出率(26名受试者)是本研究的一个限制(Perez-Cornago, et al., 2014)。在SMILE试验中,67例抑郁症患者通过饮食干预与社会支持(对照组)进行了为期12周的平行单盲随机对照试验。大多数参与者已经使用了一些疗法来治疗症状,包括心理疗法和药物疗法。膳食干预是基于澳大利亚膳食指南和希腊成人膳食指南,包括动机性访谈、目标设定和正念饮食。饮食干预组在12周后明显优于对照组(p < 0.001)。干预组和对照组分别缓解率为32.3%和8.0%。结果表明,合理的饮食干预可能是抑郁症治疗的一种选择(Jacka, et al., 2017)。
Molendijk, et al.(2018) 回顾了24项孤立队列研究(共1,959217人年),发现高质量的饮食与较低的抑郁症状风险相关。此外,较低的膳食炎症指数与较低的抑郁症状发生率有关。其中,膳食炎症指数是近年来发展起来的一种用以描述个体饮食从最大抗炎水平到促炎水平的连续性指标,并与CRP、IL-6和TNF-a水平相关(Phillips, Shivappa, Hebert, & Perry, 2017). 类似的结果来自一项长期队列研究(SU.VI.MAX)。抗炎饮食有助于预防抑郁症状,特别是男性、吸烟者或不太做运动的个人(Adjibade, et al., 2017)。上述这些研究都为抑郁症的预防和维持提供了全面的饮食策略。
其他研究从不同的角度证明了饮食在抑郁症治疗中的重要性。Islam, et al.(2018) 分析了495例MDD患者血清,研究其中宏观矿物质和微量元素的水平。本病例对照研究结果显示,抑郁症患者血清钙、镁、铁、锰、硒、锌水平明显较低,但铜水平较高。可能有几个因素会导致这种现象。饮食摄入不足是最常见的一种。抗抑郁药物的使用会影响矿物质的吸收。肠漏综合征(LGS)患者也会因消化不良而影响微量元素的水平。麦麸敏感是LGS发病的常见原因之一,它是新近提出的一种可能介导抑郁症发病机制的途径假说。麦麸中的麸朊gliadin可能会导致连蛋白zonulin(一种调节肠道内分子流动的物质)的过度生产,从而破坏肠道屏障。这可能增强免疫反应,诱导促炎细胞因子的释放。慢性炎症进而影响脑肠轴,可能引起中枢神经系统炎症和抑郁(Karakuła-Juchnowicz, et al., 2017)。
其他研究也讨论了糖尿病的饮食。胰岛素抵抗是代谢综合征的共同特征,与炎症过程相互作用,控制能量消耗、葡萄糖稳态和摄食行为。虽然目前还没有针对抑郁症和胰岛素抵抗的直接研究,但动物研究表明,通过饮食使高血糖正常可以减少海马体炎症,而海马体炎症是抑郁症患者的主要脑区之一。此外,用抗糖尿病药物治疗高血糖小鼠也显示出改善认知功能障碍(Capuron, Lasselin, & Castanon, 2017)。
另外,有许多营养元素被证明对MDD治疗有辅助作用,包括维生素B、维生素D、铁、锌、SAMe、5-MTHF、5-HTP和omega-3脂肪酸。在本文中,我们将讨论锌和omega-3脂肪酸对抑郁症的影响。
锌
锌是人体第二丰富的微量元素(仅次于铁)。它是300多种酶的辅因子,对各种蛋白质的稳定起着至关重要的作用。它在免疫系统中具有重要的功能。锌有助于B细胞和T细胞在不同强度下的增殖以及Th1/Th2的平衡(Chasapis, Loutsidou, Spiliopoulou, & Stefanidou, 2012)。锌在行为、学习和心理功能中起着重要作用。锌的抗抑郁作用机制是复杂的,因为锌涉及多个生理过程。Szewczyk et al.(2009) 动物研究结果表明,锌在强迫游泳试验中的抗抑郁作用涉及血清素能神经传递,尤其是5HT1A和5HT2A/C受体。锌可降低神经发生损伤,调节炎症,改善单胺调节,平衡HPA轴(Sarris, et al., 2015)。
有证据表明,缺锌增强了动物模型的促炎状态。Doboszewska, et al.(2016)在其研究结果中描述,通过4周锌限制饮食后,小鼠的海马组织中炎性细胞因子(IL-1α)显著增加(p = 0.0438, t(11) = 2.277),而前额叶皮层组织中的IL-1β显著增加(p = 0.0389, t(12) = 2.318)。在强迫游泳测试中,观察到这些动物的静止时间增加、快感缺失和社交行为减少。但这项研究只对雄性老鼠进行了实验,这可能是它的局限性。此外,锌受体GPR39在缺锌的情况下表达会下调。Mlyniec et al.(2016) 研究了GPR39敲除的小鼠与小鼠抑郁样行为之间的关系,寻找与免疫功能障碍的联系。与对照组相比,敲除GPR39的小鼠表现出抑郁行为,如静止时间延长 [t(10) = 3.340; p = 0.0075]。同时, LPS刺激对IL-1β(p < 0.001)和IL - 6(p < 0.001)均有显著影响,Con A刺激对IL - 6水平(p < 0.001)也有显著影响。这些结果表明,GPR39锌受体可能参与抑郁样行为。另一项以小鼠产后抑郁为研究对象的动物研究发现,Zn、Mg、Vit B1的急性联合应用显著降低了小鼠的静止时间,提示其改善了抑郁症状和焦虑样行为。该实验中,50只动物平均分为5组,1组为黄体酮戒断组(PWD), 4组为治疗组(Zn + Mg, Zn + Vit B1, Mg+ Vit B1, Zn + Mg+ Vit B1)。PWD组静止时间最长(p<0.05),说明所有治疗均影响研究对象抑郁行为(Nikseresht, et al., 2012)。
虽然动物研究的证据表明缺锌可促进炎症,导致抑郁行为。在人体研究中,结果并不完全支持这一点。在一个包括71名孕妇的研究中,研究者分析了锌和CRP水平是否预示着产前抑郁。血清样本采集于妊娠晚期。锌和c反应蛋白之间有显著负相关性(r =−0.424,p < 0.001)。在三组研究中(非孕妇、孕妇无抑郁、孕妇有抑郁),抑郁女性锌水平显著较低(Roomruangwong, et al., 2017)。该研究结果似乎支持了锌与炎症有关的观点,即在抑郁的个体中锌的含量较低。然而,在另一项对抑郁症患者进行的单中心、随机、双盲、安慰剂对照的补锌试验中,锌组22例患者在服用选择性5 -羟色胺再摄取抑制剂抗抑郁药的同时口服硫酸锌(25毫克/天)12周,17例患者服用安慰剂。没有观察到血浆IL- 6 ,TNF-α和BDNF的水平显著差异(Ranjbar,et al .,2014)。锌似乎是通过其他机制来作为一种抗抑郁剂的。
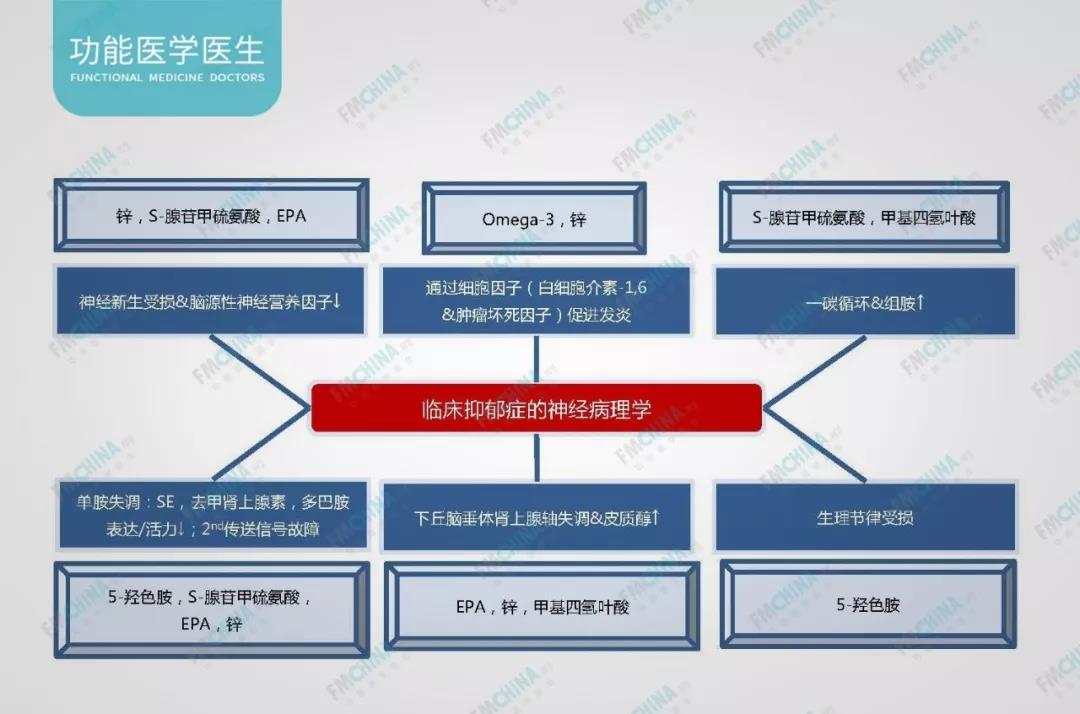
在下图中,我们可以看到锌在前文提到的单胺神经传递、下丘脑-垂体-肾上腺轴失衡导致高皮质醇水平、炎症、神经新生和可塑性退化等各种抑郁症可能的发病机制中均占有一席之地。作为功能医学医生,我们需要考虑得并不是简单的补锌=协助治疗抑郁症,而是对于单独的个体而言,其主要失衡归结在那个部分,锌是否可以从这个部分入手帮助改善患者症状。
Omega-3多不饱和脂肪酸
Omega-3多不饱和脂肪酸(Ω-3 PUFA) 是众所周知的抗炎营养因子。人体内有两种常见的PUFA。Omega-6(Ω-6) PUFA被证明为促炎脂肪酸,它来源于顺式-亚麻油酸(LA, 18:2),而Ω-3 PUFA来源于α-亚麻酸(ALA, 18:3)。这两种物质对维持所有细胞膜都很重要,而细胞膜是人类必不可少的生物组成部分(Su, 2015)。研究显示Ω-3 PUFA为转移色氨酸和血红细胞而保持细胞膜的完整性至关重要,直接与神经元膜功能相关(Prior, & Galduróz, 2012)。类似于抑郁症,许多慢性炎症疾病如神经、心血管、脑血管、自身免疫和代谢疾病均被报告存在低Ω-3 PUFA水平。通常我们研究两种类型的Ω-3 PUFA,二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)。
有些研究集中在孕期PUFA对抑郁症的影响。在动物研究中,Ω-3 PUFA干预措施被证明是诱发后代幼年时期和青少年的某些行为。在成年小鼠中,Ω- 3 PUFA补充饮食能显著增强认知,而Ω-3 PUFA缺乏饮食会破坏沟通能力、社会能力以及造成抑郁症样行为。此外,Ω-3 PUFA补充饮食使粪便呈现出丰富的双歧杆菌和乳酸菌(Robertson, et al., 2017)。在人类研究中,患有产前抑郁症的妇女血液样本中检测出DHA、EPA和总Ω- 3 PUFAs水平显著降低(Chang, et al., 2018)。在老年患者的随机对照试验荟萃分析(6研究包括4605例)中,有证据证明Ω-3 PUFA会影响抑郁症状。在抑郁症患者中,Ω-3 PUFA与安慰剂相比有较大的治疗效果。但这种影响只出现在轻度到中度抑郁症患者身上(Bae, & Kim, 2017)。此外,2016年有一项随机双盲对照研究探讨了DHA或EPA或两者对MDD高炎症个体的影响。结果表明DHA和EPA对MDD的影响可能不同。155名受试者参与了这项三臂研究。统计数据表明,EPA对高炎症个体(定义为IL-1、hsCRP、IL-6、脂联素或瘦素水平高)的疗效优于DHA和安慰剂。这些结果的可能解释是EPA可以减少花生四烯酸的产生,并可以转化为抗炎前列腺素和白三烯,这与DHA不同。这也可以解释其他研究Ω-3 PUFA对抑郁症作用的数据不一致的原因(Rapaport, et al., 2016)。
功能医学对于抑郁症抗炎治疗的诊疗思路
1. 辨别抑郁症和抑郁症状是决定精神科是否介入的重点。
目前中国通用的国际疾病分类ICD-10(World Health Organization, 2016) 中关于“抑郁发作”的标准有以下关键点:
[典型症状]:1.心境低落 2.兴趣和愉悦感丧失 3.精力不济或疲劳感
[常见症状]:1.注意力降低 2.自我评价降低 3. 自罪观念和无价值感 4.悲观 5.自伤或自杀观念/行为 6.睡眠障碍 7. 食欲下降
[严重程度]:1.轻度抑郁:至少两条典型症状+至少两条常见症状;2.中度抑郁:至少两条典型+至少三条常见症状;3.重度抑郁:至少三条典型症状+至少四条常见症状
[病程标准]:大于等于2周
严重的抑郁症需要“一些明显的、令人痛苦的症状,典型的是丧失自尊,认为自己没有价值或感到内疚。”自杀的想法和行为很常见,通常会出现一些“躯体”症状 (Zimmerman, Balling, Chelminski, & Dalrymple, 2018)。
在功能医学执业中,我们可以借助IFM的压力、焦虑和抑郁症状量表(DASS)作为初筛,再与患者沟通一些细节以确定是单纯的精神心理类问题,还是因能量系统失衡、沟通系统失衡或防御与修复系统失衡和而导致抑郁样表现。
2.饮食原则
无论哪种结果,只要是轻度或中度抑郁状态,抗炎症饮食方案都是基本处理原则之一。对于男性而言,抗炎症饮食方案可能让他们与女性相比收益更大。地中海饮食就是一个不错的选择。地中海饮食已被充分证明具有消炎作用。有足够的蔬菜、水果和谷物、足够的健康蛋白质(家禽和鱼类)、较少的红肉、橄榄油或足够的omega-3 PUFA,再加上一些天然的、有益精神健康的可有效吸收的营养素可能对抑郁有预防作用。限制加工食品、糖、精制谷物、红肉、omega-6脂肪酸,以及任何促炎食物的饮食都能减少炎症作用。尤其需要注意的是,抑郁症患者是否存在食物不耐受,尤其是麦麸不耐受。胃肠道系统的消化吸收功能,甚至肠道菌群的消化吸收功能,也应考虑在治疗方案中。
在抑郁症亚型中,非典型亚型患者具有良好的抗炎治疗效果。不过对于亚型的鉴别需要临床精神科医生的介入。对于超重或肥胖的抑郁症患者,低碳水化合物、高蛋白、抗炎的减肥饮食可能具有抗抑郁作用。同时,在首次发作缓解后,应尽快将抗炎饮食介绍给患者。
3.功能医学营养治疗原则
就我个人而言,我不建议所有的患者长期使用营养治疗,阶段性评估有助于确定疗效以及指导后续治疗。在初期治疗过程中,经慢性食物过敏检测、全套新陈代谢和肝脏解毒功能检测能获取大量的信息,也可以加做神经递质和肾上腺皮质醇节律检测。检测结果有助于我们更好判断使用哪些营养元素进行协助治疗。但最终目标是患者能自己建立健康的生活形态。
就上文提到的两种营养元素而言,在联合药物治疗时,保守建议锌补充剂为25mg /天,以提高治疗效果,在轻度抑郁时服用可能有效。而Ω-3 PUFA(特别是EPA)可以考虑作为补充剂,帮助孕妇预防后代承认后的情绪障碍发生率。老年患者只有轻度至中度的抑郁症可能受益于Ω-3 PUFA补充。另外需要提醒的是,除了饮食之外,睡眠和锻炼也对于抑郁症的预防和维护有重要作用。Lopresti, Hood, & Drummond(2013)总结了一些影响,包括睡眠对于神经新生、HPA轴和线粒体功能的作用,以及锻炼对于抗氧、神经递质功能、氧化应激、HPA轴、神经新生和线粒体功能的作用。
部分参考文献:
Adjibade, M., Andreeva, V. A., Lemogne, C., Touvier, M., Shivappa, N., H�bert, J.,R., . . . Kesse-Guyot, E.(2017). The inflammatory potential of the diet is associated with depressive symptoms in different subgroups of the general population. The Journal of Nutrition, 147(5), 879-887. 10.3945/jn.116.245167 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=28356432&site=ehost-live
Ambrósio, G., Kaufmann, F. N., Manosso, L., Platt, N., Ghisleni, G., Rodrigues, A. L. S., . . . Kaster, M. P.(2018). Depression and peripheral inflammatory profile of patients with obesity. Psychoneuroendocrinology, 91, 132-141. 10.1016/j.psyneuen.2018.03.005 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=edselp&AN=S0306453017312799&site=eds-live
Bae, J., & Kim, G.(2018). Review article: Systematic review and meta-analysis of omega-3-fatty acids in elderly patients with depression. Nutrition Research, 50, 1-9. 10.1016/j.nutres.2017.10.013 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=edselp&AN=S027153171730502X&site=eds-live
Bauer, M., Pfennig, A., Severus, E., Whybrow, P. C., Angst, J., & M�ller, H.(2013). World federation of societies of biological psychiatry(WFSBP) guidelines for biological treatment of unipolar depressive disorders, part 1: Update 2013 on the acute and continuation treatment of unipolar depressive disorders. The World Journal of Biological Psychiatry: The Official Journal of the World Federation of Societies of Biological Psychiatry, 14(5), 334-385. 10.3109/15622975.2013.804195 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=23879318&site=eds-live
Bauer, M., Severus, E., K�hler, S., Whybrow, P. C., Angst, J., & M�ller, H.(2015). World federation of societies of biological psychiatry(WFSBP) guidelines for biological treatment of unipolar depressive disorders. part 2: Maintenance treatment of major depressive disorder-update 2015. The World Journal of Biological Psychiatry: The Official Journal of the World Federation of Societies of Biological Psychiatry, 16(2), 76-95. 10.3109/15622975.2014.1001786 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=25677972&site=eds-live
Capuron, L., Lasselin, J., & Castanon, N.(2017). Role of adiposity-driven inflammation in depressive morbidity.Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, 42(1), 115-128. 10.1038/npp.2016.123 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=27402495&site=ehost-live
Chang, J. P., Lin, C., Lin, P., Shih, Y., Chiu, T., Ho, M., . . . Su, K.(2018). Polyunsaturated fatty acids and inflammatory markers in major depressive episodes during pregnancy. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 80, 273-278. 10.1016/j.pnpbp.2017.05.008 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=28536068&site=ehost-live
Chasapis, C. T., Loutsidou, A. C., Spiliopoulou, C. A., & Stefanidou, M. E.(2012). Zinc and human health: An update. Archives of Toxicology, 86(4), 521-534. 10.1007/s00204-011-0775-1 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=22071549&site=ehost-live
Cuijpers, P., Reynolds, C. F., Donker, T., Li, J., Andersson, G., & Beekman, A.(2012). Personalized treatment of adult depression: Medication, psychotherapy, or both? a systematic review. Depression & Anxiety(1091-4269), 29(10), 855-864. 10.1002/da.21985 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=pbh&AN=82070320&site=eds-live
da Silva Dias, I. C., Carabelli, B., Ishii, D. K., de Morais, H., de Carvalho, M. C., Rizzo de Souza, L. E., & ... Zanoveli, J. M.(2016). Indoleamine-2,3-Dioxygenase/Kynurenine Pathway as a Potential Pharmacological Target to Treat Depression Associated with Diabetes. Molecular Neurobiology, 53(10), 6997-7009. Retrieved from http://eds.a.ebscohost.com.uws.idm.oclc.org/eds/pdfviewer/pdfviewer?vid=1&sid=9b960a10-9e50-445f-9fd0-8a3ae982ab85%40sessionmgr4009
Dean, J., & Keshavan, M.(2017). Review article: The neurobiology of depression: An integrated view. Asian Journal of Psychiatry, 27, 101-111. 10.1016/j.ajp.2017.01.025 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=edselp&AN=S1876201816303197&site=eds-live
Doboszewska, U., Szewczyk, B., Sowa-Kucma, M., Noworyta-Sokolowska, K., Misztak, P., Golebiowska, J., . . . Nowak, G.(2016). Alterations of bio-elements, oxidative, and inflammatory status in the zinc deficiency model in rats. Neurotoxicity Research, 29(1), 143-154. 10.1007/s12640-015-9571-7 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=26581375&site=ehost-live
Fares-Frederickson N, & David M.(2018). Introduction to Immunity and Inflammation. Brunton LL, Hilal-Dandan R, Knollmann BC. eds. Goodman & Gilman's: The Pharmacological Basis of Therapeutics, 13e New York, NY: McGraw-Hill;
http://accessmedicine.mhmedical.com.uws.idm.oclc.org/content.aspx?bookid=2189§ionid=172479842. Accessed May 19, 2018.
Hickman, R. J., Khambaty, T., & Stewart, J. C.(2014). C-reactive protein is elevated in atypical but not nonatypical depression: Data from the national health and nutrition examination survey(NHANES) 1999-2004. Journal of Behavioral Medicine, 37(4), 621-629. 10.1007/s10865-013-9510-0 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=23624671&site=ehost-live
Islam, M. R., Islam, M. R., Shalahuddin Qusar, M M A, Islam, M. S., Kabir, M. H., Mustafizur Rahman, G K M, . . . Hasnat, A.(2018). Alterations of serum macro-minerals and trace elements are associated with major depressive disorder: A case-control study. BMC Psychiatry, 18(1), 94. 10.1186/s12888-018-1685-z Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=29631563&site=ehost-live
Jacka, F. N., O'Neil, A., Opie, R., Itsiopoulos, C., Cotton, S., Mohebbi, M., . . . Berk, M.(2017). A randomised controlled trial of dietary improvement for adults with major depression(the 'SMILES' trial). BMC Medicine, 15(1), 23. 10.1186/s12916-017-0791-y Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=28137247&site=ehost-live
Karakula-Juchnowicz, H., Szachta, P., Opolska, A., Morylowska-Topolska, J., Galecka, M., Juchnowicz, D., . . . Lasik, Z.(2017). The role of IgG hypersensitivity in the pathogenesis and therapy of depressive disorders. Nutritional Neuroscience, 20(2), 110-118. 10.1179/1476830514Y.0000000158 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=25268936&site=ehost-live
Kessler, & Bromet.(2013).The epidemiology of depression across cultures. Annual Review of Public Health, , 119. Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=edsgao&AN=edsgcl.323046716&site=eds-live
Köhler, C.,A., Freitas, T. H., Stubbs, B., Maes, M., Solmi, M., Veronese, N., . . . Carvalho, A. F.(2018). Peripheral alterations in cytokine and chemokine levels after antidepressant drug treatment for major depressive disorder: Systematic review and meta-analysis. Molecular Neurobiology, 55(5), 4195-4206. 10.1007/s12035-017-0632-1 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=28612257&site=ehost-live
Kollia, N., Panagiotakos, D., Georgousopoulou, E., Chrysohoou, C., Yannakoulia, M., Stefanadis, C., . . . Pitsavos, C.(2017). Exploring the path between depression, anxiety and 10-year cardiovascular disease incidence, among apparently healthy greek middle-aged adults: The ATTICA study. Maturitas, 106, 73-79. 10.1016/j.maturitas.2017.09.005 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=29150168&site=ehost-live
Lindqvist, D., Dhabhar, F. S., James, S. J., Hough, C. M., Jain, F. A., Bersani, F. S., . . . Mellon, S. H.(2017). Oxidative stress, inflammation and treatment response in major depression//doi-org.uws.idm.oclc.org/10.1016/j.psyneuen.2016.11.031 Retrieved from http://www.sciencedirect.com.uws.idm.oclc.org/science/article/pii/S0306453016306862
Lopresti, A. L., Hood, S. D., & Drummond, P. D.(2013). A review of lifestyle factors that contribute to important pathways associated with major depression: Diet, sleep and exercise. Journal of Affective Disorders, 148(1), 12-27. 10.1016/j.jad.2013.01.014 Retrieved from https://uws.idm.oclc.org/login?url=http://search.ebscohost.com.uws.idm.oclc.org/login.aspx?direct=true&db=mdc&AN=23415826&site=ehost-live