四代靶向药劲爆亮相ESMO,克服奥希替尼耐药办法多多!
肺癌是我国第一大恶性肿瘤,其中80%是非小细胞肺癌。由于我国肺癌患者存在较高的EGFR基因突变概率,因此我国肺癌病人受益于EGFR的靶向药物。从第一代EGFR靶向药吉非替尼、厄洛替尼;第二代靶向药物阿法替尼、达克替尼;第三代靶向药物奥希替尼。这些靶向药物让EGFR基因突变的肺癌患者持续受益。
EGFR靶向治疗出现耐药是躲不掉的难题,尤其是三代药奥希替尼(泰瑞沙,AZD9291)耐药十分棘手,第四代靶向药成为广大肺癌病友关注的热点。今天癌度给大家报道ESMO大会公布的两个第四代靶向药物的数据。
一、U3-1402数据更新,70%的疾病控制率成希望之药
早在2019年美国临床肿瘤学会(ASCO 2019)上,代号为U3-1402的新药横空出世,公布的初步数据表明它竟然能全面对抗各种类型的EGFR-TKI治疗耐药,连奥希替尼耐药也有希望解决(链接:ASCO快递丨新药控制率100%,奥西替尼耐药患者有救了!)。在2019年世界肺癌大会(WCLC)上,该药的更新数据出炉,控制率高达100%(链接:奥希替尼耐药后控制率高达100%的救命药U3-1402又有新进展了!)。今年的ESMO大会再次报道了U3-1402的最新数据。
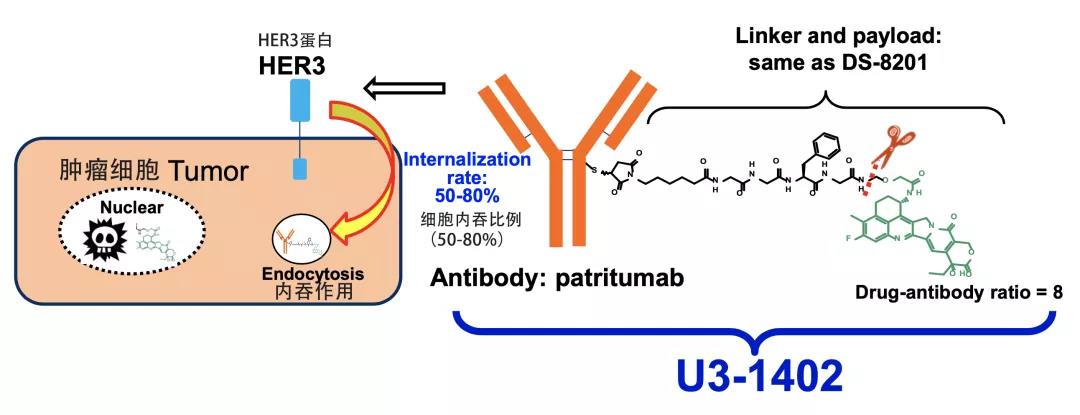
U3-1402是日本第一三共制药公司研发的Her3抗体偶联体药物,主要的治疗机理是通过U3-1402与Her3蛋白结合,然后将携带的治疗性药物送入肿瘤细胞内,以杀死肿瘤细胞。
本次ESMO公布的是U3-1402的II期研究更新数据。入组的患者为EGFR基因突变的非小细胞肺癌患者,且之前使用靶向药物和化疗后耐药,平均使用过4次治疗方案,90%的病人使用过化疗,平均使用过2种EGFR靶向药物,其中86%的患者之前用过奥希替尼。接近一半的病人曾经有过脑转移病灶。
入组的57名患者以每公斤体重5.6毫克的药物剂量用药,截止数据汇总时仍有28名患者继续治疗。中位治疗时间3.5个月,中位的随访时间为5.4个月。最为常见的3级以上的不良反应是血小板降低,中性粒细胞数降低。
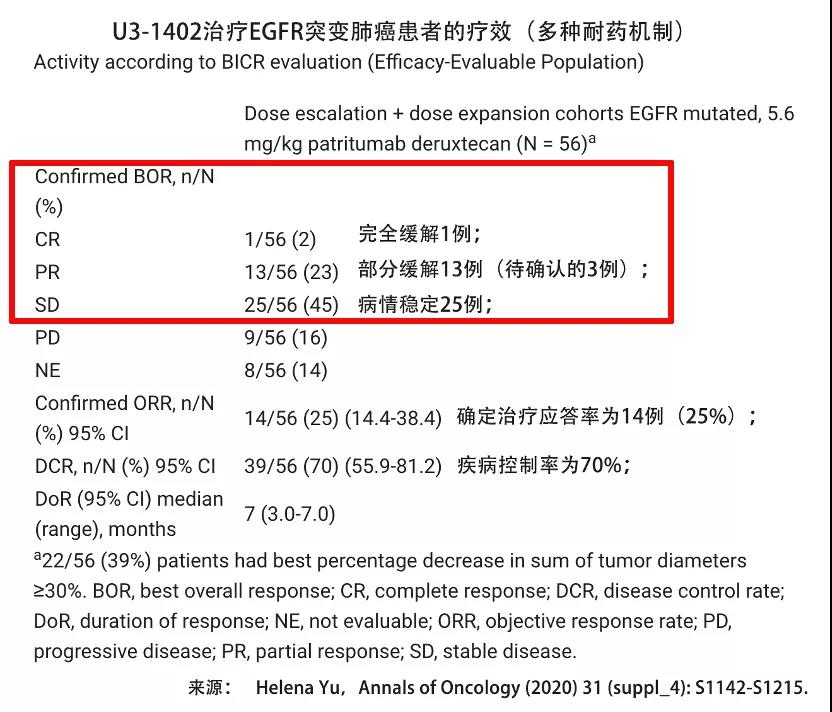
如上图所示,有1名患者可见病灶完全消失,13名患者肿瘤病灶缩小超过30%,达到了部分缓解。总体治疗应答率为25%,疾病控制率达70%。这对于平均经过了4线以上治疗后耐药的患者而言是非常难能可贵的。除了疗效优异,安全性也可控。由于HER3蛋白在部分肿瘤细胞中过表达,可与EGFR形成二聚体,参与肿瘤发展。因此U3-1402这款药物可以解决多种耐药机制,包含EGFR基因的C797S突变、MET基因扩增、HER2蛋白突变、BRAF基因和PIK3CA基因突变所导致的耐药,最重要的是也不需要管什么基因突变导致的耐药,U3-1402都可能起作用。如果这款药物成功获批上市,也真将会是广大EGFR突变患者的希望药。通过这种药物的缓冲,患者有可能再次启用之前耐药的治疗措施,有望实现更长的生存时间的延长。
二、初露峥嵘,BLU-945值得期待
EGFR突变的肺癌患者经常在最后遭遇“三联突变”,也就是EGFR敏感突变/T790M/C797S,如果是T790M和C797S在同一条染色体上,这是一种顺势构型的耐药突变,目前的治疗措施有限。本次ESMO年会上报道了一款代号为“BLU-945”的四代药物。
其体外细胞学实验显示出了亮眼的抑制效率。
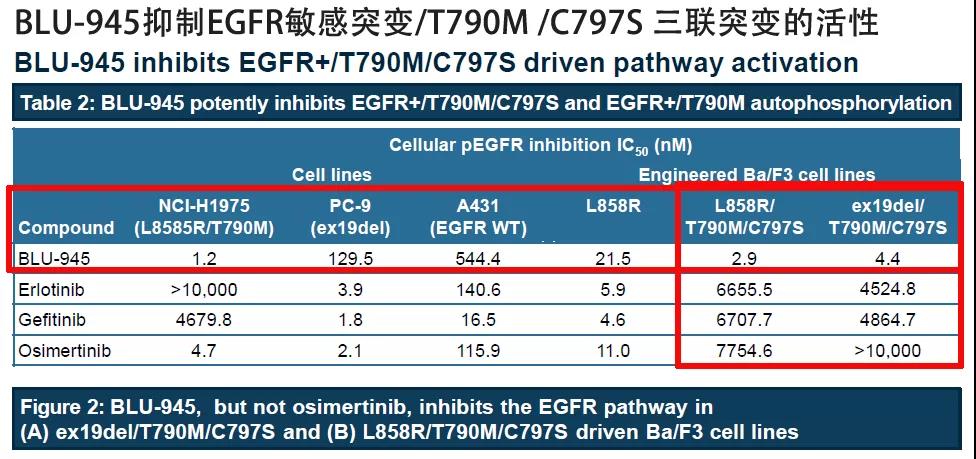
上图是不同化合物对携带不同突变的EGFR基因的抑制活性,IC50数值越小说明抑制效果越好。我们可以看出,对于携带没有发生突变的EGFR基因的细胞,BLU-945的IC50数值为544.4,是远大于特罗凯、易瑞沙和泰瑞沙的,这可能意味着BLU-945的不良反应概率要低或轻。但是对于携带L858R/T790M突变的癌细胞,BLU-945的IC50数值为1.2,低于其他三款靶向药物,甚至低于针对T790M开发的第三代靶向药物泰瑞沙( IC50 4.7)。
下面我们再看重点部分,如果是三联突变,也就是上图最右侧的标红部分。不管EGFR基因的敏感突变是什么,只要是三联突变的癌细胞。BLU-945的IC50数值仅有2.9和4.4,而其他三款靶向药物的IC50数值是4000多以上。这是上千倍的差异,所以对于三联突变的耐药目前的靶向药物是没有办法的。
本次大会上,研究者报道了使用BLU-945治疗携带三联突变的小鼠模型。证实了BLU-945的治疗效果以及较好的安全性。相信该药很快将开展人体试验。而这正是广大肺癌患者所期待的。
本次欧洲肿瘤学年会,我们惊喜地发现EGFR靶向治疗的曙光。更为难得的是BLU-945和U3-1402是抗肿瘤机制是完全不同的,这也意味着很多患者或可能从这两种药物都获得益处,也许一种耐药后还可以使用另外一种。所以期待它们尽快获批上市,很多耐药的病人等着呢。
参考文献
1. Helena Yu Annals of Oncology(2020) 31(suppl_4): S1142-S1215.
2. Stefanie Schalm Annals of Oncology(2020) 31(suppl_4): S754-S840.