非小细胞肺癌 一线免疫治疗新进展盘点
欧洲肿瘤内科学会(ESMO)年会将于2020年9月19日至21日以线上会议的形式召开。ESMO首先公布了“壁报展示”摘要内容,一起来看下非小细胞肺癌(NSCLC)一线免疫治疗有哪些最新研究进展吧!
CheckMate 227亚洲亚组数据更新:双免疫联合治疗使死亡风险降低24%
背景和方法
CheckMate 227第1部分结果显示,与单独化疗相比,纳武利尤单抗+伊匹木单抗可显著改善晚期NSCLC患者的总生存期(OS)。本次ESMO大会上, CheckMate 227研究公布亚洲亚组研究数据。
研究纳入IV期/复发性NSCLC、ECOG PS为0-1、敏感EGFR突变/ALK突变阴性、之前未接受过全身治疗的患者。PD-L1≥1%患者按1:1:1比例随机分配接受纳武利尤单抗(3mg/kg Q2W)+伊匹木单抗(1mg/kg Q6W)或纳武利尤单抗(240 mg Q2W)或化疗。PD-L1<1%的患者按1:1:1随机分配至纳武利尤单抗+伊匹木单抗或纳武利尤单抗(360mg Q3W)+化疗或化疗。亚洲人群包括来自日本、韩国和台湾患者。
主要结果
分别有121例、124例亚洲患者被随机至双免疫联合治疗组和化疗组。中位随访时间至少29.7个月时,在PD-L1≥1%亚组中,与化疗相比,双免疫联合治疗使患者死亡风险降低24%(OS HR=0.76)。双免疫联合组和化疗组的中位无进展生存期(PFS)分别为11.0个月和6.7个月(HR=0.64),两组的客观缓解率(ORR)分别为54%和37%,两组的中位缓解持续时间(DoR)分别为26.1个月和6.9个月。在所有随机分组的亚洲患者中(PD-L1≥1%和<1%),与化疗相比,双免疫治疗疗效均改善(表)。双免疫联合治疗和化疗组分别观察到40%和36%的患者发生3-4级治疗相关不良事件,两组中任何等级治疗相关不良事件(TRAE)导致停药率分别22%和13%。

结论
与CheckMate 227全球人群结果一致,双免疫联合治疗对比化疗在亚组患者中的疗效更优。
CheckMate-9LA亚洲亚组:双免疫联合治疗+短程化疗使死亡风险降低67%!
背景和方法
CheckMate-9LA是一项开放标签、多中心、随机III期研究,旨在评估与单独化疗(最多4个周期)相比,纳武利尤单抗+伊匹木单抗+2周期化疗一线治疗转移性非小细胞肺癌(NSCLC)患者的疗效。今年ASCO大会上公布的结果显示,纳武利尤单抗+伊匹木单抗+2周期化疗可显著改善OS。本次ESMO大会公布亚洲患者研究数据。
研究纳入组织学确认的IV期/复发性NSCLC,ECOG PS为0-1且敏感EGFR/ALK突变阴性患者,按1:1比例随机分配接受纳武利尤单抗(360 mg Q3W)+伊匹木单抗(1 mg/kg Q6W)+2周期化疗或4周期化疗。分层因素包括PD-L1表达(<1% vs ≥1%)等。主要终点是OS。亚洲亚组包括来自中国和日本的患者。
主要结果
研究共纳入58例亚洲患者,免疫联合治疗组和化疗组分别有28例和30例。截至2020年3月9日,随访时间至少12.7个月时,联合组和化疗组分别有57.1%和66.7%的患者后续分别接受了化疗和免疫治疗,两组的中位OS分别为未达到和13.3个月(HR=0.33)、中位PFS分别为8.4个月和5.4个月(HR=0.47)。安全性方面,联合组和化疗组的3-4级治疗相关不良事件发生率分别为57.1%和60.0%,分别有21.4%和16.7%患者因任何级别TRAE导致治疗中止。

小结
虽然化疗组后续有更多患者接受了免疫治疗,但结果仍显示,与单独化疗相比,纳武利尤单抗+伊匹木单抗+短程化疗在亚洲人群中更有效。
JASPER研究:尼拉帕利+帕博利珠单抗在PD-L1 TPS≥50%患者中的ORR达56.3%!
方法
JASPER研究是一项开放标签、多队列的Ⅱ期研究,旨在评估尼拉帕利联合PD-1单抗一线治疗晚期NSCLC的疗效和安全性。研究纳入未经化疗的局部晚期/转移性NSCLC患者,EGFR敏感突变/ALK/ROS1重排阴性。既往未接受PD-(L)1治疗的患者进行分层PD-L1 TPS分层:≥50%(1队列),1%–49%(2队列)。患者每3周静脉注射帕博利珠单抗200 mg,每天口服尼拉帕利200 mg。主要终点是研究者评估的ORR。次要终点为DoR,PFS和安全性。
主要结果
1队列和2队列分别纳入17例和21例患者,最终意向治疗人群中,1队列和2队列分别有16例和20例患者。1队列确认的ORR为56.3%,其中2例完全缓解。2队列确认的ORR为20%。1队列和2队列的中位DoR分别为19.7个月和9.4个月,两队列的中位PFS分别为8.4个月和4.2个月。
结论
尼拉帕利+帕博利珠单抗可在晚期NSCLC患者中产生持久的应答,尤其在PD-L1高表达人群中疗效更明显,且该联合方案未出现新的安全性事件。
RATIONALE 304研究重磅公布:替雷利珠单抗+化疗在非鳞状NSCLC的疗效和安全性结果
背景和方法
替雷利珠单抗在非鳞状NSCLC患者中显示出抗肿瘤活性,RATIONALE 304研究是由上海交通大学附属胸科医院陆舜教授牵头的一项多中心、开放标签、随机对照III期研究,旨在评估替雷利珠单抗+培美曲塞+卡铂/顺铂对比化疗用于局部晚期或转移性非鳞状NSCLC一线治疗的疗效和安全性。
入组患者按2:1比例随机分配接受替雷利珠单抗(200mg)+铂类(卡铂AUC 5或顺铂75 mg/m2)+培美曲塞500 mg/m2,序贯替雷利珠单抗+培美曲塞(A组),或接受铂类+培美曲塞,序贯培美曲塞维持治疗(B组)。主要终点为孤立评审委员会(IRC)评估的PFS,次要终点包括OS、ORR、DOR和安全性等。
主要结果
截至2020年1月23日,A组和B组分别纳入223例和111例患者,中位随访时间9.8个月时,A组的中位PFS明显优于B组,两组分别为9.7个月和7.6个月(HR=0.645,P=0.0044),两组的ORR分别为57% 和37%,中位DoR分别为8.5个月和6.0个月。安全性方面,A组有221例(99.5%)患者有治疗相关不良事件,其中83%与替雷利珠单抗相关。B组中有107例(97%)患者产生了1级及以上治疗相关不良事件,其中46%患者为3级及以上。
结论
替雷利珠单抗+化疗在非鳞状NSCLC患者中耐受性良好,且显示出较好的抗肿瘤活性。
RATIONALE 307研究更新:无论PD-L1表达和bTMB状态如何,替雷利珠单抗+化疗均能明显改善PFS
方法
本次ESMO大会公布了RATIONALE 307研究的更新结果。RATIONALE 307研究是由中国医学科学院肿瘤医院王洁教授牵头的一项多中心、开放标签、随机对照III期临床试验,旨在评估替雷利珠单抗+紫杉醇/白蛋白紫杉醇+卡铂对比紫杉醇+卡铂一线治疗局部晚期或转移性鳞状NSCLC的疗效和安全性。研究纳入360例鳞状NSCLC患者,按1:1:1比例接受替雷利珠单抗200 mg(D1)+紫杉醇175 mg/m2(D1)+卡铂AUC 5(D1)(A组),或替雷利珠单抗+白蛋白紫杉醇100 mg/m2(D1、8和15)+卡铂(B组),或紫杉醇+卡铂(C组)。分层因素包括PD-L1表达(<1% vs 1-49% vs ≥50%)。主要终点是IRC评估的PFS,次要终点包括ORR、DoR,OS和安全性/耐受性。并探讨了血液肿瘤突变负荷(bTMB)与疗效的相关性。
主要结果
更新结果显示,与C组相比,A组或B组的PFS、ORR、DOR明显更优(见表)。PD-L1表达与PFS或ORR无相关性。以bTMB 6mut/Mb为cut-off值,联合治疗可改善高bTMB(HR=0.31)水平和低bTMB(HR=0.66)水平人群的PFS,各组中位OS均未达到。三组中分别有12.5%、29.7%和15.4%患者因不良事件导致停止治疗。
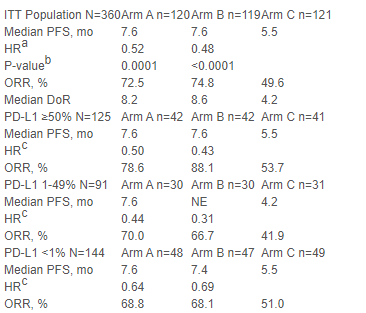
结论
更新数据显示,不论PD-L1表达和bTMB状态如何,一线替雷利珠单抗联合化疗对比化疗可为局部晚期或转移性鳞状NSCLC带来明显PFS获益。
参考文献:
1.1274P - First-line(1L) nivolumab(NIVO) plus ipilimumab(IPI) in Asian patients(pts) with advanced non-small cell lung cancer (aNSCLC) in CheckMate 227
2.1268P - JASPER: Efficacy and safety of first-line(1L) niraparib plus a programmed death receptor 1 inhibitor(PD-1i) in patients with advanced non-small cell lung cancer (NSCLC)
3.1264P - Updated analysis of tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment of advanced squamous non-small cell lung cancer (SQ NSCLC)
4.1311P - First-line(1L) nivolumab(NIVO) + ipilimumab(IPI) + chemotherapy(chemo) in Asian patients(pts) with advanced non-small cell lung cancer (NSCLC) from CheckMate 9LA
5. 1263P - Tislelizumab + chemotherapy vs chemotherapy alone as first-line treatment for locally advanced/metastatic nonsquamous NSCLC