简红教授 全面解读NSCLC精准靶向治疗的新靶点—RET融合
导读
随着分子靶向治疗研究的不断进展,越来越多的靶点逐渐被发现,针对于不同靶点的靶向治疗药物将非小细胞肺癌(NSCLC)的治疗带入了一个更精准的时代。在NSCLC诸多驱动基因中,转染重排基因(RET)已经被证实与多种恶性肿瘤的发生发展具有相关性,引起了肿瘤专家和学者的广泛关注。为此,医脉通特邀上海交通大学附属胸科医院简红教授,就RET基因的生物学特性及其在恶性肿瘤中的表达情况、RET变异NSCLC患者的临床特征及治疗现状等进行详细的讲解。
专家简介

医脉通:近年来,基因分型的深入研究使NSCLC的治疗发生了日新月异的变化。能否请您谈谈靶向治疗在当前NSCLC治疗中的地位?
简红教授: 自2004年表皮生长因子受体(EGFR)基因突变被发现以来,多项临床研究已经证实了酪氨酸激酶抑制剂(TKI)靶向治疗在EGFR基因突变型NSCLC治疗领域的主流地位。其中2009年公布的IPASS研究最先拉开了肺癌分子靶向治疗的序幕1,后续随着研究者对NSCLC发生发展机制探索的不断深入,ALK、ROS1等驱动突变陆续被发现,相关的抑制剂也不断获批上市,使得 NSCLC的靶向治疗越来越精准。
此外,其他少见基因突变类型,如RET基因融合、BRAF基因突变及NTRK基因融合等也相继被发现,使得这类患者的个体化治疗也越来越受到临床医师和研究者的关注。然而,目前这些少见突变仍缺乏获批的靶向药物,虽然近年来不断有针对性的靶向药物在NSCLC患者中表现出一定的临床获益,但其疗效和安全性仍需密切观察,还有待更多的临床试验进一步进行验证。
医脉通:在NSCLC的诸多驱动基因中,RET基因已经被证实与多种恶性肿瘤的发生发展具有相关性。能否请您介绍一下RET基因的生物学特性及其在恶性肿瘤中的表达情况?
简红教授: RET基因最早于1985年由Takahashi等在转化培养的小鼠NIH3T3细胞中发现,其编码产生的 RET 蛋白是正常发育过程中所需的一种受体酪氨酸激酶(RTK)。
与其他酪氨酸激酶不同的是,RET的激活除了需要配体胶质细胞神经营养因子(GDNF)外,还需要GDNF家族受体参与2*。RET基因在胚胎发育,特别是肠道神经系统发育过程中起关键作用3。RET失活会导致胚胎发育过程中多个器官的发育异常,包括泌尿生殖系统、胃肠道、呼吸系统和和造血系统4。
RET基因在成人的不同组织中也保持着高水平的表达,但它们的生理作用目前尚不清楚3。临床前研究显示,在成年动物中,RET缺失造成的影响通常是轻微的,或症状不严重的,这意味着选择性RET抑制剂可能在大龄儿童或成年患者中具有良好的安全性4。在肺癌方面,有研究表明正常肺组织中,RET 基因的表达率极低;而肺癌患者肿瘤组织中,RET 基因发生了融合突变,表达率明显增高5。
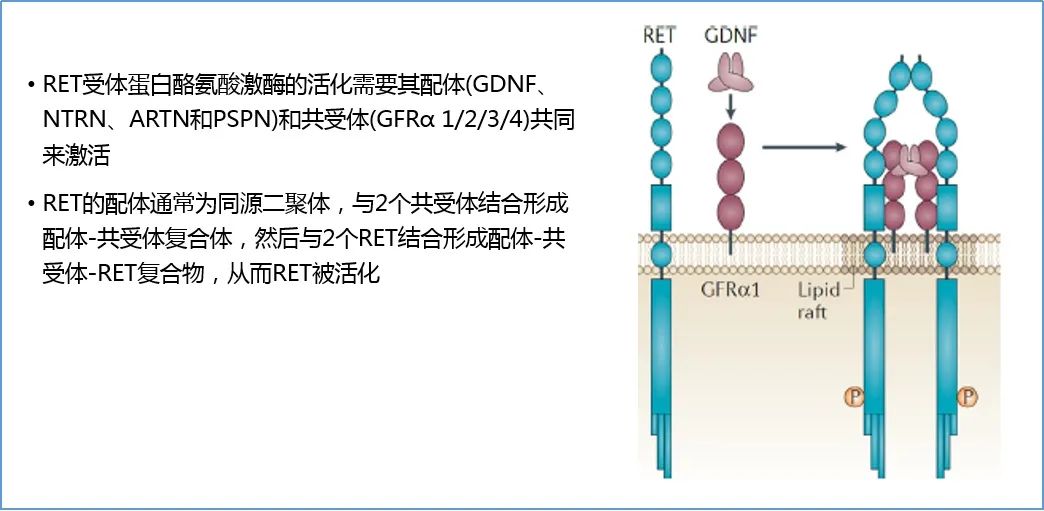
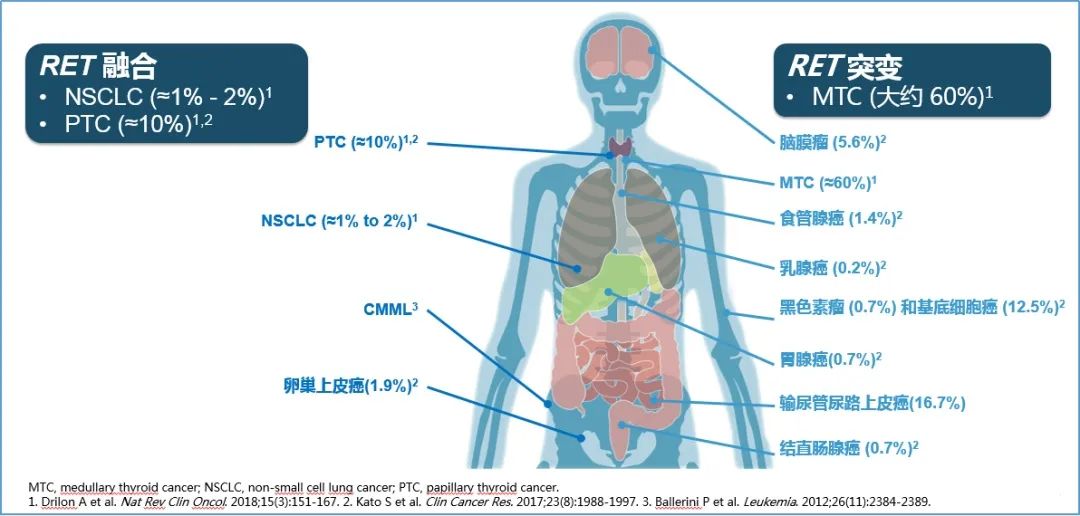
此外,RET基因发生点突变和融合突变会促使激酶活化,诱发肿瘤生成4。2012年,研究者首次在肺腺癌组织中发现RET基因融合突变6,此后随着对RET基因研究的不断深入,在许多种癌症中均发现存在致癌性的RET改变。其中RET基因融合在NSCLC患者中的发生率约为1~2%4,在甲状腺乳头状癌(PTC)中的发生率为10%7。甲状腺髓样癌(MTC)中RET基因突变的发生率约为60%4,其他发生RET变异的瘤种包括脑膜瘤、食管腺癌、乳腺癌、结直肠癌等。因此,RET基因变异已成为继NTRK“不限癌种”疗法的又一个重要靶点。
医脉通:我国的肺癌患病群体基数较大,因而RET变异的NSCLC患者在临床中应该并不少见。能否请您介绍一下RET变异NSCLC患者的临床特征?
简红教授: 2015年国家癌症中心发布的数据显示,我国每年新发肺癌患者78.7万例8。一项纳入6125例通过新一代测序技术(NGS)检测的中国肺癌患者的回顾性数据显示,中国肺癌人群RET融合的发生率为1.4%9,据此估算中国每年新发RET阳性肺癌患者约1.1万。因此,人们也越来越关注RET变异NSCLC 患者的临床特点。
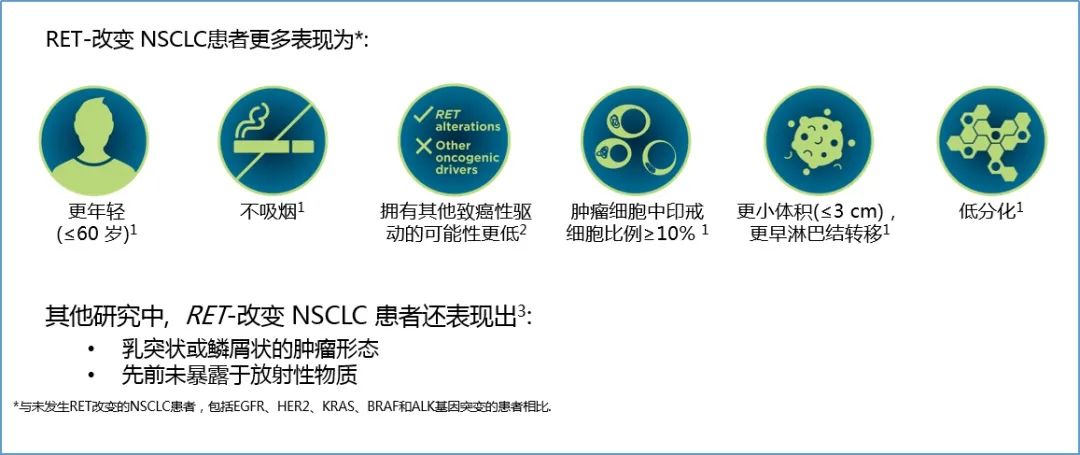
相关临床研究显示4,10,与未发生RET变异的NSCLC患者相比,RET变异NSCLC患者更多表现为:①更年轻(≤60 岁);②不吸烟;③拥有其他致癌性驱动的可能性更低;④RET融合肺腺癌中印戒细胞更常见(≥10);⑤更小体积(≤3 cm),更早淋巴结转移;⑥低分化。此外,绝大多数的RET融合NSCLC患者在确诊时已处于晚期(III/IV期)11-13,且这类患者容易发生脑转移13,预后较差。
医脉通:RET融合NSCLC患者的治疗现状如何?您对此有何期望?
简红教授:目前尚无针对RET基因融合的特异性治疗药物,凡德他尼、卡博替尼等多靶点TKI治疗RET融合型NSCLC的疗效一般。部分回顾性或亚组数据分析显示14-15,免疫检查点抑制剂在RET融合NSCLC中的获益同样有限,总缓解率(ORR)约6.3%-37.5%,中位无进展生存期(PFS)约2.1-7.6个月,临床亟需精准的RET靶点治疗药物。
近年来不断有针对RET融合的靶向药物在NSCLC患者中进行有效性和安全性的研究。其中普拉替尼(Pralsetinib)是一种强效、高选择性的靶向致癌性RET变异的小分子激酶抑制剂。2020年9月4日,美国FDA已批准普拉替尼上市,用于治疗RET融合阳性的转移性非小细胞肺癌成人患者。本届ASCO年会上公布了普拉替尼在RET融合NSCLC中的最新临床数据16,ORR高达65%,初治及经含铂化疗进展的患者ORR分别为73%和61%,且耐受性良好。这项研究结果表明普拉替尼是一种有高度潜力的选择性RET抑制剂,在RET基因融合阳性NSCLC中有非常好的治疗前景。
据悉,基石药业已与Blueprint Medicines达成独家合作和授权协议,获得了包括普拉替尼在内的多款药物在大中华区的独家开发和商业化授权,正在全力推进普拉替尼在我国的临床研发。2019年12月,中国的临床研究中心已完成经含铂化疗的RET融合NSCLC患者队列入组,初步结果显示,普拉替尼治疗中国人群的疗效及安全性与全球的研究结果相似。2020年9月7日,基石药业宣布,中国国家药品监督管理局(NMPA)已受理普拉替尼胶囊新药上市申请并纳入优先审评,用于治疗经含铂化疗的RET融合阳性的非小细胞肺癌(NSCLC)患者。希望普拉替尼能尽快获批,使更多中国患者获益。
*其他酪氨酸激酶与其家族形成同源或异原二聚体发挥作用,RET与神经营养因子受体(GDNF&α;)形成二聚体发挥功能。
参考文献
1. Tony S Mok, et al. N Engl J Med. 2009 Sep 3;361(10):947-57.
2. Roskoski R Jr, et al. Pharmacol Res. 2018 Feb;128:1-17
3. Rusmini M et al. J Cell Physiol. 2014 Dec;229(12):2027-2037
4. Drilon A et al. Nat Rev Clin Oncol. 2018;15(3):151-167.
5. 杨科, et al.癌症进展.2019;17(23):2749-2770.
6. Herbst RS, et al. Nature. 2018 Jan 24;553(7689):446-454.
7. Kato S et al. Clin Cancer Res. 2017;23(8):1988-1997.
8. 郑荣寿, et al. 中华肿瘤杂志. 2019,41(1) : 19-28.
9. K Zhang et al. Oncol Res. 2019;27(5):575-582.
10. Wang R et al. J Clin Oncol. 2012;30(35):4352-4359.
11. Oliver Gautschi, et al. J Clin Oncol. 2017 May 1; 35(13): 1403–1410.
12. Chang Lu, et al. J Hematol Oncol. 2020 Apr 15;13(1):37.
13. Lee J, et al. Jpn J Clin Oncol. 2020 Feb 21
14. Guisier F, et al. J Thorac Oncol. 2020 Apr;15(4):628-636.
15. Mazieres J, et al. Ann Oncol. 2019 Aug 1;30(8):1321-1328
16. Gainor JF,et al.2020ASCO.Poster 9515.