BRAF突变与PD-1单抗 佳偶良缘?
在几个月前的ASCO大会上,黑色素瘤三联方案的高效组合达拉非尼(D)+曲美替尼(T)+Spartalizumab在BRAF V600突变阳性的不可切除或转移性黑色素瘤患者的一线治疗中,ORR高达78%,CR率更是达到更人惊叹的44%,在我们对COMBI-iⅢ期临床研究结果充满期待之时,今天从ESMO大会上传来了其阴性结果的消息。阴性结果的原因是什么?这样的结果对临床的启示是什么?本期特邀北京大学肿瘤医院斯璐教授为您一一解答。

理论基础
在过去的几年中,黑色素瘤在靶向治疗与免疫治疗的不断进展,对临床实践产生了深刻的影响。靶向治疗起效迅速、缓解率高,但通常面临耐药的问题;免疫治疗应答持久,生存获益显著,但起效慢、有效率相对低。于是我们设想,当靶向联合免疫,是否能够取长补短、集二者的优势于一体,为黑色素瘤的治疗带来新的变革?
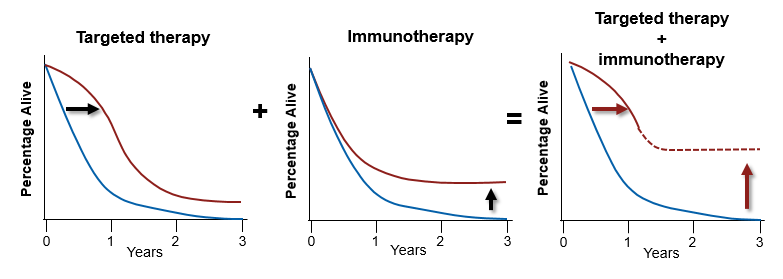
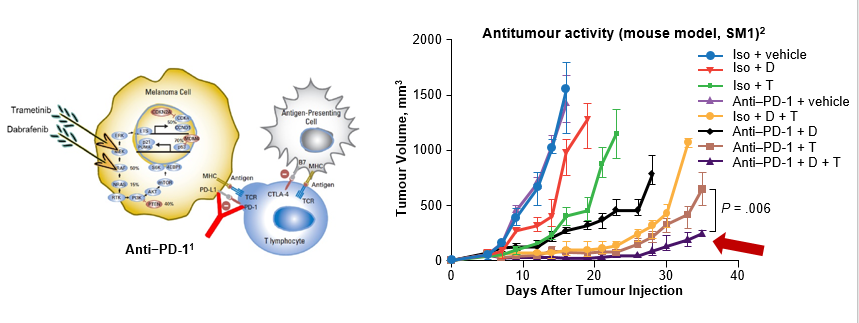
众多临床前研究都为这一设想提供了坚实的理论基础,数据显示,靶向联合疗法通过对MAPK通路的抑制,从多个方面增强免疫检查点抑制剂的抗肿瘤活性:降低免疫抑制细胞因子的水平;提高黑色素瘤细胞表面分化抗原的表达;降低Tregs细胞的水平,限制抗肿瘤免疫,增加免疫逃逸;提高肿瘤细胞表面PD-L1表达水平;增加肿瘤识别和T细胞毒性等。在BRAF V600E突变的黑色素瘤小鼠模型中,我们也看到双靶联合抗PD-1治疗的抗肿瘤活性优于三种药物中任意单药或者任意两种药物的联合。
临床验证
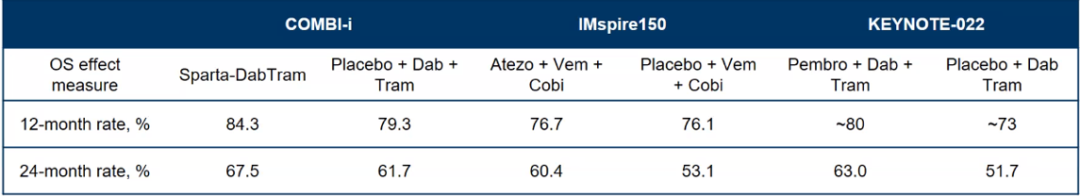
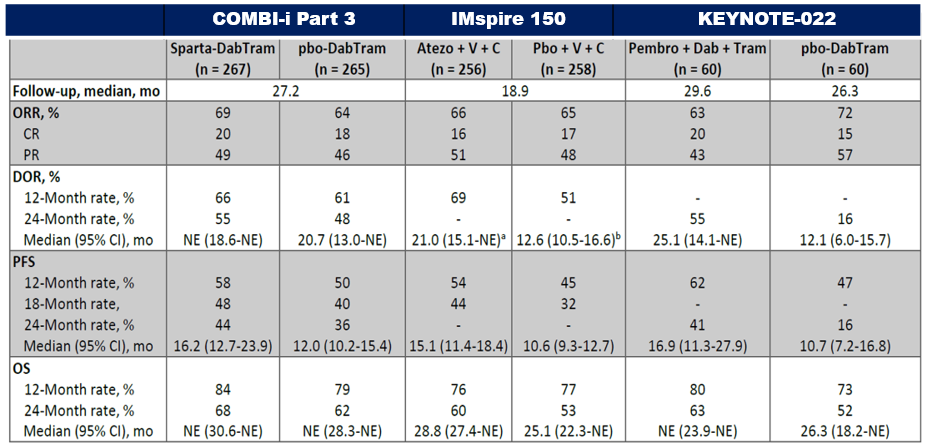
KEYNOTE-022研究(2018年ASCO公布)和IMspire-150研究(2020年AACR公布),前者是Ⅱ期研究(N = 120),主要终点研究者评估的PFS,D+T+帕博利珠单抗对比D+T+安慰剂为16.0 vs 10.3个月(HR 0.66,P = 0.043),虽然三联组显示出了更优的获益,但因未达到研究预设的终点(HR≤ 0.62, P ≤ 0.025),故为阴性结果。今年公布的IMspire-150Ⅲ期研究(N = 514)结果显示V+C+阿替利珠单抗对比V+C研究者评估的PFS为15.1 vs 10.6个月(P = 0.0249),达到其预设的主要终点。
随后备受瞩目的三联研究为COMBI-i,与D+T双靶联合的是诺华公司自主研发的PD-1单抗Spartalizumab。研究共分为三个部分,Part 1(N = 9)和Part 2(N = 27)是安全性和生物标志物队列,Part 3是Ⅲ期临床研究(N = 532)。今年ASCO公布的COMBI-i Part 1& Part 2结果显示,D + T + Spartalizumab研究者评估的ORR为78%,CR率达44%,中位PFS 22.7个月。
2020 ESMO公布的COMBI-i Ⅲ期研究结果
研究设计
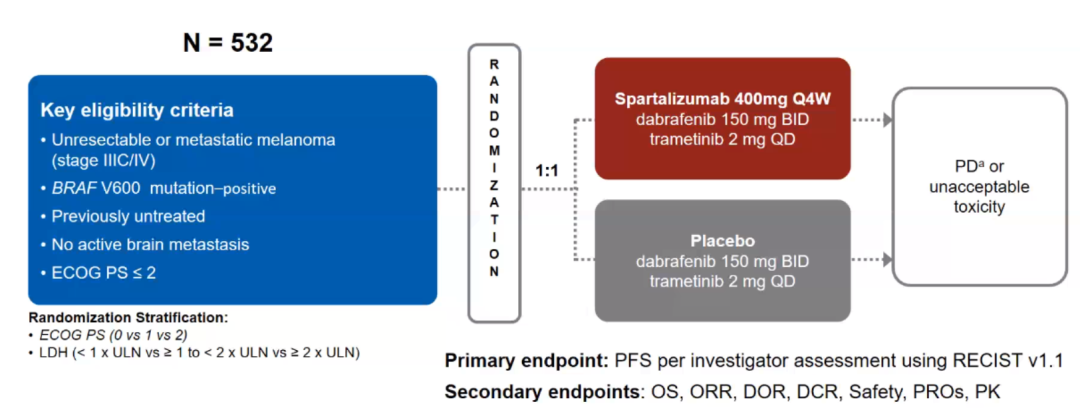
本届ESMO公布的COMBI-i Part 3是一项随机、双盲、对照的多中心Ⅲ期研究,纳入未经治疗的BRAF V600突变患者532例,1:1随机分配至D+T+Spartalizumab三联组(N = 267)和D+T+安慰剂组(N = 265),主要终点为研究者评估的PFS(RECIST V 1.1),次要终点包括OS、 ORR、 DCR、 安全性、 PROs以及PK。研究预设三联组的PFS比两药组延迟5个月。
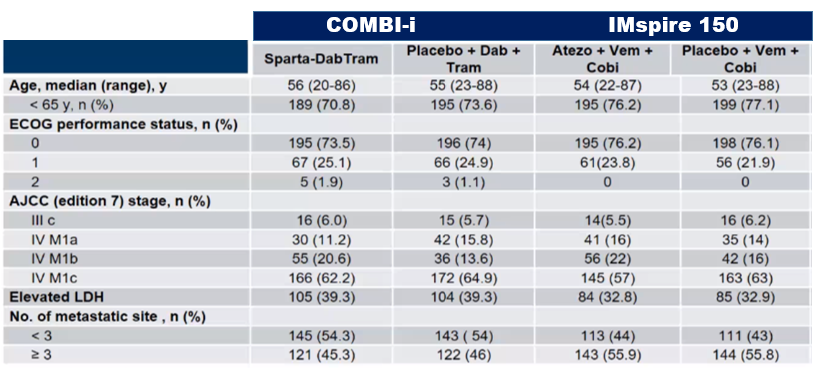
两组患者的基线平衡,且与IMspire-150研究类似,但转移病灶数大于3个的患者在本组研究中较少。数据截止日为2020年7月1日,中位随访 时间27.2个月,最短随访时间为24个月。
主要结果
主要终点三联组研究者评估的PFS为16.2个月(12.7-23.9),D+T+安慰剂组为12.0个月(10.2-15.4),数值上有优势,但未达到预设的5个月的PFS延长,即便进展风险有所降低(HR = 0.820),同样与KEYNOTE-022类似,没有达到统计学预设的显著性差异(单侧检验P值= 0.042,预设的P值为0.02497),故为阴性结果。
横向比较
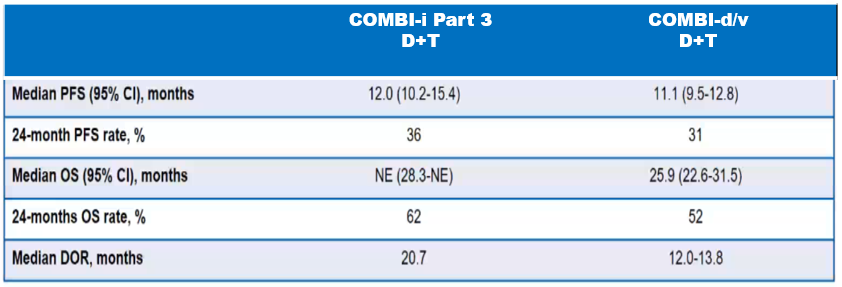
与前两项研究比较,12和24个月的OS率,COMBI-i研究的三联组均优于其他两个研究,但是两药组也同样更优,具体原因猜想请参照思考中的第2点。
安全性
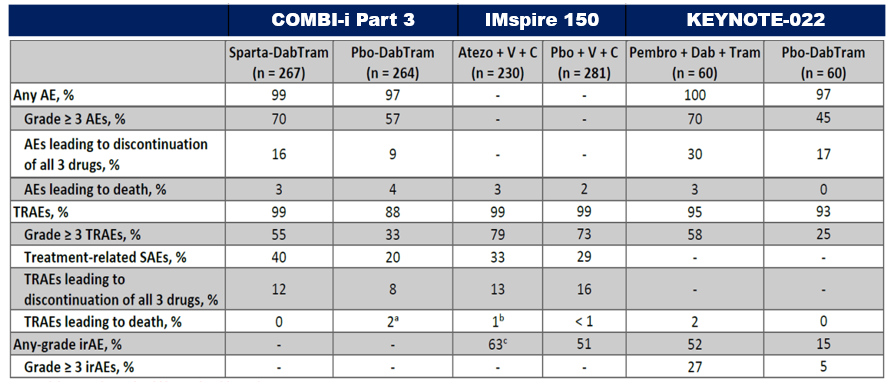
D+T+Spartalizumab三联组的安全性特征与既往三联治疗研究类似,治疗相关3级以上AE三联组为23.3%,双靶组为11.0%;由AE导致的任一药物停药率:三联组为31.8%,双靶组为14.4%。AE导致的剂量调整发生率分别为88.0%和72.7%。作为一种新型的PD-1抑制剂,Spartalizumab表现出的不良反应谱与其他PD-1抑制剂也是一致的。
关于COMBI-i的思考
研究设计的问题?
唯一成功的IMspire 150研究设置了靶向药物的导入期,可能有两大优势,其一是降低了三药联合的毒副作用,提高了耐受性;其二是利用靶向治疗提前杀死部分肿瘤细胞,释放大量肿瘤抗原,提高免疫治疗效果。另外PD-L1单抗可能通过阻断DC细胞表面的B7.1与T细胞表面的PD-L1结合,从而弥补了BRAF突变的黑色素瘤抗原呈递缺陷的问题,而这恰恰是PD-1单抗所缺乏的。
另外可能就是在统计学设计方面,COMBI-i和KEYNOTE-022在设计终点上可能都过于“自信”
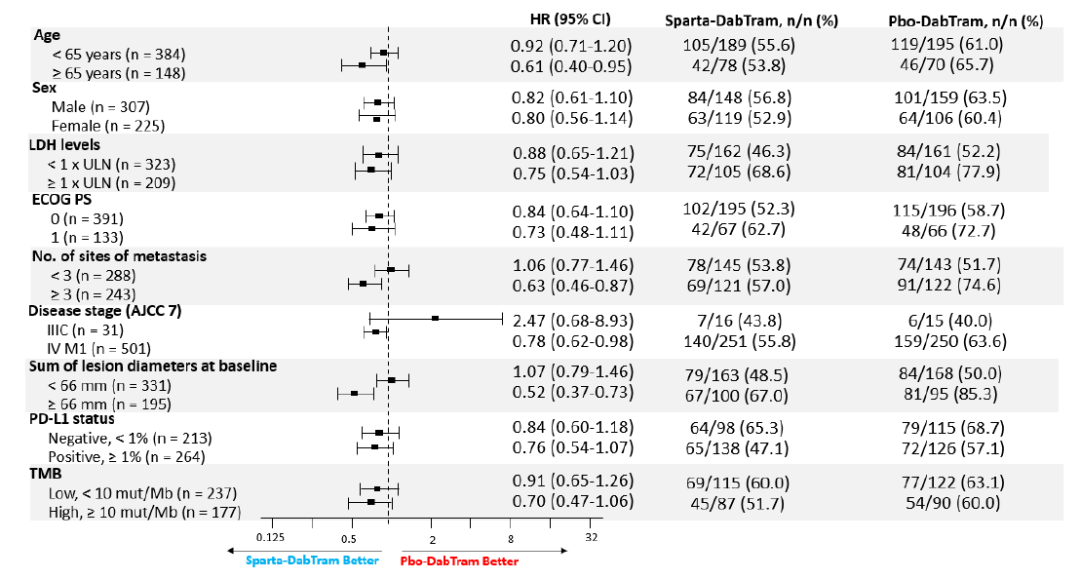
从疗效亚组分析回头看入选患者
从PFS亚组分析结果看,≥65岁、转移病灶≥3个,肿瘤负荷大的(≥66mm)是三药组明显获益的患者,而在既往研究中发现转移病灶≥3个可能是双靶获益较少的人群(Long GV, et al. Lancet Oncol. 2016;17(12):1743-1754),而本组研究中转移病灶≥3个的患者要低于IMspire 150研究。这可能也部分解释了为什么COMBI-i研究中两药组患者的疗效要明显优于KEYNOTE-022和IMspire150研究,甚至高于COMBI-d/v研究。因此,由于患者筛选的问题,导致了对照组D+T+安慰剂组表现超出预期,也可能是造成阴性结果的一大原因。
TMB是否可以作为选择三联治疗的标记物?
在COMBI-i研究中,我们看到一个既往三联治疗中没有的亚组分析结果:TMB高(≥10mut/Mb)的患者PFS显著更高,但并没有统计学差异,但有可能为后续三联治疗的优势人群指明新的方向。但在中国临床实践中,鲜有TMB高(≥10mut/Mb)的患者。
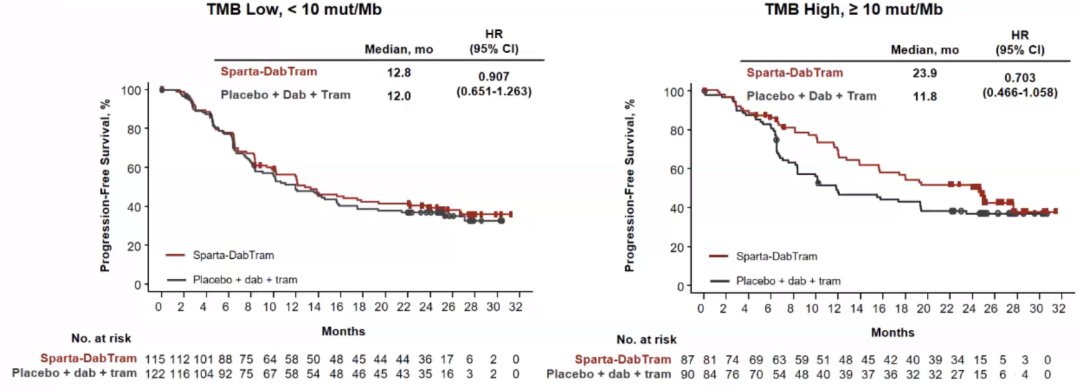
横向比较
三大研究的设计是否合理?目前已经公布的三联治疗研究的结果,研究终点都设置为研究者评估的PFS,是否合理?而且IMspire 150研究的随访时间仍然不够长。
三个研究的主要终点均为研究者评估的PFS:

安全性
COMBI-i和KEYNOTE-022研究中出现了更高的停药比例,因此三联组更高的剂量调整/中断/停药率可能影响了疗效;缺乏了前期的导入期可能也影响了安全性。
结语
就目前中国的临床实践而言,双靶仍然是BRAF患者的标准治疗。就总体趋势而言,BRAF突变的治疗在免疫治疗时代已经走到了一个瓶颈期。COMBI-i研究显示,≥65岁的老年患者,转移病灶≥3个,肿瘤直径≥66mm,或者TMB≥10,也许是三药联合的biomarker,但还需要在我们的临床实践中来验证,特别是中国人的临床实践。
中秋佳节即将来临,用“佳偶良缘”这四个字送给BRAF抑制剂和PD-1/L1单抗,着实应景。也祝愿天下人阖家欢乐,有情人终成眷属。
斯璐 写于2020.9.20,北京