靶向+TACE治疗病情进展? 免疫联合治疗为患者带来CR!
目前,晚期肝癌的一线治疗主要还依靠靶向药物的单一模式,但目前临床常用的靶向药物都属于多靶点酪氨酸激酶抑制剂,仍无法满足精准治疗需求,并且由于肝癌的逃逸机制使得靶向治疗的效果差强人意。目前PD-1单抗联合治疗的临床证据已初见成效,本期将分享一例PD-1单抗+介入及靶向药物联合治疗经TACE联合靶向治疗失败的原发性晚期肝癌病例。

基本情况
一般资料:患者男性,50岁。
主诉:食欲下降1月,右上腹部疼痛10天。
现病史:
患者于1个月前出现食欲减退,近10天出现右上腹疼痛。2020年1月10日于外院就诊, 行腹部CT考虑“肝硬化、脾大;肝右叶占位,考虑肝癌并门脉癌栓”。
既往史:既往体健,有乙肝病史,控制良好;吸烟史不详,饮酒史不详,否认其他慢性病史和过敏史。
ECOG PS评分:0分。
实验室检查:术前实验室检查血常规、凝血功能正常。HBsAg阳性;HCV-RNA阴性。
肿瘤标志物:CA199 116.7 U/ml、AFP 17892 ng/ml;CEA正常。肝功能分级:Child-Pugh A级,5分 ALB 41.1 g/L,TBIL 13.9 μmol/L ,PT:11.1s。
腹部CT:基线期腹部CT示肝右叶示长径约为15.0 cm肿块,瘤周散在小结节,均可见廓清征象,门静脉右后支示充盈缺损。
胸部CT:未见明显异常。
诊断:1. 原发性肝癌,IIIa期,T3N0M0,PS评分 0分,Child-Pugh A级;2. 肝硬化;3. 门静脉血栓;4.脾大。
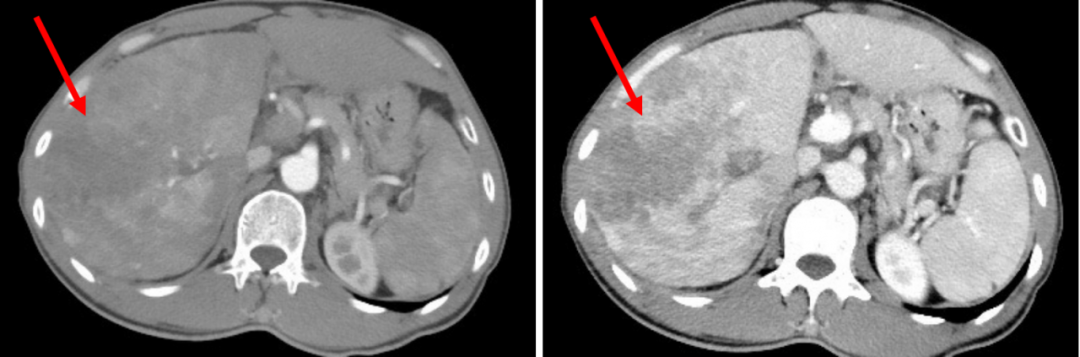
图1:2020年1月30日,基线期腹部CT
治疗经过
01前期治疗
患者经过MDT会诊后,分别于2020年2月1日和4月1日接受TACE介入+索拉非尼靶向治疗。
第1次介入+索拉非尼治疗后,行影像学检查,腹部CT示肝右叶示长径约为15.0 cm肿块,瘤周散在小结节,门静脉右后支示充盈缺损;胸部CT提示双肺多发小结节,左侧为著,考虑转移,疗效评价为PD。
第2次介入+索拉非尼治疗后,行影像学检查,腹部CT示肝右叶示长径约为11.6 cm肿块,内见碘油沉积,门静脉右后支示充盈缺损;胸部CT依旧提示双肺多发小结节,左侧为著,疗效评价依旧是PD。
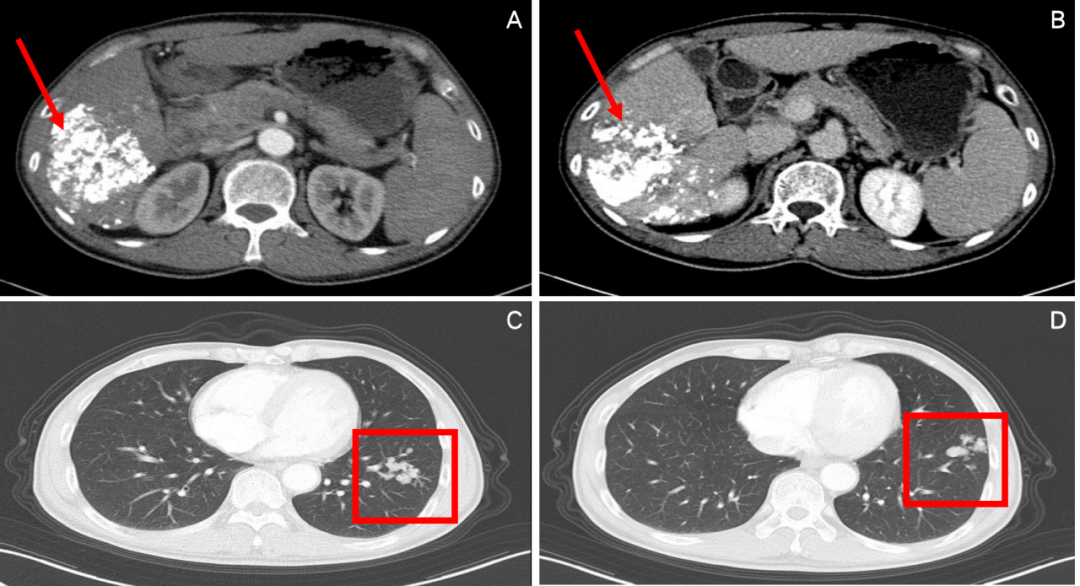
图2:2020年4月,第2次TACE+靶向治疗后腹部CT(A、B)和胸部CT(C、D)
02免疫联合治疗
经患者充分知情同意并签署知情同意书后,首次予以替雷利珠单抗+TACE+靶向联合治疗4周期,后续予以替雷利珠单抗联合靶向治疗至今。
(1)免疫联合治疗2周期:
治疗方案:替雷利珠单抗+TACE+靶向;
腹部CT:肝右叶示长径11.2 cm肿块,局部边缘略示强化,门静脉右后支充盈缺损;
胸部CT:双肺多发结节,左肺为著,较前略好转;
疗效评价:PR。
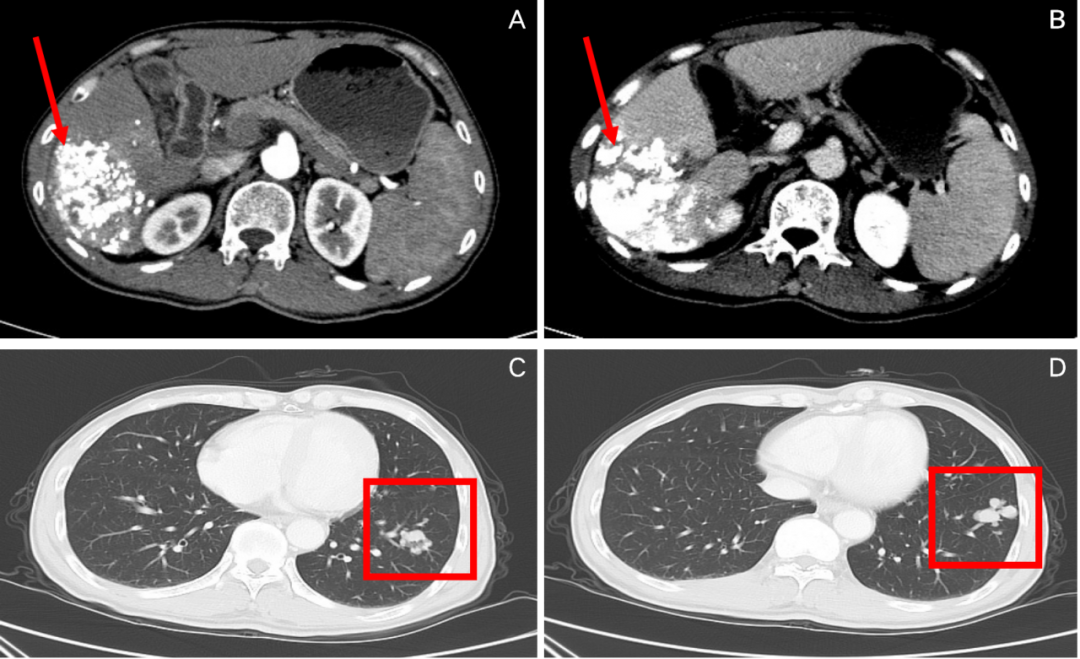
图3:2020年5月,免疫联合治疗2周期后腹部CT(A、B)和胸部CT(C、D)
(2)免疫联合治疗4周期:
治疗方案:替雷利珠单抗+TACE+靶向;
腹部CT:肝右叶不规则团片状肿块,内见碘油沉积及少许低密度影,增强后强化不著,门静脉右后支示充盈缺损;
胸部CT:双肺多发结节,左肺为著,较前明显好转;
疗效评价:PR。
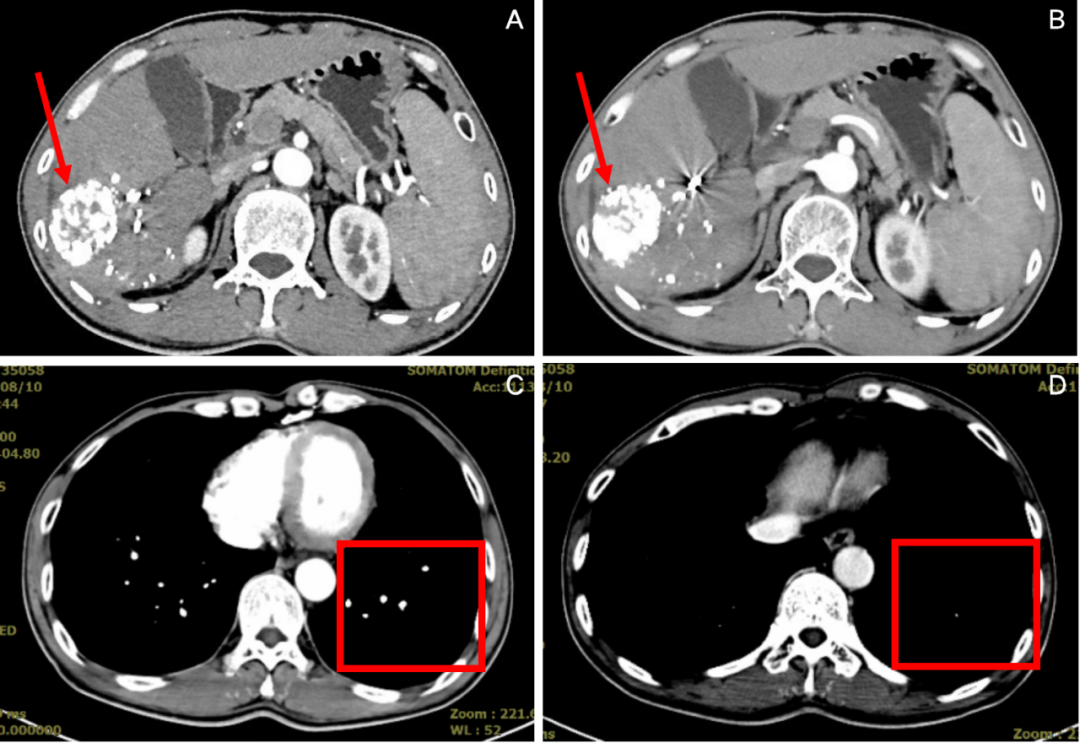
图4:2020年6月,免疫联合治疗4周期后腹部CT(A、B)和胸部CT(C、D)
(3)免疫联合治疗6周期:
治疗方案:替雷利珠单抗+靶向;
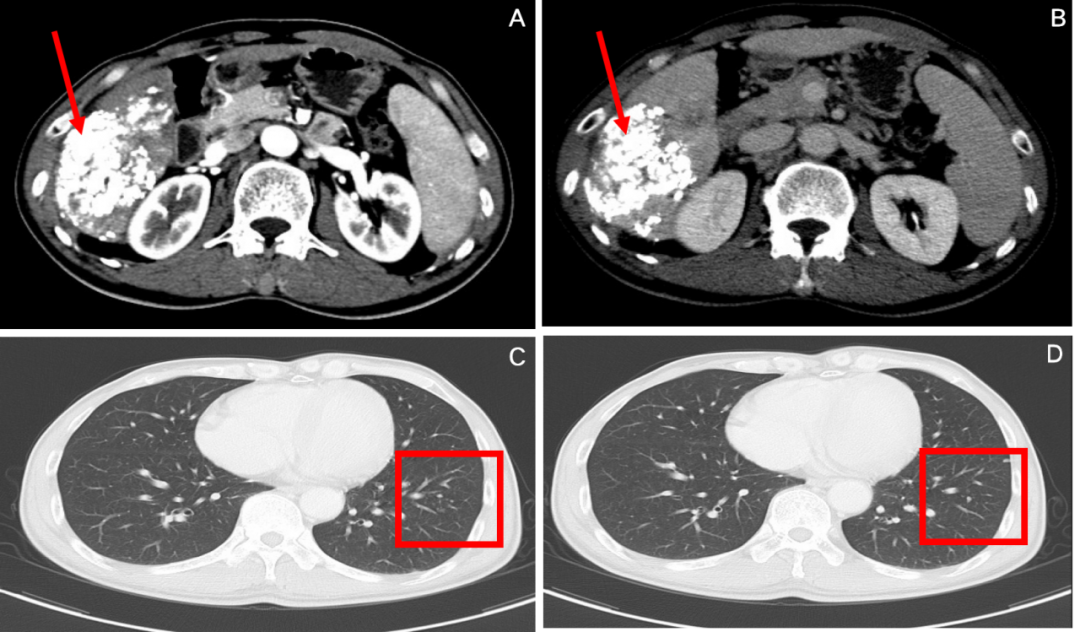
腹部CT:肝右叶不规则团片状肿块,内见碘油沉积及少许低密度影,增强后强化不著,门静脉右后支示充盈缺损;
胸部CT:双肺多发结节,左肺为著,较前明显好转;
疗效评价:CR。
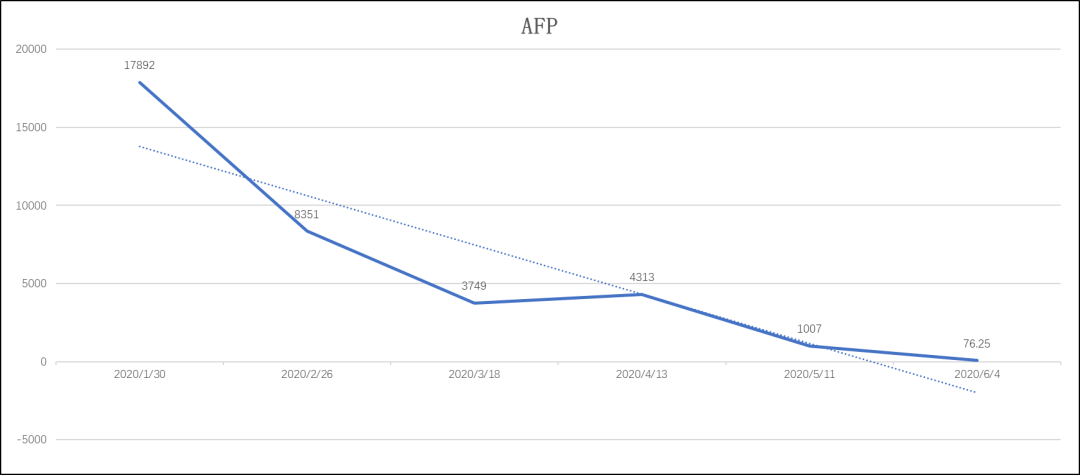
图5:2020年8月,免疫联合治疗6周期后腹部CT(A、B)和胸部CT(C、D)

病例总结
本例为2020年1月10日外院行胸部CT发现肝癌并门脉癌栓的患者,由于并发癌栓阻塞门脉,导致食欲下降1月,右上腹部疼痛10天入院。符合原发性肝癌诊疗规范(2019版);ECOG PS评分:0分;Child-Pugh分级:A级;CNLC分期:IIIa期。
患者经过两次TACE介入联合索拉非尼治疗效果不佳,肝右叶示肿块长径从15.0 cm减小到11.6cm,但是左肺出现了转移灶,CT可见多发结节,临床上达到PD的标准。经临床综合考虑,予以替雷利珠单抗+TACE+靶向联合治疗,2个周期后复查胸腹部CT提示,肝脏靶病灶肿瘤长径为11.2cm,未继续变大,肺部转移灶较前缩小、减少,总体疗效评价达到PR。联合治疗4个周期后患者病情平稳,予以替雷利珠单抗联合靶向二联治疗,2周期后胸腹部CT示肝右叶不规则团片状肿块,增强后强化不显著,提示肿瘤明显坏死、缩小,癌栓坏死、退缩,同时肺部多发结节较前明显减少,左肺转移灶基本消失,总体疗效评价达到CR。
在替雷利珠单抗治疗期间,患者AFP水平也在进行性降低,由17892 ng/ml降至76.25 ng/ml,从侧面反映了肿瘤控制的情况。自免疫治疗至发稿时,患者总生存已超过4个月,治疗过程中整体不良反应可控,安全性良好。
图6:替雷利珠单抗联合治疗期间AFP变化
专家点评
我国肝癌发病率和死亡率高,目前肝癌治疗手段有限,各期患者均存在尚未满足的临床需求。多学科诊疗(MDT)模式可以实现肝癌个体化治疗的需求,并且可以改善预后、节约费用[1,2]。本例患者最初诊断原发性肝癌后,经过MDT会诊,认为患者属于IIIa期不可切除HCC,且肝内病灶较大(>5cm),暂不适合消融治疗、放疗及粒子置入治疗,因此考虑予以患者系统化疗、或参加临床试验、或尝试靶向治疗。然而,患者经过两次TACE+靶向一线治疗后,不但原发灶没有好转,反而有了肺转移灶进展,治疗效果为PD,亟需更换或加强治疗方案。
回顾过往临床研究,目前临床广泛可及的靶向药物按RECIST标准来评价其客观缓解率(肿瘤缩小30%以上)均未超过20%[3-7],中位生存时间也往往只有1年左右,单药疗效差强人意。随着人们发现免疫疗法可以通过使自身免疫系统正常化来抗击肿瘤细胞,从而控制肿瘤的转移和扩散,为患者带来了新的希望,国际及国内指南也将免疫治疗列入晚期HCC二线治疗新选择。近期有研究显示,PD-1单抗联合靶向药物的客观缓解率高达36%[8],为晚期肝癌患者带来新的曙光。在晚期肝癌患者的治疗方案选择中,免疫联合策略有望成为未来的标准治疗。
替雷利珠单抗作为目前唯一一款经Fc段特殊改造的PD-1单抗,其Fc段与Fc&γ;R结合,不诱导ADCP效应,可在巨噬细胞数量较多的器官(如肝脏)中,潜在发挥更优的T细胞激活效应,提高抗肿瘤活性。此外,替雷利珠单抗与PD-1的结合面和PD-1/PD-L1的结合面的重叠面高达82%,与PD-1的亲和力较高,抗体结合抗原的能力较强,能够更彻底地阻断PD-1/PD-L1的结合,极大地降低了脱靶效应的发生概率,进一步增强了药物的临床有效性[9,10]。
在2019 CSCO的一项口头报告中[11],替雷利珠单抗治疗中国不可手术的晚期HCC患者ORR达17%,DCR为56%。此外还有研究显示[12],替雷利珠单抗单药治疗经治晚期肝癌患者的ORR达到12%,DOR达到15.7个月。其中,替雷利珠单抗单药治疗晚期二线肝癌患者的ORR高达18.8%,DCR高达56.3%,在同类药物中处于领先水平[13-17]。值得一提的是,相比其他同类研究,该项研究中纳入了超过92%的肝炎病毒感染者,更符合我国国情。
基于此,我们将该患者的治疗方案调整为替雷利珠单抗+TACE+靶向联合治疗。患者接受新的治疗方案2个周期之后,原发病灶肿瘤直径较前缩小,肺转移灶较前略缩小、减少,临床治疗效果达到PR。再次经过2个周期联合治疗后,患者原发灶较前无明显变化,肺部转移灶较前明显缩小、减少,疗效持续PR。由于肝原发灶已得到控制,未发现肿瘤进展,暂停TACE治疗,继续使用替雷利珠单抗联合靶向治疗,2周期后复查提示原发病灶未见肿瘤组织,肺转移灶显著好转,患者的影像学表现达到了CR。
替雷利珠单抗独特的药学特性,能够发挥良好的抗肿瘤效果,在一众PD-1抗体药物中脱颖而出。本例患者若在一线治疗时就使用免疫联合方案,或许会比现在更早获得CR,并进一步延长患者的生存。免疫联合用药方案的疗效令人振奋,达到了“1+1>2”的效果,可能会作为晚期肝癌患者一线治疗的优选方案,为我国晚期肝癌患者带来了巨大的生存希望。
参考文献
[1] Thayer D, Noda C, Charalel R, et al. Survival comparison of hepatocellular carcinoma patients treated with radioembolization versus nonoperative/interventional treatment[J]. J Comp Eff Res, 2018, 7:343-356.
[2] Liu X, Wang Z, Chen Z, et al. Efficacy and safety of transcatheter arterial chemoembolization and transcatheter arterial chemotherapy infusion in hepatocellular carcinoma:a systematic review and meta- analysis[J]. Oncol Res, 2018, 26:231-239.
[3] Llovet JM. et al. Sorafenib in advanced hepatocellular carcinoma(SHARP). N Engl J Med, 2008, 359(4): 378-390.
[4] Cheng AL. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial(Oriental). Lancet Oncol, 2009, 10(1): 25-34.
[5] Cheng AL. et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma according to baseline status: subset analyses of the phase III Sorafenib Asia-Pacific trial(Oriental). Eur J Cancer, 2012, 48(10): 1452-1465.
[6] Jordi Bruix. et al. 2016 APASL annual meeting, O-140.
[7] Masatoshi Kudo, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. REFLECT. Lancet 2018; 391: 1163-73.
[8] KEYNOTE-524, 2020 ASCO.
[9] Dahan R, et al. Fc&γ;Rs Modulate the Anti-tumor Activity of Antibodies Targeting the PD-1/PD-L1 Axis. Cancer Cell. 2015;28(3):285-95.
[10] Zhang T, et al. The binding of an anti-PD-1 antibody to Fc&γ;RΙ has a profound impact on its biological functions. Cancer Immunol Immunother. 2018;67(7):1079-1090.
[11] 沈琳,2019 CSCO.
[12] BGB-A317-001.
[13] Zhu AX, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib(KEYNOTE-224): a non-randomised, open-label phase 2 trial. KEYNOTE-224. Lancet Oncol. 2018 Jul;19(7):940-952.
[14] Richard S. Finn, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. J Clin Oncol. 2020 Jan 20; 38(3):193-202.
[15] Meyer T, et al. Ramucirumab in advanced hepatocellular carcinoma and elevated α-fetoprotein following sorafenib: outcomes by prior transarterial chemoembolisation from two randomised, double-blind, placebo-controlled phase 3 studies(REACH-2 and REACH). Ann Oncol. 2019 Jul;30 Suppl 4:iv133.
[16] Bruix J, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment(RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017 Jan 7;389(10064):56-66.
[17] Abou-Alfa GK, et al. Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. CELESTIAL. N Engl J Med. 2018 Jul 5;379(1):54-63.