九月新药公布!覆盖五大癌症,十六款重磅抗癌新药免费用的机会来了!
在人类与癌症的斗争中,药物治疗是一个很重要的措施,有效的抗癌药物,可以帮助患者获得治愈的机会和更长的生存时间。2020年截止到9月份,FDA已经批准了30多款癌症新疗法,让更多幸运的病友等到了更多的治疗选择和希望。然而这些上市的新药都远在美国,并且价格昂贵,对于大部分国内患者来说只能望药兴叹。
好消息是,目前国外上市的以及中国自主研发的众多抗肿瘤新药都开始招募国内患者了!这意味着,国内的患者也终于有机会免费用上这些堪称天价的抗癌新疗法!无癌家园医学部总结了目前已经正式在美国上市,或者已经有明确临床数据的涉及肺癌,胃癌,实体肿瘤在内的16款重磅新药在国内各大肿瘤中心临床招募的信息,帮助患者免费用到新型抗癌药物,获得更长的生存期和更多的治疗机会。
注:所有的招募信息均由药厂提供,感兴趣的病友扫描下方二维码填写基本信息,全球肿瘤医生网医学部招募团队将会协助您参加匹配的临床试验,招募信息将会不断更新,建议大家添加文末医学顾问二维码,随时获取最新招募信息。
非小细胞肺癌
1.MET抑制剂-伯瑞替尼
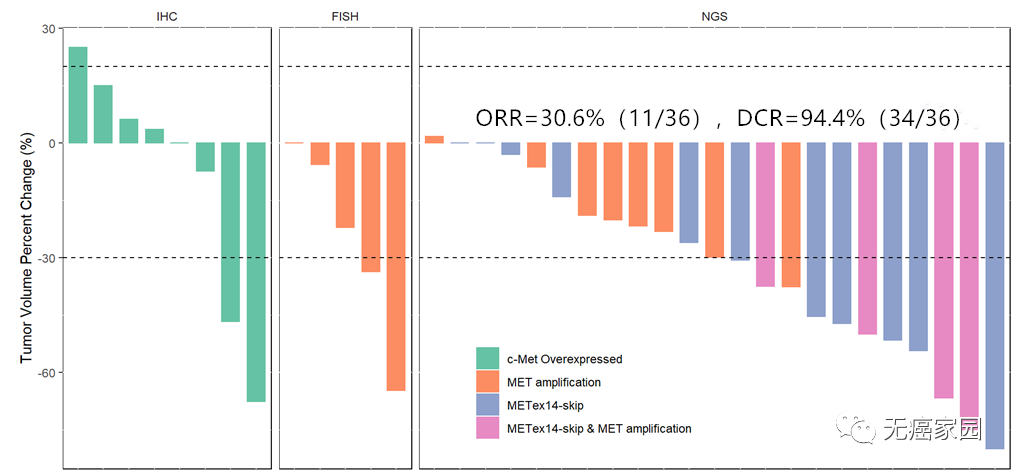
伯瑞替尼是我国自主研发的一款专门针对MET 14外显子跳跃突变的抑制剂,在近期AACR大会上报道的数据显示:在所有36例可评估疗效的患者中,伯瑞替尼的客观缓解率(ORR)为30.6%(11/36) ,疾病控制率(DCR)为94.4%(34/36)。目前,伯瑞替尼的Ⅱ期临床招募正在进行中,符合以下条件并经过专家评估后成功入组的患者有机会免费用药。原文链接:疾病控制率94.4%!肺癌新药伯瑞替尼临床试验招募进行中
适合患者:
经组织学或细胞学确诊的非小细胞肺癌,证实具有c-Met 14外显⼦跳跃突变,未使⽤过克唑替尼。
实验名称:
一项在c-MET异常的晚期非小细胞肺癌患者中评估伯瑞替尼肠溶胶囊有效性和安全性的多中心、多队列、开放的Ⅱ期临床研究
纳入标准(部分):
1、年龄≥18,男性或女性;
2、经组织学或细胞学证实的晚期非小细胞肺癌患者;
3、EGFR wt、ALK重排阴性、ROS1重排阴性、KRAS突变阴性;
4、经证实存在c-Met异常,c-Met异常,包括以下两种类型:
①c-Met外显子14突变;②c-MET扩增,GCN≥6;
5、ECOG评分0~1分;
6、预期生存期≥3个月等。
2.MET抑制剂-谷美替尼
谷美替尼(SCC244)也是一款国内自主研发的络氨酸激酶受体(MET)抑制剂,又称c-MET抑制剂,主要针对三类MET突变的患者。与其他c-MET抑制剂相似,谷美替尼有缓解率高、安全性良好等多个特点。目前,谷美替尼治疗非小细胞肺癌的临床试验正在招募患者。
适合患者:MET 14 外显⼦跳变或MET扩展(GCN≥5)MET蛋⽩过表达且既往标准治疗失败(含铂化疗⽅案),化疗不耐受或者不适合进⾏化疗的局部晚期和转移性⾮⼩细胞肺癌(包括肺⾁瘤样癌)的患者
纳入标准(部分):
1、年龄18~80岁(含两端),男性或女性;
2、Ⅲb/Ⅳ期非小细胞肺癌(包括肺肉瘤样癌);
3、存在c-MET改变;
4、详细纳入及排除标准可咨询全球肿瘤医生网医学部。
3.EGFR ex20in抑制剂-JMT-101
2019年,我国自主研发的、专门针对EGFR ex20in患者的新药JMT-101已经获得批准投入临床试验!并且在2020年ASCO线上会议中,首次公布了这款药物治疗晚期结直肠癌患者的试验结果,疾病控制率达到100%,引起轰动。目前JMT-101治疗多种实体瘤的Ⅰ期临床试验已经陆续开始。其中,治疗非小细胞肺癌的Ⅰb期试验正在招募患者。原文链接:疾病控制率100%,我国自主研发广谱新药JMT-101重磅登场!临床招募进行中
适合患者:
经组织学或细胞学确诊的ⅢB或Ⅳ期NSCLC,不适合进⾏根治性⼿术或放疗,且证实具有EGFR 20号外 显⼦插⼊突变(包括重复突变),初治或⼀线治疗失败后的患者。
试验名称:
评价JMT101联合阿法替尼或奥希替尼治疗EGFR 20号外显子插入突变的ⅢB 或Ⅳ期非小细胞肺癌患者的安全性和有效性的Ⅰb期临床研究
纳入标准(部分):
1、年龄18~75(含)周,性别不限;
2、ⅢB或Ⅳ期非小细胞肺癌,不适合进行根治性手术或放疗,且证实具有EGFR 20号外显子插入突变(包括重复突变),初治或一线治疗失败后的患者;
3、基线至少存在一个符合RECIST 1.1标准定义的可测量的病灶;
4、ECOG体能状态评分:0或1分;
5、预计生存时间≥3个月等。
4.ALK抑制剂-CT-707
我国自主研发的1类创新药CT-707,也是全新结构的二代ALK抑制剂在国际上大放异彩。在北京协和医院进行的Ⅰ期临床试验数据显示,不管是初治的患者,还是克唑替尼耐药的患者,CT-707的有效率均在85%以上,疾病控制率均为100%!这款药物堪称国药之光!目前,一项评价 CT一 707 治疗克唑替尼耐药的晚期 ALK 阳性非小细胞肺癌患者有效性和安全性的 二期多中心临床研究正在招募患者。
适合患者:
经组织学或细胞学确诊的NSCLC,证实具有ALK阳性,克唑替尼治疗失败后未使⽤过其他ALK抑制剂, 无症状且不需要临床⼲预的脑转移NSCLC患者。
纳入标准(部分):
1.年满 18 一 75 周,男女不限;
2.克唑替尼耐药后
3.近 4 周未参加过其他研究性药物临床研究;女性患者未处在怀孕期,试验期间同意采取避孕措施;
4.既往细胞毒类化疗未超过 2 线;
5.组织学或细胞学检查证实的 ALK阳性。
5.ROS1抑制剂-TQ-B3101
目前,多种针对ROS1靶点的靶向药物已经获得FDA批准或NCCN指南推荐,另有多款药物在研,有望在未来投入临床,服务于患者。一款由国内药企正大天晴药业集团自主研制的ROS1靶点新药TQ-B3101在Ⅰ期试验中展现出了卓越的疗效。在发布于2020 ASCO年会上的数据中,在接受350 mg bid治疗的8例患者中,整体缓解率达到了87.5%;此外,TQ-B3101同样具有通过血脑屏障的能力,在基线有脑转移的8例患者中,整体缓解率达到了62.5%。基于这项卓越的一期数据,二期临床试验也顺利开展了目前正在招募患患者。原文链接:缓解率87.5%!非小细胞肺癌新药TQ-B3101疗效卓越,临床试验招募中
适合患者:
经组织学或细胞学确诊的NSCLC,证实具有ROS1阳性,既往接受过不超过2个化疗⽅案,⽆症状且不需 要临床⼲预的脑转移NSCLC患者
试验名称:
评价TQ-B3101胶囊单药治疗ROS1阳性非小细胞肺癌患者疗效和安全性的II期单臂、多中心临床研究
纳入标准(部分):
1、患者年龄≥18岁;
2、ECOG评分0~1分,预期生存期超过3个月;
4、通过组织学或细胞学证明诊断为局部晚期或转移性非小细胞肺癌;
5、提供ROS1阳性书面报告,或在入组前提供组织学标本、活检组织标本送中心实验室进行检测,并确认为ROS1阳性;
6、既往接受过不超过2个化疗方案(若接受超过2个化疗方案,则需再次进行检测,且检测结果确认为ROS1阳性)。
6.RET-抑制剂-BLU-667
2020年5月8日,全球首款用于治疗RET基因变异的靶向药selpercatinib上市,同时,另一款疗效卓越的RET抑制剂Pralsetinib(BLU-667,帕拉西替尼)也紧跟步伐,预计将于2020年11月23日前做出审批决定。
在2020年5月29日ASCO大会上最新公布的 数据中,显示了帕拉西替尼强大的抗癌功效,NSCLC患者中的总体缓解率(ORR)为61%,95%的患者观察到肿瘤缩小,其中14%的患者达到完全缓解!原文链接:疾病控制率100%!FDA接受抗癌新药pralsetinib(BLU-667) 上市申请!
目前这款药物正在国内进行临床招募。
适合患者:
病理学证实和确诊的携带RET融合的局部晚期或转移性⾮⼩细胞肺癌,且既未往接受过化疗及靶向治疗, 排除存在除RET以外的已知的主要驱动基因改变。
入组条件(部分):
1 非小细胞肺癌患者必须有病理学证实和确诊的携带RET融合的局部晚期或转移性非小细胞肺癌,未接受过治疗。
2 有可测量病灶。
3 同意提供肿瘤组织以进行RET状态确认。
申请方式:
做过基因检测的病友,请将基因检测报告,诊断报告电子版或拍照发送至[email protected],邮件中留下联系方式,医学部将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
小细胞肺癌
7.化疗药物-盐酸米托蒽醌脂质体
盐酸米托蒽醌脂质体为化疗药物,与多柔比星(阿霉素)同属于蒽环类药物,这一类药物的特点在于,它们能治疗的癌种比其他任何类型的化疗药物都要丰富,同时疗效较好,是目前最有效的化疗方案之一。适用蒽环类药物的癌种包括白血病、淋巴瘤、乳腺癌、子宫癌、卵巢癌和肺癌等。目前,米托蒽醌二线治疗小细胞肺癌的临床试验正在招募中。原文链接:“老大难”的小细胞肺癌终结无药悲剧,多款抗癌药迎来一线生机!
适合患者:
经组织学或细胞学确诊的SCLC,仅接受含铂类化疗或放化疗⽅案系统性⼀线治疗,3个⽉后出现疾病进 展或复发的⼩细胞肺癌
实验名称:全国多中⼼(四川、云南、重庆、陕⻄、北京)、随机化、平⾏分组、开放、观察和评 价盐酸⽶托蒽醌脂质体注射液不同给药间隔⼆线治疗⼩细胞肺癌的初步疗效
入组条件(部分):
1、年龄18~70周岁(含两端),性别不限;
2、小细胞肺癌,仅接受含铂类化疗或放化疗方案系统性一线治疗;
3、EGOG评分0~2分,预计生存期≥12周;
4、详细纳入及排除标准可咨询无癌家园医学部。
胃癌/胃食管交界癌
8.Claudin18.2-CAR-T
在实体肿瘤领域,我们国家领跑全球,取得备受世界瞩目的成绩,研发出了国际上首个靶向Claudin18.2的实体瘤CAR-T疗法。
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。基于此,中国研究人员开发了国际上首个针对 Claudin18.2 的 CAR-T 细胞疗法--CT041。
CT041细胞治疗胃癌的临床前研究成果显示,在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
2019 ASCO年会上,CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据更新显示,靶向claudin18.2 CAR T细胞治疗12例转移性腺癌(胃癌7例,胰腺癌5例),未发生严重不良事件、治疗相关死亡或严重神经毒性。
目前,这项试验已经率先由国内胃肠道肿瘤享负盛名的北京大学肿瘤医院胃肠肿瘤科开展,评估自体人源化抗claudin18.2嵌合抗原受体T细胞在晚期实体瘤中的安全性及功效,具体入排标准可向无癌家园位点咨询,我们会全力给予帮助。
适合患者:
经标准治疗失败后的晚期恶性实体肿瘤患者,肿瘤组织样本检测确定表达CLDN18.2;ECOG体⼒评分0- 1分;预计⽣存时间3个⽉以上;各器官功能状态良好。
入组标准(部分):
年龄18至75,男性或女性;
患有病理证实的实体瘤(即晚期胃癌,食管胃交界癌)并且经标准治疗失败的受试者;
Claudin 18.2 IHC染色阳性;
预计寿命> 12周。
9.Claudin18.2-Zolbetuximab(IMAB362)
Zolbetuximab(IMAB362)是一类针对Claudin 18.2靶点的单克隆抗体药物。在2016年ASCO大会上公开的数据中,采用Zolbetuximab+CAPOX化疗方案治疗局部晚期或转移性胃癌患者,中位无进展生存期为7.9个月,中位总生存期13.2个月;明显长于仅采用CAPOX化疗方案的4.8个月和8.4个月。在2019年公开的Ⅱ期研究数据中也证实,Zolbetuximab治疗晚期胃癌或胃食管交界处癌或食道腺癌患者,临床获益率达到23%。
目前,Zolbetuximab已经获得FDA的批准进行Ⅲ期临床试验,有望尽快得到更有价值的大型疗效数据。近期,Zolbetuximab治疗局部晚期不可切除或转移性胃及胃食管交界处腺癌患者的临床试验获得国家药品监督管理局批准,正式开始在中国招募患者。
适合患者:
局部晚期不可切除或转移性、CLDN18.2阳性和HER2阴性,未接受过任何放、化疗,靶向等治疗的初治 成⼈胃和胃⻝管交界(GEJ)腺癌患者
入组标准(部分):
成年患者,年龄≥18岁;
经组织学证实诊断为胃或胃食管交界处腺癌;
接受临床试验前28天内经影像学证实为局部晚期不可切除或转移性疾病;
受试者的肿瘤有≥75%肿瘤细胞表达CLDN18.2,中心实验室IHC检测确定有中至重度膜染色;
HER2阴性;
ECOG评分为0或1分;详细纳入标准可咨询无癌家园医学部。
10.血管生成抑制剂-金妥昔单抗
我国药企针对雷莫芦单抗相同靶点人血管内皮生长因子受体2(VEGFR2/KDR)进行深入研究、攻坚克难,研制出了“国产版雷莫芦单抗”(Me-Too产品)金妥昔单抗,为胃癌患者生存助力!
目前,金妥昔单抗在国内的Ⅰb/Ⅱ期临床研究已经展开,计划招募76例晚期胃及胃食管结合部腺癌患者,挑战二线治疗方案!
适合患者:
经组织学诊断的晚期或转移性胃或胃⻝管结合部腺癌患者,且既往接受过含铂类联合氟尿嘧啶类药物⼀ 线化疗期间或治疗结束后3个⽉内疾病进展,未接受过抗⾎管⽣成类药物或紫杉醇治疗者。
入组标准(部分):
年龄18~75周,性别不限;
经组织学诊断的晚期或转移性胃或胃食管结合部腺癌患者,且既往接受过含铂类联合氟尿嘧啶类药物一线化疗期间或治疗结束后3个月内疾病进展(辅助或新辅助治疗期间或治疗结束后6个月内疾病进展的受试者可以入组);
根据RECIST1.1实体瘤疗效评价标准至少有一个可测量病灶(即存在实体病灶);
ECOG体力状况评分0~1分;
肝内胆管癌/膀胱癌
11.FGFR抑制剂-ICP-192
ICP-192为我国药企自主研发的第二代泛FGFR抑制剂,对FGFR家族四个激酶均有很强的抑制效果。多种FGFR抑制剂的临床试验数据表明,很多FGFR变异类型的患者均可在FGFR抑制剂治疗中获益。
ICP-192为二代泛FGFR抑制剂药物,具有特异性更强、药效更持久、对耐药突变仍然有效且有效性及安全性更高的特点,临床前研究已经展现出了出色的潜力。目前,ICP-192治疗胆管癌和膀胱癌的临床试验均在招募患者中。
适合患者:
组织或细胞病理学证实的不可切除、复发或转移性存在 FGFR2 易位/融合胆道恶性肿瘤,⾄少⼀线化疗 失败或不能耐受⼀线化疗(需⾄少接受过两个周期),新辅助/辅助化疗后 6 个⽉内进展/复发可以⼊选;
接受过⼀线治疗失败或者不适合含顺铂⽅案治疗的晚期(膀胱)尿路上⽪癌患者;存在FGFR2/3基因融 合( FGFR2-BICC1、FGFR2-CASP7、FGFR3-TACC3、FGFR3-BAIAP2L1);FGFR3基因突变(R248C、S249C、 G370C、Y373C ) 。
入组标准(部分):
1、年龄≥18周,性别不限;
2、不可切除或转移性膀胱尿路上皮癌或肝内胆管癌;
3、至少具有以下一种基因异常:FGFR3基因突变:R248C、S249C、G370C、Y373C;基因易位/融合:FGFR2-BICC1、FGFR2-CASP7、FGFR3-TACC3、FGFR3-BAIAP2L1;
4、ECOG体力评分为0~1分,预计生存期3个月以上;
5、详细纳入及排除标准可咨询无癌家园医学部。
不限癌种实体肿瘤
12.NTRK抑制剂-Larotrectinib
去年7月,拉罗替尼将在国内开展临床招募的信息公布后,引起了广泛的关注,经过半年多的审批流程,近日,广谱天价抗癌药拉罗替尼针对成人实体瘤和儿童实体瘤的两项试验终于正式在国内开始招募患者了!这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!原文链接:终于来了!堪称天价的“治愈系”抗癌药拉罗替尼正式在国内开展临床试验!
这项研究是为了验证拉罗替尼对不同类型的肿瘤疗效。这些肿瘤必须存在一种特定的基因变化(NTRK1, NTRK2或NTRK3)。Larotrectinib是一种试验性的药物,可以阻止这些NTRK基因在癌细胞中的作用,因此可以用来治疗肿瘤。
适合患者:
通过分⼦学⽅法检测出NTRK1、NTRK2或NTRK3融合基因的局部晚期或转移性恶性肿瘤,必须接受过 适合其肿瘤类型和疾病分期的既往标准疗法失败后的患者(即将招满,想申请的火速联系医学部)
13.NTRK抑制剂-Entrectinib
2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,目前恩曲替尼针对成人实体瘤的临床试验终于正式在国内开始招募患者了!
适合患者:
经组织学或细胞学确诊为局部晚期或转移性实体瘤,携带NTRK1/2/3基因融合/重排,且不同时存在第⼆ 种致癌因素(例如EGFR、KRAS)
入组标准(部分):
1. 经组织学或细胞学确诊为局部晚期或转移性实体瘤,而且根据Foundation Medicine, Inc.或CLIA认证或同等机构认可的当地诊断实验室采用任何核酸类诊断检测方法进行的检测,该肿瘤携带一种预计分别转化成具有一个功能性TrkA/B/C、ROS1 或ALK激酶结构域的融合蛋白的NTRK1/2/3、ROS1或ALK基因重排,且不同时存在第二种致癌因素(例如EGFR、KRAS);
2. 对于通过当地实验室分子检测入组的患者,要求提交存档或新鲜的肿瘤组织(除非存在医学禁忌),在Foundation Medicine, Inc.(不服不行!全球肿瘤基因检测行业标杆-Foundation Medicine!)或该地区其他认可的中心实验室进行孤立中心分子检测;
3. 根据当地采用RECIST v1.1进行的评估,疾病可测量。
14.NTRK抑制剂-TL118
TL118胶囊是一款国产“不限癌种”NTRK融合基因突变靶向药,全球上市的同样用于治疗NTRK融合基因实体瘤的药物有两个,分别是拜耳/LOXO的拉罗替尼(2018年11月被FDA批准上市)以及罗氏的恩曲替尼(2019年8月被FDA批准上市)。目前国内已开展TL118治疗晚期NTRK融合实体肿瘤的临床试验。
适合患者:
经病理组织学和/或细胞学确诊的局部晚期或转移性恶性实体瘤,既往检测存在NTRK基因融合突变, ECOG体⼒评分0-2分,⾄少有⼀个可评估的肿瘤病灶。
试验题目:TL118胶囊在NTRK基因融合的晚期恶性实体瘤患者中的安全性、耐受性、药代动力学特征的剂量递增、开放的I期临床试验
15.化疗药物-莱古比星
莱古比星是一类我国自主研发的新型蒽环类化疗药物,基于多柔比星偶联而成,可以降低药物的心脏毒性及其对免疫系统造成的损伤,同时延长药物在患者体内的半衰期,同时能够达到在抑制肿瘤生长的同时促进抗肿瘤免疫反应的双重效果。
由于这样的特点,与多柔比星相比,莱古比星对于正常细胞的伤害更小,造成的心脏毒性、过敏性、溶血性及血管与肌肉刺激性更小,安全性更高。临床前试验证实,莱古比星联合PD-1抑制剂治疗,完全缓解率可达到多柔比星联合PD-1抑制剂的7倍!同时,莱古比星对于肝内病灶及骨转移有良好的治疗效果。目前,莱古比星的Ⅰ期临床试验正在招募患者。
适合患者:
经标准治疗失败后的晚期恶性实体肿瘤患者,⽆枢神经系统转移或脑膜转移;近半年未使⽤过pd-1,⽆ 酒精过敏,既往未接受过多柔⽐星或其他蒽环类药物治疗,⽆传染病,⼼功能正常,⽆恶性积液。
入组标准(部分):
1、年龄18~75周岁(含两端),性别不限;
2、晚期恶性实体肿瘤;
3、ECOG体力评分0~1分,预计生存时间≥3个月;
4、详细纳入及排除标准可咨询无癌家园医学部。
16.PARP抑制剂-CVL218
CVL218是一款针对多种晚期或转移性恶性肿瘤的广谱抗癌药,属于PARP抑制剂,主要针对 BRCA1 或 BRCA2 基因突变的患者。目前正在招募的癌种虽非全部实体瘤,但基本涵盖了常见癌种。
与同为小分子PARP抑制剂药物的奥拉帕利等相比,CVL218的生物利用度更高、疗效更好,无明显蓄积、安全性更好,制剂稳定性高、储存简单、方便使用,能穿过血脑屏障、可治疗脑部病灶,多组织中药物浓度高、适应症更广,选择性更强、脱靶毒性更低。
目前,CVL218的临床试验正在招募的癌种包括乳腺癌、前列腺癌、肺癌、膀胱癌、胃癌、肠癌、胆道肿瘤、胰腺癌、黑色素瘤、脑胶质瘤等。
适合患者:
经标准治疗失败后的晚期恶性实体肿瘤患者,⽆枢神经系统转移或脑膜转移;有证据能证实存在胚系或 体系BRCA基因突变,既往未使⽤过以PARP为靶点的抗肿瘤药物
入组标准(部分):
1、年龄18~75岁(含两端),性别不限;
2、BRCA1或BRCA2突变阳性的晚期或转移性恶性肿瘤,包括乳腺癌、前列腺癌、肺癌、膀胱癌、胃癌、肠癌、胆道肿瘤、胰腺癌、黑色素瘤、脑胶质瘤等;
3、ECOG评分0~1分;